重组人降钙素原的制备及发酵优化*
2022-09-24霍景瑞孙文杰张晶晶张国安杨晓晖刘英富
霍景瑞,孙文杰,张晶晶,张国安,张 艳,杨晓晖,刘英富
沧州医学高等专科学校/沧州纳米抗体技术创新中心,河北沧州 061000
降钙素原(PCT)是由甲状腺滤泡旁细胞合成的一种非激素类蛋白,相对分子质量约为14×103[1-2]。PCT是降钙素的前体产物,在健康人血清中水平不超过50 pg/mL。脓毒症、败血症、急性胰腺炎、术后细菌感染等患者的PCT水平能达到正常水平的数千至数万倍[3-4]。PCT是早期鉴别诊断严重细菌感染、脓毒症较好的观察指标之一,主要用于全身细菌感染诊断及鉴别诊断,还可辅助临床快速鉴别细菌感染和病毒感染,判断感染严重程度,辅助临床开始使用或停用抗菌及抗病毒药物等[3-5]。床旁PCT快速检测在指导非传染性疾病(包括终末期肾病、充血性心力衰竭、慢性阻塞性肺疾病和肝硬化)患者的诊断、治疗和预后评估中有很好的应用前景[6-7]。
PCT检测试剂盒常被用于体外定量检测人血清、血浆或全血中PCT的含量。以PCT为检测指标的酶联免疫吸附试验(ELISA)、胶体金检测、化学发光检测、时间分辨免疫荧光检测等方法[5]的检测过程和所需仪器各有不同,但都需要将PCT作为标准蛋白进行参比[8]。本文拟构建PCT原核表达质粒,以大肠杆菌为宿主细胞,采用原核表达的方式,通过细菌培养、亲和层析的方式,获得高纯度的PCT蛋白,并探讨其在试剂盒检测中的应用。
1 材料与方法
1.1主要实验材料及仪器 大肠杆菌DH5α、BL21(DE3)、pET28a均为Novagen公司产品,人胚胎肾细胞293由本实验室保存,核酸限制性内切酶BamHⅠ、XhoⅠ、NdeⅠ购自New England Biolabs公司,质粒提取试剂盒、核酸凝胶纯化试剂盒购自北京康为世纪公司,酵母粉、蛋白胨为英国Oxoid公司产品,诱导剂异丙基β-D-硫代半乳糖苷(IPTG)、消泡剂AntiForm204均购自德国Merck公司,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)相关试剂购自国药集团(北京)化学试剂有限公司,镍柱亲和层析(Ni-NTA)填料购自南京金斯瑞生物科技有限公司,PCT检测试剂盒分别购自Sigma(RAB0037-1KT)、碧云天(Beyotime PP790)、天津生物芯片技术有限责任公司(Tianjin Biochip津械注准20152400067),其他试剂均为国产分析纯。
BioPhotometer D30核酸蛋白测定仪、BioFlo 320发酵罐购自德国Eppendorf公司;CR21N高速冷冻离心机购自日本Himac公司;D-5L高压均质机购自美国PhD公司;NGC蛋白纯化系统购自美国Bio-Rad公司;Milli-Q7000超纯水机购自德国Merck公司;蛋白电泳设备购自美国Bio-Rad公司;Omega LumC凝胶成像系统购自美国Aplegen公司;Spectramax M4酶标仪购自美国MD公司。
1.2方法
1.2.1人PCT基因克隆及pET28a-PCT表达质粒构建 通过美国国立生物技术信息中心(NCBI)数据库查找人PCT蛋白(NP_001365878.1)的氨基酸序列及其核苷酸序列,设计并合成PCT26-141肽段对应核苷酸序列的扩增引物(F:5′-GCATATGGCACCATTCAGGTCTGCC-3′;R:5′-CCTCGAGGTTGGCAT TCTGGGGCAT-3′),以人胚胎肾细胞293总RNA为模板,扩增目的基因。通过分子生物学方法将酶切后的目的基因与pET28a质粒连接,随后导入大肠杆菌DH5α感受态细胞并在肉汤(LB)固体培养基上培养,限制性核酸内切酶(NdeⅠ、XhoⅠ)筛选阳性克隆,委托北京中美泰和生物公司对重组质粒的插入序列进行测序验证;重组质粒导入大肠杆菌DH5α和大肠杆菌BL21(DE3)细胞,用含有卡那霉素的LB抗性平板培养,分别用于重组质粒的保存和重组蛋白的表达。
1.2.2PCT的摇瓶表达 取出-80 ℃保存的重组大肠杆菌BL21(DE3)/pET28a-PCT,用接种环涂布在含50 μg/mL卡那霉素的LB培养基(LBK培养基)平板上,37 ℃培养过夜;从平板上挑取形态饱满、边缘清晰的细菌克隆,接种于LBK培养基(卡那霉素为50 μg/mL)中,37 ℃ 230 r/min振荡培养6 h。将活化的细菌以1∶10的体积比接种于液体LBK培养基中,37 ℃ 230 r/min继续培养并监测培养液在600 nm处的吸光度(A600)。当A600在0.5~0.6时,加入诱导剂IPTG至终浓度0.1~1.0 mmol/L,继续培养4 h。取0.5 mL诱导后的培养液,离心收集细菌沉淀,用40 μL无菌水重悬,加入10 μL样品处理液(5倍浓度)煮沸10 min,12 000 r/min离心1 min,配制聚丙烯酰胺凝胶(12%分离胶和5%浓缩胶),进行SDS-PAGE分析(230 V,400 mA,20 min)。用凝胶快速染色液染色,观察目的蛋白表达情况,筛选表达量高的细菌克隆。
1.2.3重组大肠杆菌BL21(DE3)/pET28a-PCT高密度培养 取出-80 ℃保存的表达量高的细菌,按0.1%的比例接种于LBK培养基中,37 ℃ 220 r/min过夜培养。次日,按5%的比例将种子液接入发酵罐(内含预先灭菌的2×YT基础培养基),初始转速200 r/min,37 ℃培养,用3 mol/L NaOH调节维持培养液pH值在7.2;监测培养液A600,当A600达到(或超过)8.5,加入IPTG使其终浓度为0.2 mmol/L,诱导(4 h)目的蛋白表达。
1.2.3.1发酵温度对目的蛋白表达的影响 细菌培养温度会影响细菌生长速度及目的蛋白的表达量,因此摇瓶培养的最适条件不适用于发酵培养。在发酵过程中,尝试将细菌培养阶段的温度控制在30、37、40、42 ℃,研究温度对发酵时间及目的蛋白表达量的影响。每隔1小时取样测定培养液A600,以A600达到(或超过)8.5作为加入诱导剂的时间点,诱导4 h后,取样并进行SDS-PAGE,分析目的蛋白表达情况,离心收集细菌,称质量记录湿菌量。
1.2.3.2补料速度对目的蛋白表达量的影响 采用优化后的培养温度进行细菌培养,监测细菌生长密度。自A600=1.0起,连续加入预先灭菌的补料培养基(0.1 g/mL胰蛋白胨、0.05 g/mL酵母粉、0.01 g/mL氯化钠、20%甘油),补料速度控制为50、100、150、200 mL/h,IPTG加入时间点及诱导条件同前,筛选适宜的补料速度。
1.2.3.3溶氧量对目的蛋白表达的影响 大肠杆菌为好氧菌,溶氧量直接影响细菌生长速度。采用选定的发酵温度和补料速度进行细菌培养,采用搅拌转速-溶氧联动的方式,将溶氧量分别设置为20%、30%、40%、50%,IPTG加入时间点及诱导条件同前,筛选适宜的溶氧量。
1.2.4重组PCT蛋白的纯化
1.2.4.1细菌破碎 发酵结束后,离心收集细菌(16 ℃,8 000 r/min,10 min),菌体用20 mmol/L Tris-HCl(pH8.0)洗涤后,按质量体积比1∶10的比例重悬,利用高压均质机低温下破碎细菌。离心(16 ℃,13 000 r/min,20 min)收集上清液,0.45 μm滤膜过滤除去杂质后,滤液即可用于目的蛋白纯化。
1.2.4.2镍柱亲和纯化 采Bio-Rad公司的NGC蛋白纯化系统,以Ni-NTA预装柱进行蛋白纯化。配制缓冲液A:50 mmol/L Tris-HCl(内含0.15 mol/L NaCl),pH8.0;配制缓冲液B:50 mmol/L Tris-HCl(内含0.15 mol/L NaCl,500 mmol/L咪唑),pH8.0。向过滤后的上清液中加入咪唑至其终浓度为10 mmol/L。缓冲液A冲洗预装柱5个柱体积后,将上清液以2 mL/min的流速流过纯化柱,2%缓冲液B冲洗10个柱体积,依次用10%、20%、40%、100%缓冲液B进行洗脱。收集各洗脱峰,进行SDS-PAGE检测。
1.2.5重组PCT蛋白的定量分析
1.2.5.1根据BCA法原理测定PCT蛋白水平 按照蛋白定量试剂盒(Pierce #23225)说明书,配制不同水平的蛋白标准品溶液,配制所需体积的蛋白测定工作液。按说明书操作,根据标准品水平和A值绘制标准曲线,根据公式计算蛋白水平。
1.2.5.2用人PCT ELISA检测试剂盒测定纯化的PCT水平 根据试剂盒说明书,稀释不同水平的PCT标准品蛋白,夹心法检测由步骤1.2.3得到的纯蛋白水平。用酶标仪在450 nm波长下测定A值,通过标准曲线计算标定纯化样品中人PCT水平。
1.2.5.3重组PCT蛋白在ELISA试剂盒组成中的应用 用蠕动泵配合超滤膜包(赛多利斯 Vivoflow50)将标定后的重组蛋白水平调整至2 mg/mL,分装于样品管中。以商品化的PCT ELISA检测试剂盒为基础,用重组PCT蛋白替代试剂盒中的标准品蛋白,将重组PCT蛋白用20 mmol/L Tris-HCl缓冲液分别稀释为以下几个水平:4 000.00、2 000.00、1 000.00、500.00、250.00、125.00、62.50、31.25 pg/mL,进行ELISA,绘制水平-吸光度曲线,分析重组蛋白作为标准品应用的可能性[9]。
1.3统计学处理 采用SPSS22.0分析软件进行数据统计,应用GraphPad Prism 5.0软件绘制图表。除特别说明外,每个实验均进行3次重复。
2 结 果
2.1重组人PCT基因克隆和表达质粒的构建 从人胚胎肾细胞293基因组DNA中扩增除信号肽序列外的PCT编码基因。琼脂糖凝胶电泳结果显示,PCR产物条带为250~500 bp,与预期大小(348 bp)相符。回收PCR产物并将其插入pET28a的多克隆位点;转化DH5α后,经测序筛选符合预期的细菌克隆,即为携带PCT表达质粒的细菌,结果见图1。经测序证实重组质粒中目的基因序列正确。
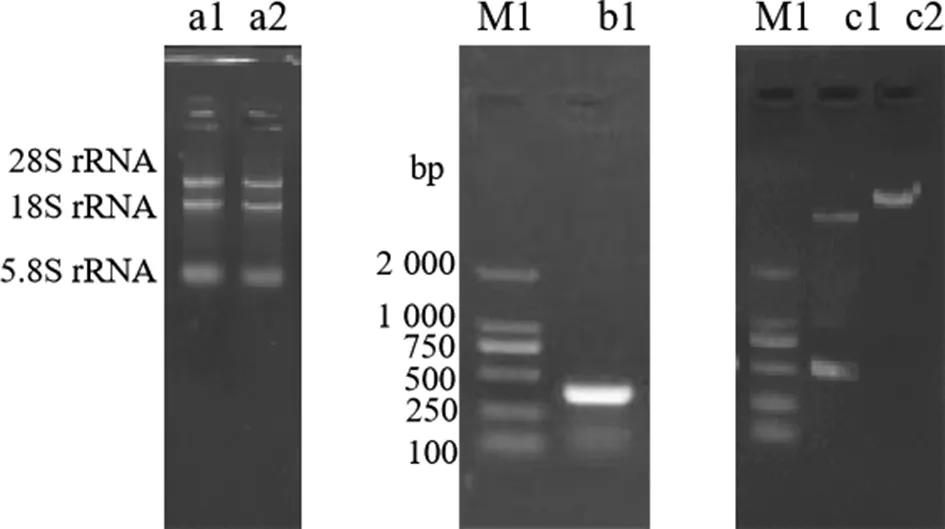
注:a1、a2为人胚胎肾细胞293总RNA;M1为DL 2 000 DNA Marker;b1为扩增的PCT基因;c1为pET28a-PCT质粒双酶切产物;c2为pET28a-PCT质粒。
2.2表达菌株的筛选 将重组质粒pET28a-PCT导入大肠杆菌BL21(DE3)中,于摇床培养,IPTG诱导目的蛋白表达。经Expasy软件预测,PCT26-141的相对分子质量约为12.8×103。图2的蛋白电泳染色结果可见,与未加诱导剂的样品相比,诱导后的细菌裂解液在对应位置均有明显的蛋白条带(黑色箭头指示)。对比各个细菌克隆的目的蛋白表达情况,克隆2没有表达,克隆5表达的相对分子质量不正确,最终筛选出4号克隆作为表达菌株,将其扩增后,以甘油为保护剂,进行一、二级种子的菌种保存,将种子液冻存于-80 ℃冰箱。
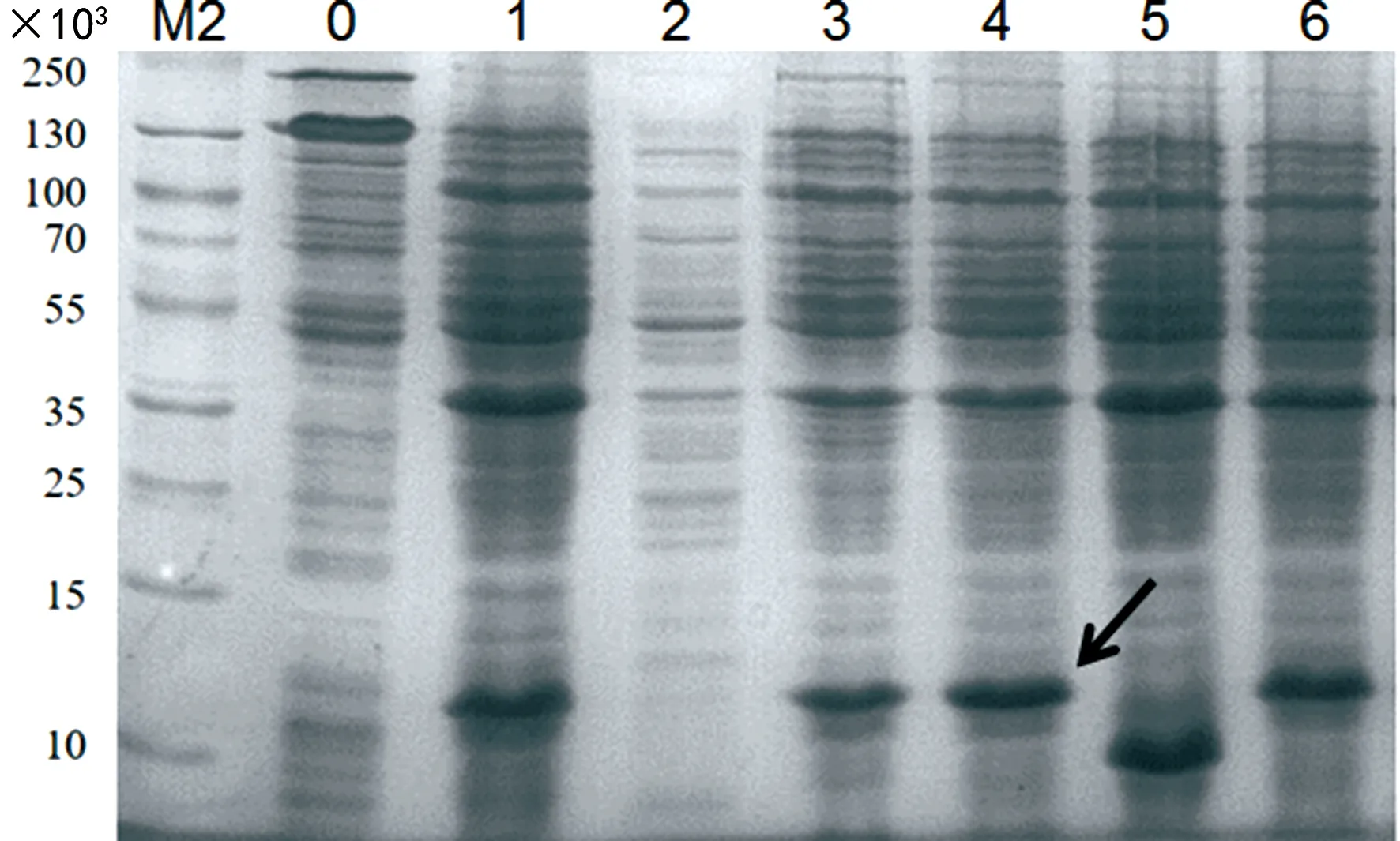
注:M2为蛋白相对分子质量标准(#26616);0为未加IPTG的重组菌;1~6为6个重组菌克隆,黑色箭头所指为表达量高的目的蛋白。
2.3重组大肠杆菌BL21(DE3)/pET28a-PCT发酵条件的优化 为提高PCT蛋白的产量并降低成本,对表达菌株BL21(DE3)/pET28a-PCT的发酵条件进行了下述优化。首先,研究发酵过程中培养温度对发酵周期和蛋白产量的影响。图3a1、a2可以看出,随着培养温度的升高,细菌生长速度加快。目的蛋白在细菌裂解液中的占比在40 ℃时最优(灰度分析结果受限于篇幅,本文未列出图片及数据)。图3b结果可见,随补料速度的加快,外源蛋白在细胞裂解液中的占比升高,补料速度超过100 mL/h后趋于稳定。因此,本研究选择在细菌生长阶段将补料速度维持在100 mL/h。图3c分析了溶氧量对目的蛋白表达的影响,结果表明溶氧量的增加能缩短细菌的发酵周期,但目的蛋白的表达没有明显变化。鉴于高搅拌转速不仅功率消耗变大,而且搅拌产生的剪切力会影响菌体的生长,本研究选择了30%作为搅拌-溶氧联动的控制参数。
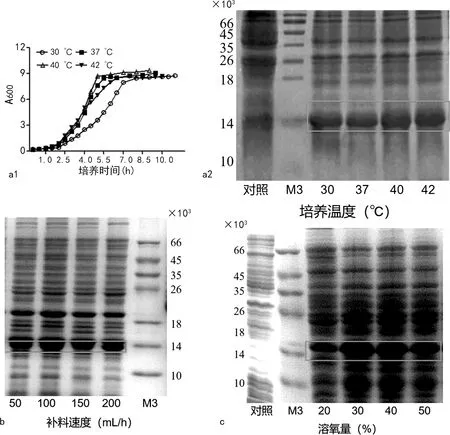
注:a1为不同培养温度下重组菌生长曲线;a2为不同培养温度下目的蛋白的表达;b为不同补料速度下目的蛋白的表达;c为不同溶氧量下目的蛋白的表达;对照为未诱导的重组菌;M3为自制蛋白相对分子质量标准;实线所指为目的蛋白。
通过上述单因素实验优化发酵参数,最终确定大肠杆菌BL21(DE3)/pET28a-PCT发酵生产PCT蛋白(10 L发酵罐)的适宜条件为5.5 L基础培养基,接种量10%,温度维持40 ℃,10×LB作为补料培养基,以100 mL/h等速流加(根据1.2.3摸索得到),用3 mol/L NaOH维持培养液pH值为7.2,采用搅拌-溶氧联动方式将溶氧量恒定在30%,0.2 mmol/L IPTG诱导目的蛋白表达。在上述适宜条件下,连续进行3批发酵,收获的湿菌量为(430±14)g,目的蛋白占比为(45.2±8.7)%。
2.4重组PCT蛋白的纯化 采用高压匀浆的方法对发酵收获的大肠杆菌(50 g湿菌)进行破碎,分析目的蛋白在菌体破碎上清液和沉淀中的比例,结果见图4a,细菌破碎上清液中有明显的目的蛋白。用镍柱纯化目的蛋白,20%缓冲液B(200 mmol/L咪唑洗脱)的洗脱峰SDS-PAGE染色结果显示有单一的蛋白条带,相对分子质量略小于18.4×103,与研究预期的重组蛋白相对分子质量相符(图4b)。利用Image J软件对泳道8目的蛋白进行灰度分析(图4c),结果显示目的蛋白纯度为93.14%。
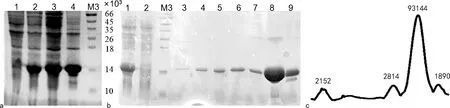
注:a为收获的大肠杆菌目的蛋白的表达分析,其中1为未诱导的重组菌,2为诱导后的重组菌,3为裂解后的上清液,4为裂解后的沉淀,M3为蛋白相对分子质量标准(A11911);b为从收获的大肠杆菌中纯化目的蛋白的情况,其中1为裂解后的上清液,2为纯化流穿液,3为10 mmol/L咪唑冲洗液,4~6为50 mmol/L咪唑洗脱液,7~9为200 mmol/L咪唑洗脱液,M3为蛋白相对分子质量标准(A11911);c为b图泳道8得到的Image J灰度分析结果。
2.5重组PCT蛋白的检测
2.5.1BCA法测定重组蛋白纯度 50 g湿菌体,经上述镍柱纯化后,泳道8的洗脱产物(共402 mL)用20 mmol/L Tirs-HCl缓冲液透析,采用BCA法定量试剂盒进行蛋白水平测定。根据标准曲线计算待测蛋白的水平,纯化的PCT水平为2.24 mg/mL。综合5.5 L发酵培养所得菌体质量(430 g),经计算,PCT产量为1 405 mg/L。
2.5.2以PCT标准品原液绘制标准曲线对纯化的PCT重组蛋白进行含量赋值 利用商品化的PCT检测试剂盒,标定纯化得到的PCT蛋白水平。Sigma公司试剂盒测得的PCT水平为(1.89±0.26)mg/mL,碧云天公司试剂盒测得的PCT水平为(1.64±0.47)mg/mL,天津生物芯片公司的试剂盒测得的PCT水平为(2.25±0.31)mg/mL。综合3种试剂盒的检测结果,计算均值,纯化的PCT蛋白水平标定值为1.93 mg/mL。
2.5.3重组PCT蛋白在ELISA试剂盒组成中的应用 以重组蛋白为标准品绘制的标准曲线与各试剂盒提供的标准曲线相比,在100~1 000 pg/mL范围内重组蛋白PCT水平与A值呈线性相关,提示本研究制备的重组PCT蛋白可以用作标准蛋白以组装检测试剂盒,但其检测范围略窄,而且各水平样品的检测数值偏低,导致曲线的斜率均偏低(图5)。
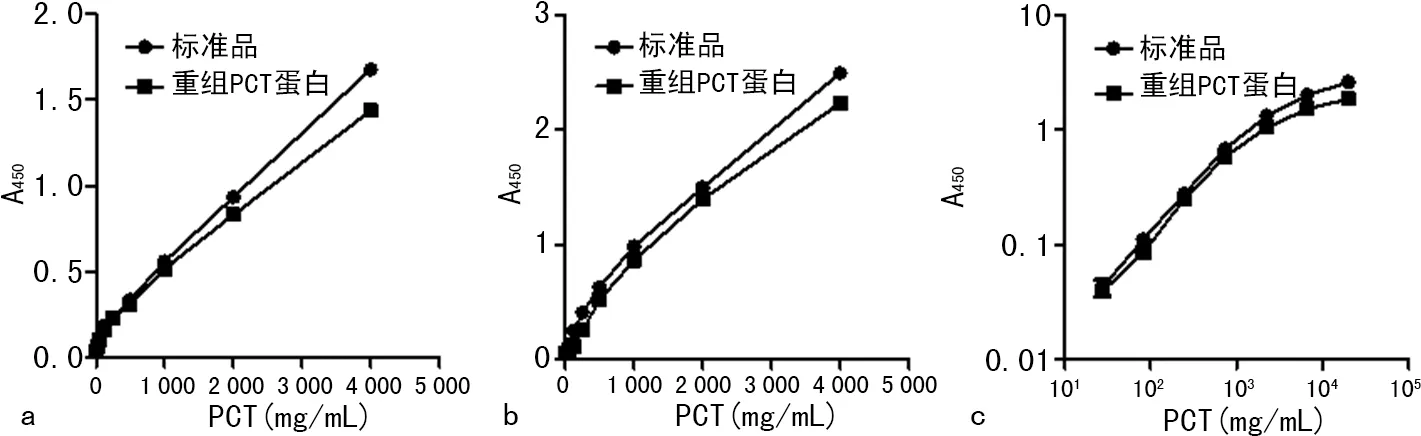
注:a为Sigma公司试剂盒检测结果;b为碧云天公司试剂盒检测结果;c为天津生物芯片公司试剂盒检测结果。
3 讨 论
原核表达系统是目前研究最清楚、最为经济的表达系统,以大肠杆菌为代表的原核表达系统是研究外源基因表达的首选[10-11]。大肠杆菌共有4 405个开放型阅读框架,遗传稳定,被美国食品药品监督管理局(FDA)批准为安全的基因工程表达系统。大肠杆菌不仅遗传背景清楚、生长繁殖快、转化效率高、成本低廉,还可以用于快速、大规模地生产目的蛋白[9]。
细菌培养常见的方法为摇瓶培养和发酵罐高密度培养。细菌培养过程中,培养温度、培养基组分、溶解氧含量、pH值等均会影响细菌生长繁殖速度及重组蛋白的产量[12]。在利用大肠杆菌作为宿主、通过发酵培养以期收获目标蛋白的发酵过程中,通过调节温度、补料速度、搅拌转速等参数,可以实现目标蛋白在细菌中的高占比。发酵罐培养可以便捷地调节培养温度、通过增加搅拌转速或者从外部注入氧气的方式调节溶氧量、通过外接蠕动泵的方式补充营养成分及调节培养液pH值,实现细菌的高密度培养,进而获得高产量的重组蛋白。
大肠杆菌最适宜生长的温度为37 ℃。本研究结果显示,随着温度的升高,细菌繁殖速度加快,到平台期所用的时间明显缩短。但是温度的升高可能会影响大肠杆菌细胞内各种蛋白酶的表达速度,也将会加速细菌的衰老和死亡。本研究推测,在细菌生长过程中,过快的营养消耗亟须外源碳源、氮源等营养的补充,而在目的蛋白表达阶段,诱导剂抑制了细菌繁殖,细菌状态由分裂繁殖转变为生产目的蛋白,维持这个阶段需要的营养消耗降低,因此补料速度的持续增加对目标蛋白的表达没有明显影响。此外,培养液中的溶氧量直接关系细菌的繁殖速度,溶氧量是影响发酵周期、蛋白产量的重要参数[10]。通过提高搅拌速度或者直接接入纯氧,能够提高溶氧量。采用搅拌-溶氧联动的方式使溶氧量维持在一个动态平衡的状态,可提供细菌繁殖所需的氧气。
大肠杆菌作为最常用的宿主细胞,能够对多数以pET质粒为载体携带的目标基因进行高水平表达。本研究利用大肠杆菌BL21(DE3)作为宿主,采用发酵培养并亲和纯化的方式获得重组人PCT蛋白。构建的pET28a-PCT重组质粒导入大肠杆菌BL21(DE3)后,以IPTG为诱导剂进行PCT蛋白的表达。pET28a携带的6×His标签使得表达的重组蛋白能够采用亲和层析的方式进行纯化,经过一步层析即可获得较高纯度的蛋白,而且6×His标签很小,不会影响蛋白的表达、折叠及其与抗体的结合活性[13]。
本研究构建的工程菌,在摸索建立的适宜发酵条件下,发酵周期10 h内,1 L发酵液即可获得78 g湿菌,1 L发酵液收获的细菌经亲和层析后能获得1 405 mg的重组PCT蛋白。经市售的PCT检测试剂盒标定后的重组PCT蛋白,在100~1 000 ng/L,其水平与A值有较好的线性关系,提示获得的重组蛋白经标定后,能够作为标准蛋白用于PCT检测,也可以作为抗原免疫动物以获得针对PCT的多克隆抗体或者单克隆抗体。后续工作:笔者还需要考察PCT蛋白的稳定性及储存条件对蛋白稳定性的影响,而且在装配试剂盒时,还需要对PCT水平进行标定。本研究为PCT检测试剂盒的研发提供了重要的原料。
