胃癌组织FIBCD1、ANKRD49表达与临床病理特征和预后的关系研究*
2022-09-24魏浩飞孙海滨李新江
魏浩飞,孙海滨,王 川,李新江
河北医科大学第二医院普外科,河北石家庄 050000
胃癌是我国发病率居第1位的消化道恶性肿瘤,相关数据显示2019年我国胃癌发病人数约61.2万例,因胃癌死亡病例约42.1万例[1]。胃癌治疗以手术及化疗等方式为主,胃癌肿瘤异质性较大,恶性程度较高,并且早期不易发现,多数患者确诊时已为晚期,丧失手术治疗的最佳时机[2]。研究胃癌的发生机制对胃癌预后判断意义重大。含纤维蛋白原C结构域蛋白1(FIBCD1)编码基因位于9q34.12,编码的蛋白含有461个氨基酸,主要在肠上皮细胞、气道上皮细胞及唾液管上皮细胞中表达[3]。FIBCD1是一种乙酰基识别受体,通过纤维蛋白原样识别域结合乙酰基几丁质,促进上皮细胞的增殖[4]。研究发现,乙酰胆碱能够通过结合胃癌细胞表面M3毒蕈碱受体,促进肿瘤细胞发生上皮间充质转化,以及增殖和转移[5]。FIBCD1作为一种乙酰胆碱受体,可能在胃癌进展中发挥重要的作用,影响胃癌患者的预后。锚蛋白重复结构域49(ANKRD49)含有30个氨基酸残基,编码基因位于11q21,包含4个锚蛋白重复序列。HAO等[6]研究表明,胶质瘤中ANKRD49的高表达促进肿瘤细胞的恶性增殖,ANKRD49是患者不良预后的重要肿瘤标志物,在胶质瘤细胞中敲低ANKRD49表达后,热休克蛋白27(HSP27)的表达下调,而HSP27参与促进胃癌的恶性进展[7]。故推测ANKRD49的表达可能与胃癌的进展及患者预后有关。本文通过检测胃癌组织中FIBCD1、ANKRD49的表达情况,探讨二者对胃癌患者的临床意义,现报道如下。
1 资料与方法
1.1一般资料 选取2015年1月到2018年1月本院收治的132例胃癌患者。纳入标准:(1)经术后病理组织检查确诊为胃腺癌。(2)首次确诊的患者。(3)具备手术指征,均完成胃癌根治术。排除标准:(1)合并其他恶性肿瘤。(2)伴肝、肾衰竭。(3)伴胃肠道急慢性疾病。其中男70例,女62例;年龄34~77岁,平均(55.81±6.13)岁;肿瘤浸润深度:T1~T2 89例,T3~T4 43例;肿瘤最大径:≤5 cm 75例,>5 cm 57例;肿瘤位置:贲门胃底部、胃体部39例,幽门胃窦部93例;TNM分期:Ⅰ~Ⅱ期82例,Ⅲ期50例;肿瘤分化程度:高中分化80例,低分化52例。本研究经本院伦理委员会批准通过,患者及家属均知情同意。
1.2方法 免疫组化检测:将术后标本组织[胃癌组织和癌旁组织(距癌组织边缘2 cm以上)]置于中性甲醛固定过夜,石蜡包埋后以CUT6062全自动轮转式切片机(上海聚慕医疗器械有限公司)切片,厚度4 μm。将切片放入60 ℃烘箱烤片2 h;二甲苯脱蜡两次;梯度乙醇水化切片;用微波炉在柠檬酸盐缓冲液中抗原热修复5 min,自然冷却至室温;避光滴加3%过氧化氢30 min;5%封闭液封闭30 min;一抗4 ℃孵育过夜(兔抗人FIBCD1多克隆抗体购自美国赛默飞世尔公司,货号PA5-43502,稀释比1∶1 000;兔抗人ANKRD49多克隆抗体购自英国Abcam公司,货号ab85726,稀释比1∶1 000);羊抗兔二抗孵育30 min;辣根过氧化物酶(HRP)标记的三抗孵育30 min;二氨基联苯胺(DAB)显色2 min,苏木素染色30 s;2%盐酸乙醇分化3 s;梯度乙醇脱水,中性树脂封片。由2名高年资的病理科医生以双盲法阅片,在ZX-17AT基础型倒置金相显微镜(深圳市众寻光学仪器有限公司)的高倍视野(×400)下观察切片染色情况,以出现棕黄、棕褐色显色判断为阳性细胞。染色强度计分:无着色、浅黄、棕黄、棕褐色分别计0、1、2、3分。阳性细胞占比计分:0、>0~25%、>25%~50%、>50%~75%、>75%分别计0、1、2、3、4分。二者乘积为最终染色计分结果,0~2分为阴性,≥3分为阳性[8]。
1.3随访 患者出院后进行定期随访,每3个月以电话联系或门诊复查方式随访1次,随访3年,随访内容为患者生存情况及疾病进展情况等,随访截止时间为2021年1月,随访终止事件为患者死亡或随访时间结束。
1.4统计学处理 采用SPSS22.0软件分析数据。计数资料以例数或率表示,组间比较采用χ2检验。采用Spearman相关分析胃癌组织中FIBCD1与ANKRD49表达的相关性。以Kaplan-Meier曲线及Log-rank检验分析不同FIBCD1和ANKRD49表达情况胃癌患者的生存情况。以COX比例风险回归模型分析影响胃癌患者预后的危险因素。以P<0.05为差异有统计学意义。
2 结 果
2.1胃癌组织和癌旁组织FIBCD1、ANKRD49表达 胃癌组织中FIBCD1、ANKRD49阳性表达率均高于癌旁组织,差异有统计学意义(P<0.05),见表1。免疫组化染色结果显示,胃癌组织FIBCD1阳性染色位于细胞核,ANKRD49阳性染色位于细胞核和细胞质,癌旁组织中未见FIBCD1、ANKRD49阳性染色。见图1。
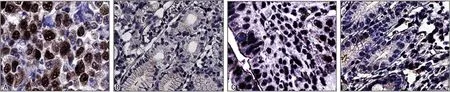
注:A为癌组织中FIBCD1表达情况;B为癌旁组织中FIBCD1表达情况;C为癌组织中ANKRD49表达情况;D为癌旁组织中ANKRD49表达情况。
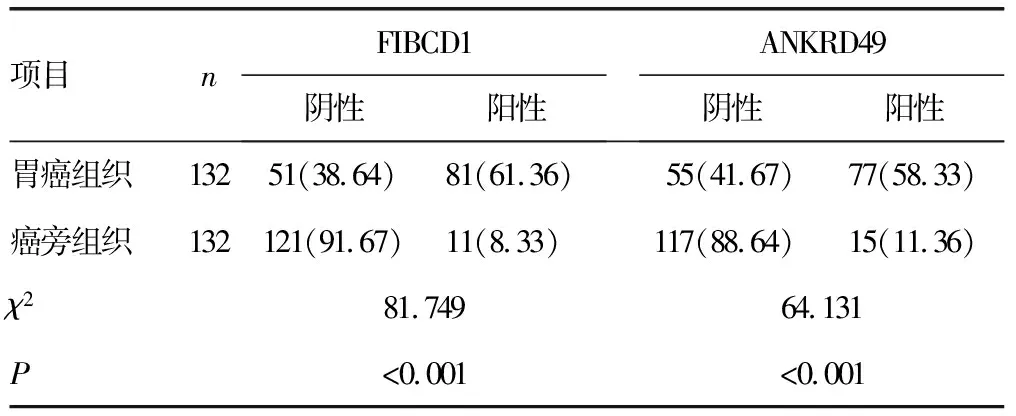
表1 胃癌组织和癌旁组织FIBCD1、ANKRD49表达[n(%)]
2.2胃癌组织中FIBCD1、ANKRD49表达与临床病理特征的关系 不同TNM分期、肿瘤浸润深度的患者胃癌组织中FIBCD1、ANKRD49的阳性表达率差异有统计学意义(P<0.05)。不同性别、年龄、肿瘤分化程度、肿瘤最大径、肿瘤位置的患者胃癌组织中FIBCD1、ANKRD49的阳性表达率差异无统计学意义(P>0.05)。见表2。
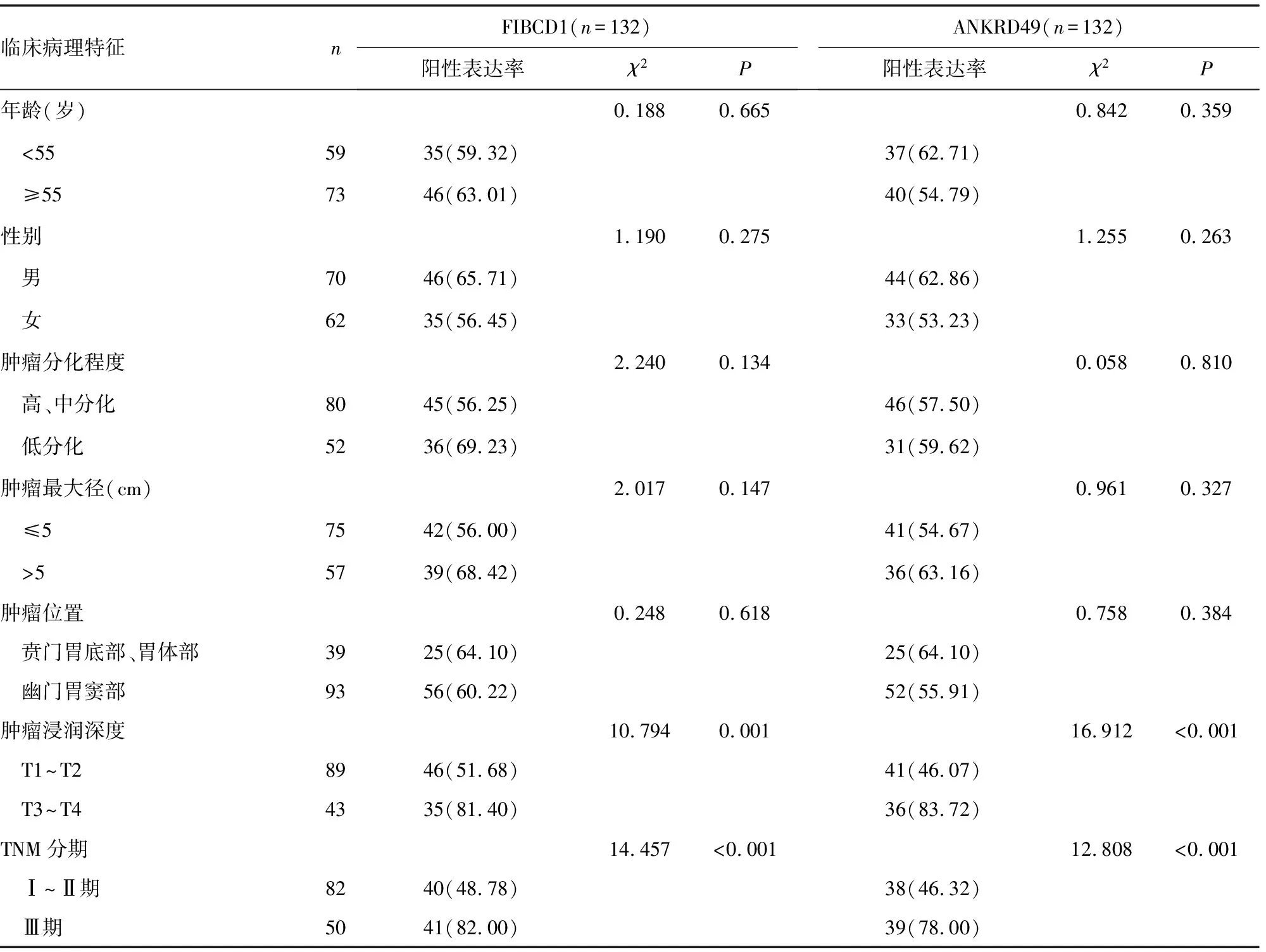
表2 胃癌组织中FIBCD1、ANKRD49表达与临床病理特征的关系[n(%)]
2.3胃癌组织中FIBCD1与ANKRD49表达的相关性 Spearman相关分析胃癌组织中FIBCD1与ANKRD49表达的相关性,结果发现FIBCD1与ANKRD49表达呈正相关(r=0.522,P<0.001)。
2.4不同FIBCD1、ANKRD49表达的胃癌患者预后情况 随访期间患者失访2例,死亡43例,总体生存率为66.92%(87/130)。FIBCD1阳性、阴性表达患者3年生存率分别为55.70%(44/79)、84.31%(43/51),FIBCD1阳性表达患者3年生存率显著低于FIBCD1阴性表达患者(Log-rankχ2=9.338,P=0.002)。ANKRD49阳性、阴性表达患者3年生存率分别为53.33%(40/75)、85.45%(47/55),ANKRD49阳性表达患者3年生存率显著低于ANKRD49阴性表达患者(Log-rankχ2=10.440,P=0.001)。见图2。
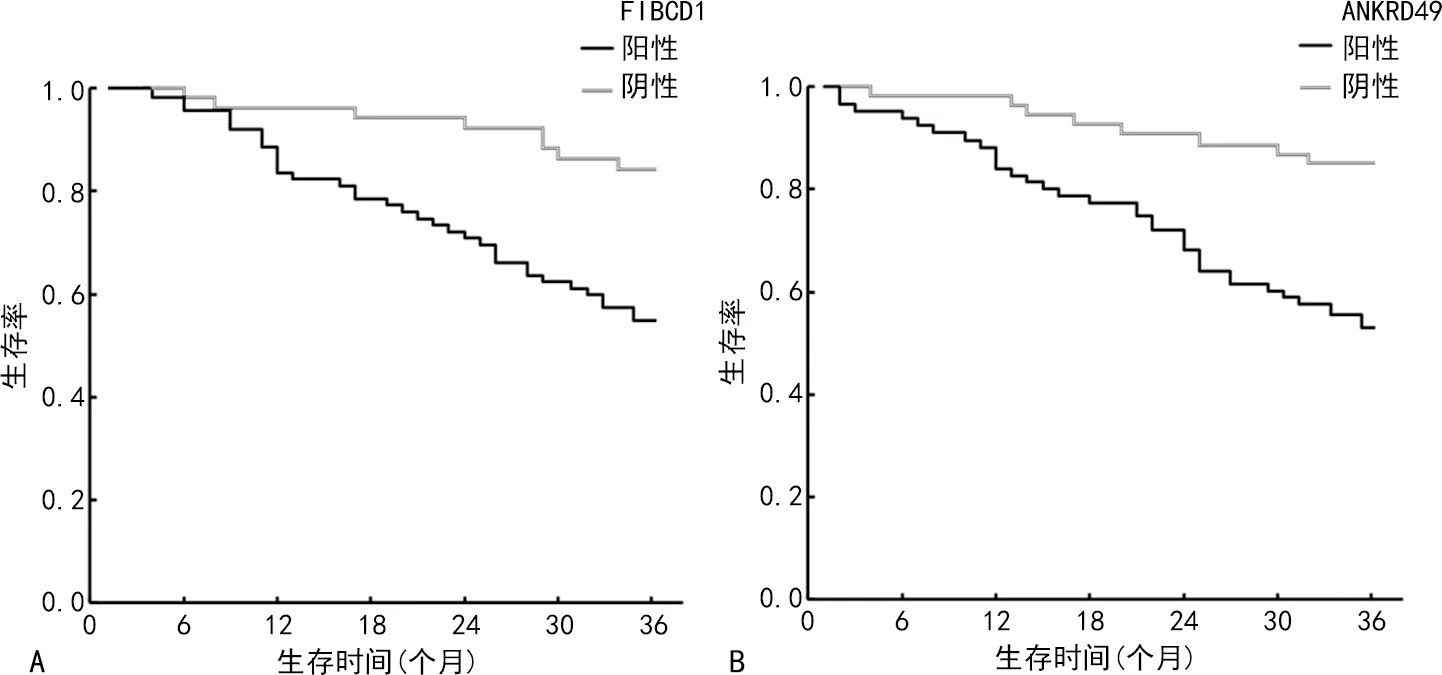
注:A为不同FIBCD1表达情况胃癌患者生存曲线;B为不同ANKRD49表达情况胃癌患者生存曲线。
2.5COX比例风险回归模型分析影响胃癌预后的危险因素 以胃癌患者的生存结局为因变量(1=死亡,0=存活,t=生存时间),纳入年龄(1=≥55岁,0=<55岁)、性别(1=男,0=女)、肿瘤最大径(1=>5 cm,0=≤5 cm)、肿瘤位置(1=贲门胃底部、胃体部,0=幽门胃窦部)、肿瘤浸润深度(1=T3~T4,0=T1~T2)、TNM分期(1=Ⅲ期,0=Ⅰ~Ⅱ期)、肿瘤分化程度(1=低分化,0=高中分化)、FIBCD1(1=阳性,2=阴性)、ANKRD49(1=阳性,2=阴性)为自变量,纳入COX比例风险回归模型。结果显示FIBCD1阳性表达、ANKRD49阳性表达、TNM分期Ⅲ期及肿瘤浸润深度T3~T4是胃癌患者预后的危险因素(P<0.05)。见表3。
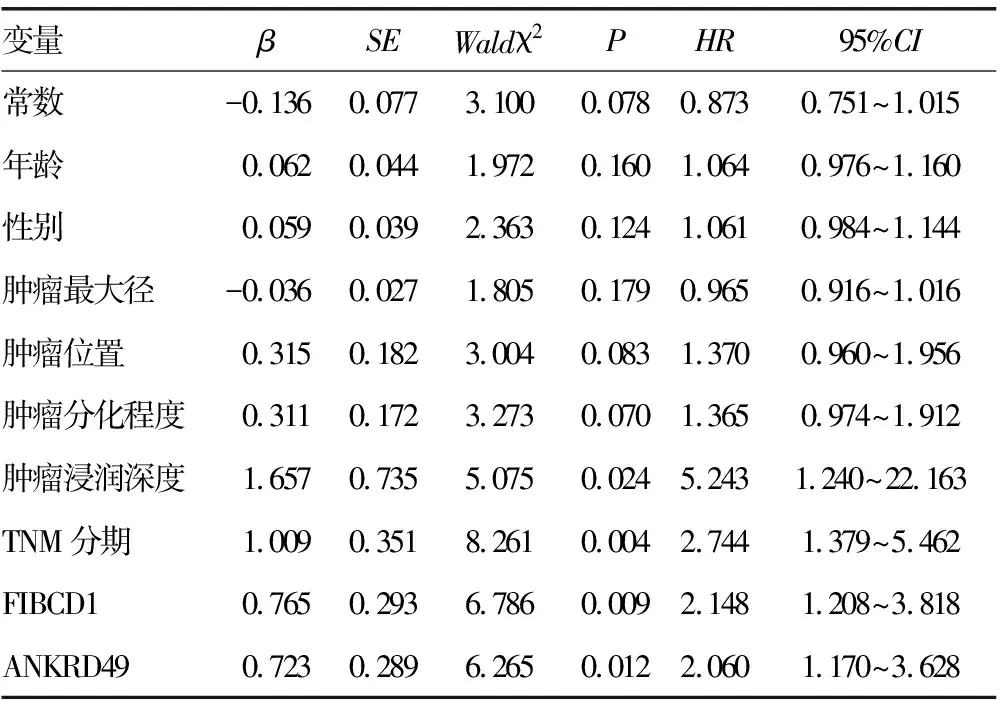
表3 胃癌患者预后危险因素的COX比例风险回归模型分析
3 讨 论
胃癌是常见的消化系统恶性肿瘤,其发生、发展是一个多阶段、多步骤的过程,机制涉及遗传学和表观遗传学[9]。随着分子生物学和免疫学研究的进展,临床研发出多种针对胃癌的诊断治疗策略,如分子靶向药物及免疫检查点抑制剂等,使胃癌的早期诊断和治疗得到了一定程度的改善[10]。但目前胃癌仍缺乏有效的治疗手段,特别是晚期患者预后较差,病死率较高。因此,寻找影响胃癌发生、发展的关键机制,研究有效的治疗策略,对提高患者远期预后意义重大。
编码FIBCD1的基因位于人类9号染色体,相对分子质量为55×103,在胃肠道、睾丸等人体组织中表达水平较高。FIBCD1的活性形式是由二硫键结合的同源四聚体,其作为一种识别受体,具有C端纤维蛋白原样识别域。功能上,FIBCD1是一种钙依赖性、高亲和力乙酰基结合受体,可结合乙酰化成分,如几丁质[11]。以往研究发现,乙酰胆碱具有促进胃癌恶性进展的生物学作用[5],推测作为乙酰胆碱受体的FIBCD1可能在胃癌发生、发展中发挥重要作用。本研究中,胃癌组织中FIBCD1的阳性表达率明显高于癌旁组织,表明胃癌中FIBCD1表达升高。目前其具体机制尚不清楚。研究表明,FIBCD1的配体几丁质表达下调能诱导下游缺氧诱导因子1α(HIF1α)的表达[12]。DING等[13]研究发现,胃癌中HIF1α的表达上调能够促进胃癌肿瘤细胞的迁移及浸润。因此,推测胃癌中FIBCD1的表达可能受HIF1α表达的调控。FIBCD1表达变化在胃癌中的临床意义值得深入研究。本研究表明,胃癌组织中FIBCD1的阳性表达率与患者较高的TNM分期及肿瘤浸润深度有关,提示FIBCD1的阳性表达可促进胃癌进展。分析其机制,可能与FIBCD1在肿瘤免疫反应中的重要作用有关。研究发现,FIBCD1能够招募巨噬细胞、辅助性T细胞2(Th2)等免疫细胞,并释放慢性炎症细胞因子如白细胞介素-4等,进而在肿瘤微环境中发挥免疫抑制的效应,促进肿瘤细胞的免疫逃逸,导致肿瘤进展[14]。本研究通过生存分析发现,FIBCD1阳性表达的患者预后较差,并且FIBCD1阳性表达是胃癌患者预后的危险因素。这表明检测胃癌组织中FIBCD1的表达有助于判断胃癌患者的预后。
锚蛋白重复序列蛋白家族是一种在生物体中广泛存在的序列模体,具有典型的螺旋环-螺旋-β-发夹折叠结构,依靠氢键和疏水作用形成紧密的结构域[15]。该家族介导蛋白质-蛋白质相互作用,参与精子产生、肿瘤形成等多种生理和病理过程[16-17]。ANKRD49包含4个锚蛋白重复基序。研究表明,在胶质瘤等肿瘤中ANKRD49表达上调,其作为一种促癌基因,促进肿瘤的发生、发展[6]。此外,ANKRD49表达能够影响下游多种基因的表达,如丝裂原活化蛋白激酶(MAPK)等[6],而MAPK能够明显促进胃癌细胞的恶性增殖,导致肿瘤进展[18]。本研究发现,胃癌组织中ANKRD49阳性表达率显著升高。目前肿瘤中ANKRD49表达上调的机制尚缺乏报道。有学者在精子产生方面的研究发现,微环境中营养物质缺乏、缺氧等能够激活核因子-κB通路,诱导ANKRD49的表达上调,促进细胞自噬,维持精子细胞的生存[19]。胃癌肿瘤微环境是一个缺血、缺氧的微环境,涉及核因子-κB通路的过度激活[20-21],胃癌中ANKRD49的表达上调可能受相似机制的调控,有待深入研究。此外,本研究还发现ANKRD49阳性表达与TNM分期及肿瘤浸润深度有关。评估不同个体胃癌患者的预后对于选择正确的治疗方案具有重要的临床意义,但目前尚缺乏有效用于判断胃癌预后的生物标志物。本研究中,ANKRD49的阳性表达与胃癌的进展有关,推测ANKRD49是评估胃癌不良预后的生物标志物。生存分析结果证实,ANKRD49阳性表达胃癌患者预后较差,并且ANKRD49阳性表达是患者预后的危险因素。这表明ANKRD49是一种潜在的预测胃癌患者预后的生物标志物。相关性分析发现,胃癌中FIBCD1与ANKRD49表达呈正相关,二者共同激活肿瘤增殖信号通路,发挥促进肿瘤进展的生物学功能,但二者在胃癌中的具体作用机制及相互调控关系有待深入研究。
综上所述,胃癌组织FIBCD1、ANKRD49阳性表达率升高,二者表达与TNM分期及肿瘤浸润深度有关,并且二者之间呈正相关,可协同发挥促癌作用。检测胃癌组织中FIBCD1、ANKRD49表达情况有助于判断患者预后。
