急性脑出血患者血清MPO、S100A12、Omentin-1表达与神经功能损伤及预后的相关性*
2022-09-24崔海随胡德献杨昌立
崔海随,胡德献,杨昌立,王 刚
1.海南省第二人民医院神经外科,海南五指山 572299;2.海南医学院第二附属医院神经外科,海南海口 570216
急性脑出血是由非外伤导致的颅内血管破裂引起的急性出血,该病起病急,病情进展快,致残率及致死率较高,严重威胁患者的生命健康[1]。髓过氧化物酶(MPO)作为一种炎性指标,参与一氧化氮衍生氧化剂和反应性氧化物质的生成。研究表明,急性缺血性脑卒中患者血清MPO水平升高与病情严重程度有关[2]。S100钙结合蛋白A12(S100A12)也被称为钙粒蛋白C,是钙结合蛋白S100家族成员,由91个氨基酸组成,可作为损伤相关模式(DAMP)分子与多种受体结合,激活炎性反应。研究发现,血清S100A12水平升高是急性缺血性脑卒中患者预后不良的独立预测因子[3]。网膜素-1(Omentin-1)作为一种新的脂肪因子,可通过影响机体的糖脂代谢、炎性反应等参与动脉粥样硬化进程,进而影响心脑血管疾病的发生、发展[4]。目前,有关MPO、S100A12、Omentin-1与急性脑出血患者预后关系的报道较少。因此,本研究通过检测急性脑出血患者血清MPO、S100A12、Omentin-1的表达情况,并分析其与患者病情、预后的相关性,现报道如下。
1 资料与方法
1.1一般资料 选取2017年1月至2020年1月海南省第二人民医院神经外科收治的急性脑出血患者110例(观察组)。其中男61例,女49例;年龄32~80岁,平均(59.68±10.13)岁;体质量指数(BMI)21.00~27.00 kg/m2,平均(24.75±2.01)kg/m2;吸烟史53例,饮酒史48例;慢性基础疾病史:高血压42例,冠心病15例,糖尿病29例。纳入标准:(1)均符合《中国脑出血诊治指南(2014)》[5]中的急性脑出血诊断标准,并经颅脑CT确诊;(2)年龄>18岁;(3)首次发病,且在发病12 h内入院。排除标准:(1)外伤性脑出血、蛛网膜下腔出血、血管畸形致脑出血者;(2)恶性肿瘤者;(3)严重心、肝、肾等器官功能障碍者;(4)自身免疫性疾病及造血系统疾病者;(5)近3个月内有脑血管疾病史者;(6)严重精神疾病,不能配合者。同期,另选取该院体检健康者80例(对照组)。其中男40例,女40例;年龄35~76岁,平均(57.43±8.20)岁;BMI 20.00~26.00 kg/m2,平均(24.13±1.79)kg/m2;吸烟史35例,饮酒史29例。两组受试者的性别、年龄、BMI等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院医学伦理委员会批准,患者或家属均知情同意并签署知情同意书。
1.2方法 分别于入院后12 h或体检时空腹采集两组受试者外周静脉血5 mL,3 000 r/min 离心10 min,分离上层血清,置于-70 ℃冰箱保存待测。采用酶联免疫吸附试验(ELISA)检测血清MPO、S100A12、Omentin-1水平。MPO试剂盒由合肥莱尔生物科技有限公司提供,S100A12试剂盒由上海酶联生物科技公司提供,Omentin-1试剂盒由上海江莱生物科技有限公司提供,检测过程严格按照试剂盒说明书进行操作。
1.3病情及预后评估 应用美国国立卫生研究院卒中量表(NIHSS)评估急性脑出血患者入院时神经功能损伤情况,总分为0~42分,分值越高说明神经功能越差,并根据NIHSS评分将患者分为轻度组(<8分,25例)、中度组(8~<15分,47例)及重度组(≥15分,38例)。在急性脑出血患者治疗3个月后,采用格拉斯哥预后量表(GOS)[6]评估患者预后情况,并将患者分为预后不良组(1~<4分,42例)和预后良好组(4~5分,68例)。
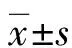
2 结 果
2.1观察组与对照组血清MPO、S100A12、Omentin-1水平比较 观察组血清MPO、S100A12、Omentin-1水平与对照组相比,差异有统计学意义(P<0.05),见表1。
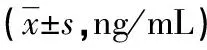
表1 观察组与对照组血清MPO、S100A12、Omentin-1水平比较
2.2不同严重程度急性脑出血患者血清MPO、S100A12、Omentin-1水平比较 重度组血清MPO、S100A12水平高于中度组、轻度组,中度组血清MPO、S100A12水平高于轻度组,重度组血清Omentin-1水平低于中度组、轻度组,中度组血清Omentin-1水平低于轻度组,差异均有统计学意义(P<0.05),见表2。
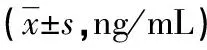
表2 不同严重程度急性脑出血患者血清MPO、S100A12、Omentin-1水平比较
2.3不同预后急性脑出血患者临床资料及血清MPO、S100A12、Omentin-1水平比较 预后良好组与预后不良组的年龄、性别、BMI,合并高血压、糖尿病、冠心病的比例比较,差异无统计学意义(P>0.05)。两组NIHSS评分、血清MPO、S100A12及Omentin-1水平比较,差异有统计学意义(P<0.05),见表3、4。
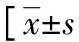
表3 不同预后急性脑出血患者临床资料比较或n/n或n(%)]
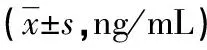
表4 不同预后急性脑出血患者血清MPO、S100A12、Omentin-1水平比较
2.4急性脑出血患者预后不良的多因素分析 以急性脑出血患者是否预后不良为因变量(是=1,否=0),自变量为入院时NIHSS评分、血清MPO、S100A12、Omentin-1水平(均为连续变量,原值录入),进行多因素Logistic回归分析,变量筛选采用逐步法,结果显示,NIHSS评分(OR=1.520,P=0.012)、血清MPO(OR=2.019,P=0.001)、S100A12(OR=1.364,P<0.001)、Omentin-1(OR=0.413,P=0.005)是急性脑出血患者预后不良的独立影响因素,见表5。
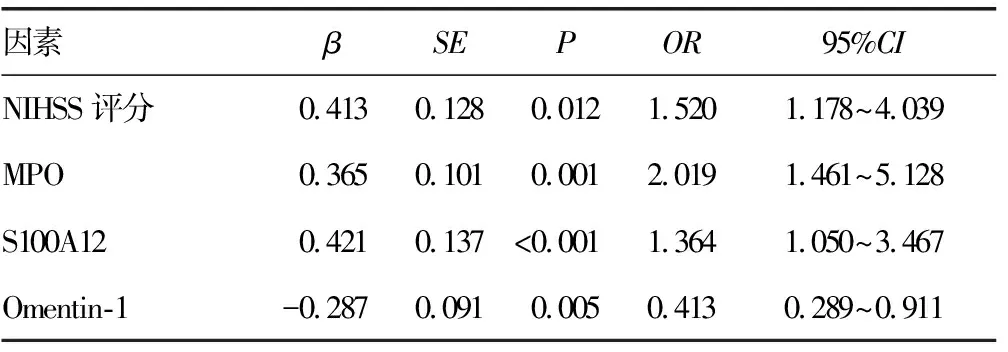
表5 急性脑出血患者预后不良的多因素Logistic分析
2.5血清MPO、S100A12、Omentin-1对急性脑出血患者预后不良的评估价值 ROC曲线分析结果显示,血清MPO预测患者预后不良的曲线下面积(AUC)为0.780(95%CI:0.679~0.881,P<0.001),cut off值为3.79 ng/mL,灵敏度和特异度分别为0.778、0.737;血清S100A12预测患者预后不良的AUC为0.766(95%CI:0.660~0.873,P<0.001),cut off值为55.81 ng/mL,灵敏度和特异度分别为0.694、0.711;血清Omentin-1预测患者预后不良的AUC为0.809(95%CI:0.717~0.900,P<0.001),cut off值为161.24 ng/mL,灵敏度和特异度分别为0.806、0.684;三者联合预测患者预后不良的AUC为0.901(95%CI:0.837~0.961,P<0.001),灵敏度和特异度分别为0.736、0.897,见图1。
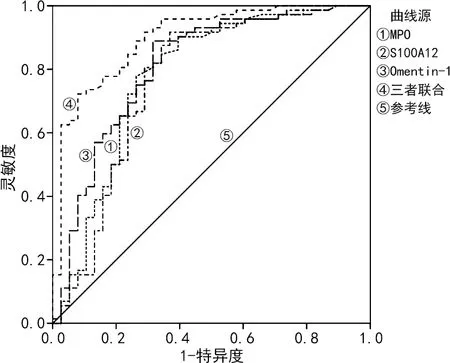
图1 血清MPO、S100A12、Omentin-1预测急性脑出血患者预后不良的ROC曲线
3 讨 论
急性脑出血是脑血管疾病中最常见的类型之一,约占急性脑血管疾病的40%,表现为偏瘫、失语等症状,对患者生活质量造成极大的影响[7]。脑出血引起的急性占位效应可对脑组织造成破坏,发病后的缺血、缺氧状态可进一步增强炎性反应,加重脑组织损伤,导致神经功能缺损,影响患者预后[8]。目前,随着我国老龄化进程的不断发展,急性脑出血发病率也逐年升高,若患者不能得到及时救治,将严重威胁患者的生命安全。据报道,脑出血患者急性期病死率高达40.0%[6]。因此,尽早对患者病情进行评估,并采取相应的治疗措施,对改善患者预后尤为重要。
炎性反应、自由基损伤及氧化应激反应与出血性脑血管疾病的发生密切相关。MPO是一种亚铁血红蛋白酶,为氧化酶家族成员,由中性粒细胞、单核细胞、巨噬细胞和小胶质细胞分泌,并在机体炎性反应、氧化应激反应等方面起重要作用。MPO可通过形成高活性物质,如酪氨酰、羟自由基和乙醛,损伤组织并促进促炎细胞因子的产生,其也可起到募集中性粒细胞的作用,从而增强炎性反应。同时,MPO还可通过催化H2O2和氯化物将其转化为强效次氯酸并产生自由基,导致内皮细胞功能障碍、诱导型一氧化氮合酶的产生和脂质过氧化,从而加剧炎症[9]。而患者发生急性脑出血后,脑部细胞损伤、炎症因子分泌增加导致氧化应激反应更加剧烈,从而加重脑组织损伤。研究发现,脑出血急性期血清MPO活性显著升高,抑制MPO可减轻脑出血患者血肿周围脑组织的炎性反应,减少神经元损伤,从而改善神经功能[10]。
S100A12是钙结合蛋白S100家族成员,与血管内皮黏附因子的表达密切相关,并促进炎症细胞的趋化作用[11],参与机体的炎性反应、免疫调节等,进而诱导动脉粥样硬化的发生。S100A12也可与细胞表面晚期糖基化终产物(RAGE)受体和内源性Toll样受体4(TLR4)结合,激活淋巴细胞、中性粒细胞及单核细胞中的细胞内调节激酶1/2(ERK1/2)和磷脂酰肌醇3-激酶(PI-3K)/AKT信号通路,诱导白细胞介素(IL)-1β、IL-6等细胞因子产生,促进炎症进展[12]。中性粒细胞浸润到缺血脑组织中会增加S100A12的表达,并在缺血性脑卒中发生后将S100A12分泌到血浆中,使血浆S100A12水平升高[3]。研究发现,S100A12表达与脑组织炎性反应有关,血清S100A12水平升高与重型颅脑损伤患者不良预后有关[13]。
Omentin-1是一种从内脏脂肪组织释放的脂肪细胞因子,参与调节血管内皮细胞功能,具有抗炎、抗氧化及抗凋亡等作用。Omentin-1可抑制血管平滑肌细胞的氧化应激反应,发挥抗动脉粥样硬化的作用。其还可抑制线粒体的氧化应激反应,从而降低细胞毒性并发挥神经保护作用,并促进内皮细胞释放生物活性物质,调节内皮细胞功能,改善血管舒张、收缩功能。研究发现,Omentin-1能促进缺血状态下的血管重塑,以改善内皮功能、减少梗死面积、抑制细胞凋亡、减轻神经元损伤[14]。ZHANG等[15]报道称,较低的血清Omentin-1水平与急性脑出血患者的不良预后密切相关。
本研究结果显示,观察组血清MPO、S100A12水平高于对照组,血清Omentin-1水平低于对照组,提示MPO、S100A12、Omentin-1可能参与急性脑出血的发生过程。有研究显示,与健康对照者相比,急性脑出血患者的血清MPO水平明显增加,血清MPO水平与患者NIHSS评分呈正相关[16]。本研究也发现,随着急性脑出血患者神经功能缺损程度加重,血清MPO、S100A12水平逐渐升高,血清Omentin-1水平逐渐降低,原因可能与MPO、S100A12、Omentin-1水平升高或降低能促使机体炎性反应增强,使细胞毒性水肿加剧,进而加重神经元损伤有关。这说明入院时血清MPO、S100A12、Omentin-1水平变化可反映急性脑出血患者病情严重程度,与既往报道结果一致[17]。患者发生脑出血后,随着脑细胞损伤及脑组织缺血、缺氧加重,可促使炎症因子释放入血,并刺激多种通路激活,使继发性脑水肿发生风险升高,从而导致患者预后不良。本研究中,预后不良组血清MPO、S100A12水平高于预后良好组,血清Omentin-1水平低于预后良好组,差异均有统计学意义(P<0.05),提示MPO、S100A12、Omentin-1有可能成为预测急性脑出血患者预后的潜在指标。QIAN等[17]研究发现,较高的血清S100A12水平与急性脑出血患者的脑组织炎症、病情严重程度和短期病死率密切相关,表明S100A12是预测患者预后不良的生物标志物。本研究多因素Logistic回归分析结果显示,血清MPO、S100A12、Omentin-1是急性脑出血患者预后不良的独立影响因素,进一步证实MPO、S100A12、Omentin-1在脑出血病理生理发展过程中起重要作用,而联合检测血清MPO、S100A12、Omentin-1预测急性脑出血患者预后不良的AUC为0.901,提示联合检测3项指标对评估患者预后不良有较高的参考价值。
综上所述,急性脑出血患者血清MPO、S100A12水平升高及血清Omentin-1水平降低,且与患者神经功能损伤程度及预后有关,早期监测血清MPO、S100A12、Omentin-1水平对评估患者预后有较高的临床价值。但是,本研究为单中心研究,且样本量较少,未来仍需进行前瞻性、多中心和大样本研究加以证实。
