侧脑室注射脂多糖建立脑微出血动物模型研究
2022-09-22吴倩张恒卢永婷李春艳贾文姬鲍天昊韩剑虹
吴倩 张恒 卢永婷 李春艳 贾文姬 鲍天昊 韩剑虹
脑微出血(cerebral microbleeds,CMBs)是一种脑小血管病(cerebral small vessel disease,CSVD)[1],其发病机制尚未完全清楚,主要是由于脑微小血管壁损害导致血管内红细胞等成分外渗并沉积于脑实质内,长期亚急性损伤可导致患者认知功能下降。动物模型研究对全面认识和了解疾病机制和病因具有重要作用。目前CMBs动物模型主要包括腹腔注射脂多糖(LPS)全身炎症诱导法[2]、脑内定向注射细菌胶原酶诱导法[3]和激光脉冲靶向损伤血管诱导法[4],这些方法均存在一定不足:如腹腔注射LPS全身炎症诱导CMBs模型无法进行动物行为学评估,其原因是难以区分行为学表现差异是由CMBs造成还是全身炎症导致,未能排除躯体因素的干扰;脑内定向注射细菌胶原酶诱导出的微出血灶仅存在注射位点,微出血病灶较少,与临床上CMBs多部位多发的特点存在差异;而激光脉冲靶向损伤血管造模方法对条件要求和成本相对较高而应用受限。
研究表明神经炎症是各种神经退行性疾病的机制之一[5],LPS可通过与Toll样受体4(Toll-like receptors 4,TLR4)结合激活核因子κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路诱导神经炎症发生,导致小胶质细胞迁移增殖和星形胶质细胞激活[6],胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)作为反应性星形胶质细胞标志物在炎症损伤时表达增多,已成为评估星形胶质细胞反应性的一个重要标志物[7]。因此,本研究运用脑立体定位仪向侧脑室注射LPS诱发神经炎症反应从而诱导CMBs,尝试建立一种新型的CMBs动物模型。
1 材料和方法
1.1 动物雄性SPF级SD大鼠共24只,体质量250~300 g,购自昆明医科大学实验动物学部〔SCXK(滇)K2020-0004〕。室内饲养,温度20~26℃,12 h/12 h昼夜明暗交替,自由饮水及进食。将大鼠随机分为对照组以及低、中、高剂量LPS模型组,每组6只。该研究经昆明医科大学实验动物伦理委员会批准(kmmu2021553)。
1.2 主要试剂与仪器LPS(L2630)、苏木素(H3136)、伊红(230251)均购自美国Sigma公司;抗GFAP小鼠单抗(一抗,GB12096)购自武汉塞维尔生物科技有限公司;AF488标记山羊抗小鼠IgG(二抗,ab150113)购自英国Abcam公司;大鼠脑立体定位仪、微量注射器购自深圳市瑞沃德生命科技有限公司。
1.3 方法
1.3.1CMBs模型制备:采用右侧脑室单次注射LPS法进行造模。将大鼠以3%(质量浓度)戊巴比妥钠腹腔注射麻醉(35 mg/kg),头顶备皮、碘伏消毒后将大鼠固定于脑立体定位仪上,头顶正中作一长约1.5 cm手术切口,参照Paxinos &Watson大鼠脑立体定位图谱[8],以前囟为原点,向后0.8 mm、矢状缝向右1.5 mm为注射位点,打孔后微量注射器缓慢进针,进针深度3.8 mm。低、中、高剂量LPS模型组大鼠分别给予50、75、100 μg LPS(均10 μL),给药速度1 μL/min,注射完毕后留针10 min,缓慢退针后缝合伤口,术后置于加热垫待大鼠苏醒后放回饲养笼继续饲养。对照组以相同方法给予等体积生理盐水。实验过程中若出现大鼠死亡,用备用鼠补充至每组6只,并记录大鼠存活率。
1.3.2新物体识别实验:根据Leger等[9]方法进行新物体识别检测。给药后第1天为适应阶段,将大鼠置空箱子内5 min让其自由探索,之后放回笼子。给药后第2天进入熟悉和测试阶段,箱子内放置2个相同的物体,让老鼠探索物体10 min后放回笼子,1 h后其中一个物体替换为不同的新物体,再次让老鼠探索2个物体10 min,记录老鼠嗅探新物体和熟悉物体的时间。按下列公式计算大鼠的辨别指数:辨别指数=探索新物体的时间/探索两个物体的总时间。
1.3.3旷场实验:在四周有固定标识物件的环境中,将大鼠单独放置在一个方形场地(100 cm×100 cm×20 cm)让其自由活动。采用SuperMaze动物行为学视频分析系统跟踪大鼠4 min,记录大鼠运动距离评价大鼠的水平运动情况;同时统计大鼠4 min内站立次数,记为大鼠垂直运动情况。每只大鼠测试后用75%酒精擦拭场地去味。
1.3.4CMBs检测:包括脑表面微出血和病理性脑微出血(cerebral microhemorrhages,CMH)。于给药48 h(即行为学评估结束)后,给予大鼠腹腔注射致死剂量的戊巴比妥钠,取全脑组织置4%(质量浓度)多聚甲醛中固定72 h。采用体视显微镜观察并记录大鼠脑表面微出血点,随后将脑组织脱水、石蜡包埋,常规制备冠状切片,厚度5 μm,每隔8张切片取相邻2张切片为一组,每只大鼠共收集45组切片。每组切片中的一片用于HE染色检测CMH,另一片用于免疫荧光检测GFAP阳性表达。HE染色按照脱蜡至水、苏木素染细胞核、伊红染细胞质、脱水封片的步骤依次进行,染色后置光学显微镜下观察沉积于脑实质的红细胞并拍照。根据Fisher教授建议[2],以微出血数量、微出血大小描述和记录CMH情况。取每只大鼠45张脑切片微出血个数的中位数表示每只大鼠CMH数量。运用NIH ImageJ软件分析每张切片CMH总面积,取每只大鼠45张脑切片微出血面积的中位数表示每只大鼠CMH面积。
1.3.5免疫荧光法检测脑组织GFAP表达:石蜡切片脱蜡至水后经PBS溶液漂洗、柠檬酸盐缓冲液抗原修复、PBS溶液漂洗、5%(体积分数)羊血清封闭、加1∶200稀释的抗GFAP小鼠单抗、PBST漂洗、加1∶500稀释的AF488标记山羊抗小鼠IgG H&L、PBST漂洗、DAPI染色封片等步骤依次进行。置荧光显微镜观察GFAP表达情况,玻片通过扫描仪扫描后使用NIH ImageJ软件量化每张切片总阳性免疫反应面积,以每张切片阳性免疫反应面积的均值表示每只大鼠GFAP表达水平。
1.4 统计学处理采用SPSS 25.0统计软件进行数据统计分析,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用SNK检验;非正态分布的计量资料采用中位数(四分位数间距)表示,多组间比较采用Kruskal-Wallis秩和检验,两两比较采用Bonferroni校正检验水准;采用Spearman相关性分析GFAP阳性表达与CMH数量、大小的相关性。以P<0.05认为差异具有统计学意义。
2 结果
2.1 大鼠存活率对照组和低剂量LPS组大鼠均存活,存活率100.0%,中剂量LPS组死亡1只,存活率83.3%,高剂量LPS组死亡3只,存活率50.0%。
2.2 脑表面微出血情况对照组大鼠无脑表面微出血,低、中、高剂量LPS模型组大鼠均存在明显的脑表面微出血,中、高剂量LPS模型组脑表面微出血数量较对照组明显增多(P<0.05),而高、中剂量LPS模型组间比较无统计学差异(P>0.05)。结果见图1、表1。

注:LPS:脂多糖;A:对照组;B:低剂量LPS模型组;C:中剂量LPS模型组;D:高剂量LPS模型组
2.3 病理学检测微出血HE染色结果显示,与对照组比较,低、中、高剂量LPS模型组大鼠CMH数量更多、面积更大(均P<0.05);与低剂量LPS模型组比较,中、高剂量LPS模型组CMH数量更多、面积更大(均P<0.05);中、高剂量LPS模型组CMH数量、面积比较均无统计学差异(P>0.05)。结果见图2、表1。
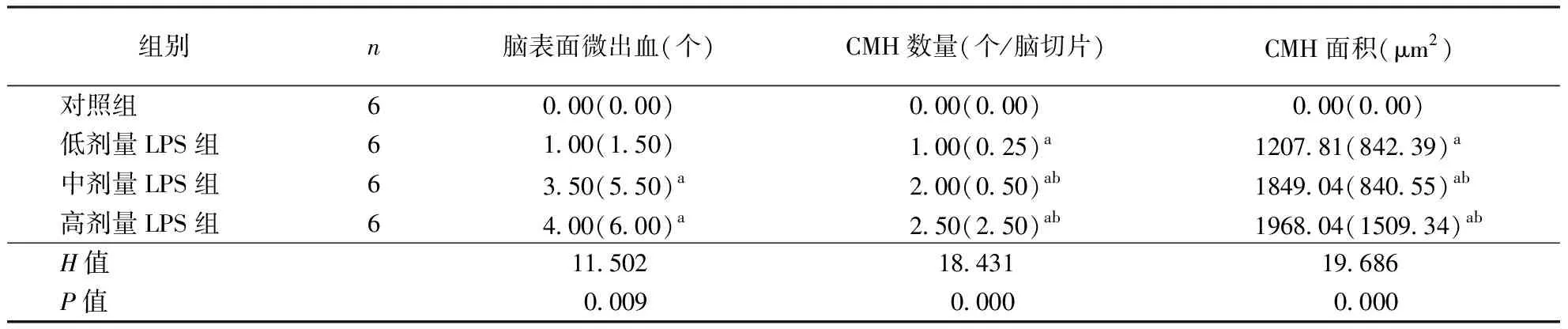
表1 各组大鼠脑表面微出血及CMH数量和大小比较情况〔Md(QU-QL)〕

注:CMH:脑微出血;A:对照组大脑组织未见微出血灶;B:中剂量LPS模型组脑干组织微出血病灶(箭头所示);C:中剂量LPS模型组大脑组织微出血病灶(箭头所示)
2.4 非空间记忆认知功能及运动功能情况新物体识别实验结果显示,低、中、高剂量LPS模型组辨别指数有小于对照组的趋势,但4组间比较差异无统计学意义(P>0.05)。旷场实验结果显示,4组大鼠水平运动距离和垂直运动次数间比较均无统计学差异(均P>0.05)。结果见表2。

表2 各组大鼠新物体识别实验和旷场实验结果比较
2.5 各组大鼠脑组织GFAP表达免疫荧光结果显示,对照组以及低、中、高剂量LPS模型组大鼠脑组织GFAP荧光阳性面积比较有统计学差异(F=80.458,P=0.000),且随LPS剂量增加,大鼠脑组织GFAP荧光阳性面积增加(均P<0.05)。结果见表2、图3。

注:GFAP:胶质纤维酸性蛋白;A:对照组;B:低剂量LPS模型组;C:中剂量LPS模型组;D:高剂量LPS模型组
2.6 脑组织GFAP表达与CMH的相关性GFAP阳性表达面积与CMH数量和大小呈正相关(r=0.80,r=0.74;均P<0.05)。见图4。
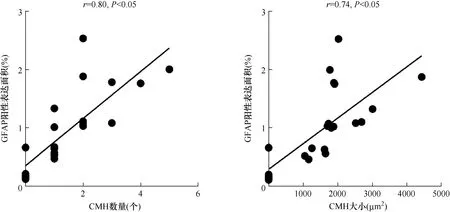
注:GFAP:胶质纤维酸性蛋白;CMH:脑微出血
3 讨论
本研究在既往针对CMBs动物模型研究的基础上进行改进,尝试通过侧脑室注射LPS诱发神经炎症建立CMBs模型,结果显示中、高剂量LPS模型组脑表面微出血数量较对照组增多,且低、中、高剂量LPS模型组脑组织CMH数量较对照组增多,面积增大,提示造模成功。同时,本研究对造模大鼠进行了非空间记忆认知功能和运动功能的检测,为后续进一步研究CMBs与认知功能的关系提供了参考。
既往研究证实神经炎症是导致神经退行性疾病的重要病因,是治疗神经退行性疾病的重要靶点。炎症可导致内皮细胞损伤和血-脑屏障通透性增加[10],使红细胞等血管内物质外渗并沉积于组织导致CMBs的形成。炎症引发早期和持续的周围小胶质细胞迁移和星形胶质细胞增生,导致后续的树突变性和神经元坏死[11],从而导致认知功能下降。本研究结果显示,随着LPS浓度升高,LPS模型大鼠新物体辨别指数呈下降趋势,提示大鼠经LPS干预后其认知功能可能已开始发生改变,但尚未达统计学差异,其原因可能为本研究诱发的是急性CMBs模型,而认知功能受损与慢性持续损伤关系密切,因此大鼠尚未出现具有统计学差异的认知行为学改变。有关脑室单次注射LPS法造模大鼠认知功能的确切变化可参考Fisher教授团队的腹腔注射LPS的CMBs模型思路[2],从造模后2 d(急性期)和造模后7 d(亚急性期)两个时间点分别探索模型大鼠的认知功能变化。本研究旷场实验结果显示,4组大鼠在水平运动距离和垂直运动次数两方面比较差异无统计学意义,这与Lee等[12]研究结果一致,表明侧脑室注射LPS未影响动物的运动功能,进一步提示大鼠的行为表现差异是由记忆认知功能引起而非病理因素等引起,可排除躯体因素的干扰。本研究结果显示,大鼠脑组织GFAP表达水平与CMH的数量和大小呈正相关,表明CMBs与星形胶质细胞激活有关。星形胶质细胞可上调突触破坏性基因,在神经炎症中具有损伤效应,随着炎症反应愈烈,可导致微出血数量越多、范围越广。
本研究中,对照组与低剂量LPS组大鼠均存活,而中、高剂量LPS模型组大鼠有死亡情况;与低剂量LPS组比较,中剂量LPS组大鼠CMH数量明显增多,面积增大,而中、高剂量组间比较无统计学差异。结合大鼠存活率和微出血诱导情况,作者推荐75 μg剂量LPS侧脑室注射可作为诱导大鼠CMBs相对理想造模方法。
综上所述,本研究结果显示,运用脑立体定位仪侧脑室单次注射LPS方法可诱导大鼠CMBs模型,其中75 μg剂量LPS诱导CMBs较为理想。与现有的CMBs动物模型方法相比,侧脑室单次注射LPS方法既可满足CMBs随机多发的特点又可以满足行为学的评估。但本研究目前尚存以下不足:未进行影像学观察;所造模型为急性CMBs模型,而临床CMBs大多呈亚急性或慢性。因此,今后如能借助SWI影像学技术可能会更全面、更精确地观察大鼠CMBs情况;此外,进一步探索LPS剂量和注射频率以制备更符合临床的CMBs动物模型,可为深入研究CMBs的病理生理机制提供参考。
