直径不大于5 cm 孤立性肝癌:射频消融与手术治疗的比较
2022-09-22张桥莫阿里高恒毅周伟夏丰张伟桥陈伟强
张桥,莫阿里,高恒毅,周伟,夏丰,张伟桥,陈伟强
原发性肝癌(primary hepatic carcinoma,PLC)是起源于肝细胞或胆管上皮细胞的恶性肿瘤,其中HCC 最为常见,约占90%[1],目前HCC 已经成为全球第六大常见恶性肿瘤,也是导致癌症相关死亡的第4 大原因,全世界每年平均约有78 万人死于HCC[2]。HCC 患者往往早期临床症状不典型,出现腹痛、黄疸、腹部肿块等临床症状时,大多已失去手术切除(surgical resection,SR)的机会。虽然近年来靶向治疗、免疫治疗在晚期HCC 的相关领域取得重大进展,但患者的长期预后仍然较差[3,4]。射频消融(radiofrequency ablation,RFA)是早期HCC 根治性治疗的重要手段,具有创伤小、安全性高及重复性应用等优点[5]。一项来自于意大利的Alessandro 等人的研究表明,对于直径≤2 cm 的HCC 有效率甚至达到100%,SR 和RFA的预后相似[6]。考虑到RFA 是直径通过热效应引起肿瘤组织坏死[7],其发挥诱导肿瘤坏死作用的区域存在一定上限。所以对于直径稍大的HCC,特别是大肝癌(large hepatocellular carcinoma,LHCC)的治疗上仍有争议。为了探究RFA 治疗早期HCC的有效临界直径,我们利用大样本、多中心数据对肿瘤大小进行了分层,分别比较SR 和RFA 在各个亚组中患者生存预后,以期确定两者的优劣性。
1 材料与方法
1.1 病人资料
回顾分析了2015年1月~2018年12月收治的直径≤5 cm 孤立性HCC 患者的临床资料。通过增强CT 或增强MRI 进行测量确定其肿瘤最大直径。根据肿瘤直径将患者分为3 个亚组:≤2 cm组、>2 cm 且≤3 cm 组和>3 cm 组且≤5 cm 组,分别定义为A 组、B 组和C 组。
纳入标准:①诊断HCC时患者年龄大于18岁;②孤立性病灶,肿瘤直径不超过5 cm;③肝功能Child-Pugh 为A 级或B 级;④术前未接受任何辅助治疗;⑤术后病理或临床诊断为肝细胞患者;⑥随访资料完善。排除标准:①心、脑、肾功能障碍;②合并有其他肿瘤病史;③门静脉、肝静脉癌栓或邻近器官侵犯或远处转移;④临床病理基本资料不全;⑤术后病理提示切缘阳性。术后治疗方式包括:再次射频消融、再次手术切除、肝移植、经肝动脉化疗栓塞术、靶向治疗、免疫治疗等。
1.2 治疗方式
1.2.1 手术切除 术前检查包括上腹部增强CT/MRI、肝肾功能、凝血功能、血常规、甲胎蛋白等常规检查。手术切除均由高年资副主任医师以上的外科医生施行,根据患者的肿瘤位置、肿瘤大小以及与肝内大血管毗邻位置关系,制定相应的手术方案。手术切除的方式分为腹腔镜下肝切除术和开腹肝切除术。手术基本过程:待患者全麻后,常规消毒。进入腹腔后首先观察肿瘤是否存在邻近器官的远处转移,利用器械分离相应的组织结构。接下来间隙阻断第一肝门,必要时选择性地阻断第二肝门。根据肿瘤位置离断相应的肝段,检查标本切缘无肿瘤残余后,充分止血,松开第一肝门和第二肝门,关腹。
1.2.2 射频消融 各个医疗中心根据各单位的医疗器械和设备进行射频消融治疗。患者取仰卧位,术前根据肿瘤位置进行相应部位的常规消毒、铺巾、局部麻醉等操作。在超声探头引导下确定肿瘤位置,选择进针位置与方向。接下来将射频消融针插入肿瘤中心,进行射频消融治疗,每次消融时间约6~8 min。可以选择多次进针,直到消融范围完全覆盖肿瘤,肿瘤靠近腹腔大血管及胃肠等脏器处采用无水酒精进行消毒。
1.3 术后随访
所有接受治疗的患者通过门诊、电话、微信等方式进行随访。在术后2 个月内,进行胸部和腹部CT 或MRI、甲胎蛋白、肝肾功能和血常规检查。术后2年内每隔3~4 个月进行一次复诊,此后每6 个月进行一次。当肿瘤复发时,根据复发情况和患者意愿对患者进行治疗。治疗手段包括:手术、RFA、TACE、靶向治疗、免疫治疗或肝移植。对终末期患者进行了生命维持治疗。研究终点包括无复发生存(recurrence-free survival,RFS)和总体生存(overall survival,OS)。OS 定义为从手术日期到患者死亡或最后一次随访的日期,RFS 定义为从手术日期到术后肿瘤复发或最后一次随访的日期。随访截止日期为2020年12月30 日。
1.4 统计学方法
连续变量以中位数(范围)或平均值±标准差(SD)表示,分类变量以患者人数(n)或百分比(%)表示。连续变量采用t检验或Mann-WhitneyU检验进行比较,分类变量采用χ2检验或Fisher 精确检验进行比较。采用Kaplan-Meier 法绘制RFA 组和SR 组患者的RFS 和OS 生存曲线,并采用Logrank 检验比较其差异。研究的所有统计分析和可视化均通过R version 3.6.1分析。P值<0.05 被认为具有统计学意义。
2 结 果
2.1 一般资料特征
本研究共纳入606 例HCC 患者,其中男性438人,占总人数的72.3%,年龄≥60 岁的患者416 例(68.6%)。绝大多数患者存在HBV 感染,占总人数的90.3%,只有24 人感染HCV。术前影像学检查所示约有75%的患者存在肝硬化的病理基础。肿瘤直径的平均值为3.1 cm。SR 组有362 列,而RFA 组有244 例。
2.2 总体人群的比较
2.2.1 在总体人群中RFA 与SR 组的临床资料的比较 总体人群中,行SR 患者364 例,RFA 患者244 例。对两组患者的临床资料进行比较,发现RFA 组的肿瘤直径比SR 组小且年龄≥60 岁、Child-Pugh分级B 的患者多,除年龄存在显著差异外(P<0.05),其他临床因素两组之间无统计学意义(P>0.05)。具体的内容详见表1。
表1 总体人群中RFA 组和SR 组临床病理资料的比较[n(%)](±s)
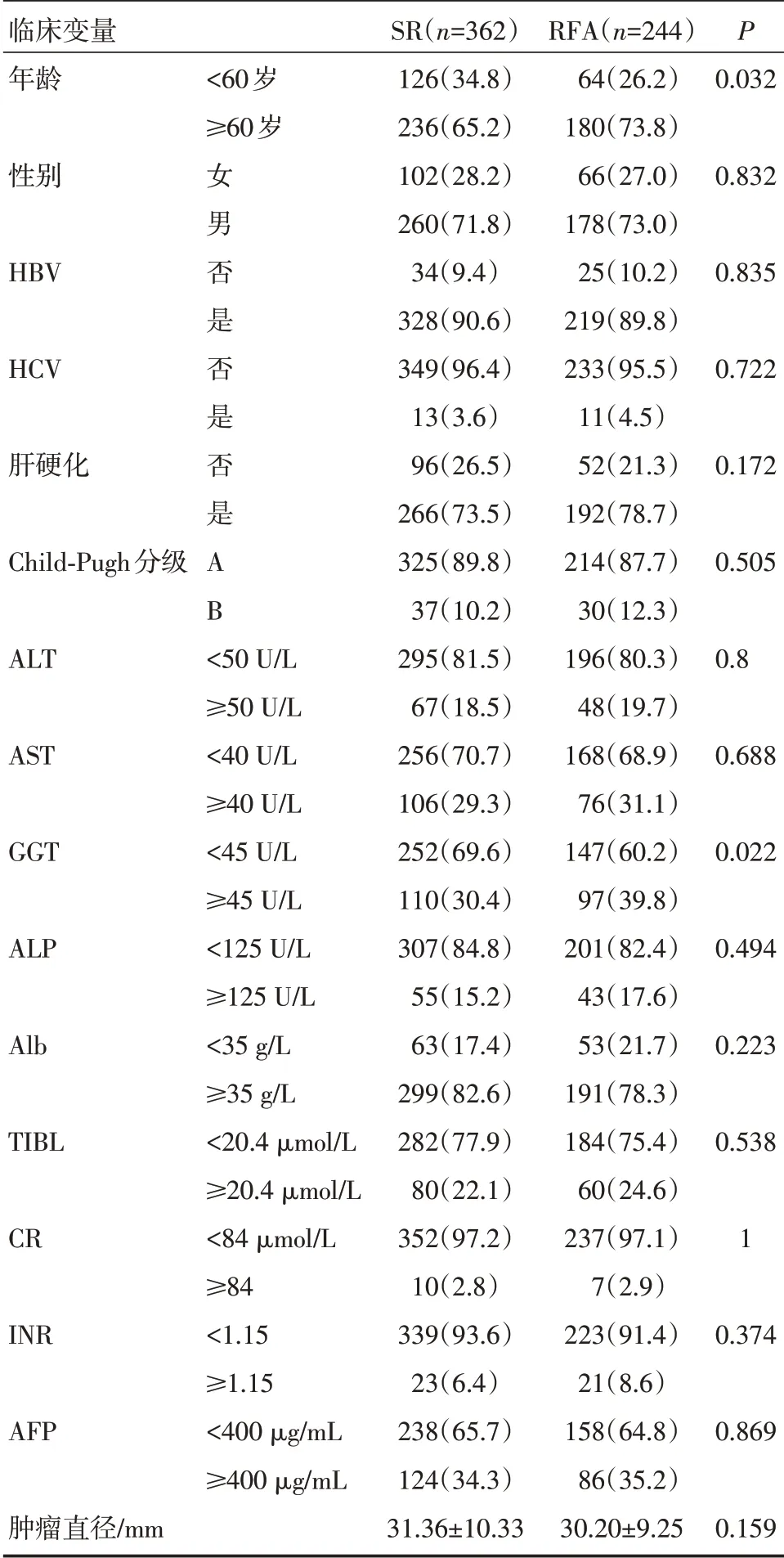
表1 总体人群中RFA 组和SR 组临床病理资料的比较[n(%)](±s)
注:ALT:谷丙转氨酶;AST:天冬氨酸转氨酶;GGT-γ:氨基丁酸转氨酶;ALP:碱性磷酸酶;Alb:白蛋白;TIBL:总胆红素;CR:肌酐;INR:标准化国际比值;AFP:甲胎蛋白;RFA:射频消融;SR:外科手术切除;HCV:丙型肝炎病毒
临床变量年龄P<60岁≥60岁0.032性别0.832 HBV 0.835 HCV 0.722肝硬化0.172 Child-Pugh分级女男否是否是否是AB 0.505 ALT 0.8 AST 0.688 GGT 0.022 ALP 0.494 Alb 0.223 TIBL 0.538 CR 1 INR 0.374 AFP<50 U/L≥50 U/L<40 U/L≥40 U/L<45 U/L≥45 U/L<125 U/L≥125 U/L<35 g/L≥35 g/L<20.4 μmol/L≥20.4 μmol/L<84 μmol/L≥84<1.15≥1.15<400 μg/mL≥400 μg/mL 0.869肿瘤直径/mm SR(n=362)126(34.8)236(65.2)102(28.2)260(71.8)34(9.4)328(90.6)349(96.4)13(3.6)96(26.5)266(73.5)325(89.8)37(10.2)295(81.5)67(18.5)256(70.7)106(29.3)252(69.6)110(30.4)307(84.8)55(15.2)63(17.4)299(82.6)282(77.9)80(22.1)352(97.2)10(2.8)339(93.6)23(6.4)238(65.7)124(34.3)31.36±10.33 RFA(n=244)64(26.2)180(73.8)66(27.0)178(73.0)25(10.2)219(89.8)233(95.5)11(4.5)52(21.3)192(78.7)214(87.7)30(12.3)196(80.3)48(19.7)168(68.9)76(31.1)147(60.2)97(39.8)201(82.4)43(17.6)53(21.7)191(78.3)184(75.4)60(24.6)237(97.1)7(2.9)223(91.4)21(8.6)158(64.8)86(35.2)30.20±9.25 0.159
2.2.2 总体人群中RFA 与SR 组的临床预后的比较 平均随访时间为33.3 个月,随访期间共153 出现了死亡结局,占总人数的25.2%,出现复发的患者268 例(44.2%)。RFA 组1、3 和5年的OS分别为90.4%、62.8%和50.6%;SR组中1、3和5年的OS分别为94.6%、81.2%和70.0%,SR 组患者的OS 明显高于RFA 组,差异具有统计学差异(P<0.05,图1A)。RFA 组1、3 和5年的RFS分别为86.5%、49.3%和36.3%;SR 组中1、3 和5年的RFS分别为94.3%、64.7%和46.9%。RFA 组患者的RFS 明显低于手术切除术组,差异具有统计学差异(P<0.05,图1B)。
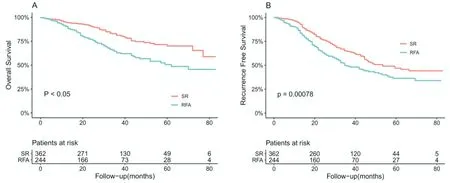
图1 总体人群中RFA 与SR 组临床预后的ROC
2.3 A 组人群的比较
2.3.1 A 组人群中RFA 与SR 组的临床资料的比较 在A 组人群中,行SR 的患者51 例患者,RFA组患者26 例。进过对两组患者的一般临床资料进行比较,两组临床基本变量无统计学意义(P>0.05)。
2.3.2 A 组人群中RFA 与SR 组的临床预后的比较 A亚组患者随访期间共有13出现了死亡结局,出现复发的患者37 例。RFA 组1、3 和5年的OS分别为92.3%、81.6%和73.5%;SR 组中1、3 和5年的OS分别为93.9%、84.8%和80.9%,SR 组的OS 与RFA 组差异无统计学差异(P>0.05,图2A)。RFA组1、3和5年的RFS分别为92.0%、75.5%和54.1%;SR 组中1、3 和5年的RFS分别为92.0%、76.1%和63.5%。RFA 组患者的RFS 与SR 组大致相当,无统计学差异(P>0.05,图2B)
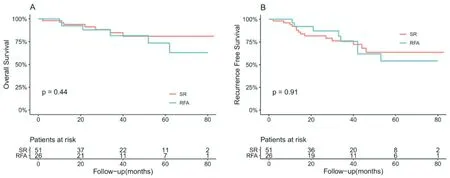
图2 A 组人群中RFA 与SR 组临床预后的ROC
2.4 B 组人群的比较
2.4.1 B 组人群中RFA 与SR 组的临床资料的比较 B 组中,行SR 患者128 例患者,RFA 组患者111 例。进过对两组患者的一般临床资料进行比较,临床基本变量在两组中差异无统计学意义(P>0.05)。
2.4.2 B 组人群中RFA 与SR 组的临床预后的比较 B亚组患者中,随访期间共有59出现了死亡结局,出现复发的患者107 例。RFA 组1、3 和5年的OS分别为88.9%、66.8%和58.1%;SR 组中1、3 和5年的OS分别为97.6%、82.2%和58.7%,SR 组的OS 优于RFA 组,存在统计学差异(P<0.05,图3A)。RFA 组1、3 和5年的RFS分别为83.8%、48.7%和40.7%;SR组1、3和5年的RFS分别为95.3%、65.9%和45.3%。RFA 组的RFS 较SR 组差,存在统计学差异(P<0.05,图3B)。
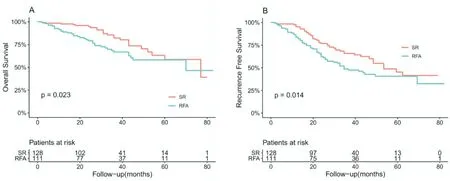
图3 B 组人群中RFA 与SR 组临床预后的ROC
2.5 C 组人群的比较
2.5.1 C 组人群中RFA 与SR 组的临床资料的比较 C 组人群中,行SR 患者183 例患者,RFA 组患者107 例。我们发现RFA 组的肿瘤直径比SR 组小,Child-Pugh分级B 的患者及年龄≥60 岁的多,但无统计学意义(P>0.05)。其他临床因素在两组的差异无统计学意义(P>0.05)。
2.5.2 C 组人群中RFA 与SR 组的临床预后的比较 C 亚组患者,随访期间共有81 出现了死亡结局,出现复发的患者139 例。RFA 组1、3 和5年的OS分别为91.6%、53.9%和38.7%;SR 组中1、3 和5年的OS分别为92.7%、79.2%和72.9%,SR 组患者的OS 显著优于RFA 组(P<0.05,图4A)。RFA组1、3和5年的RFS分别为77.4%、42.8%和31.1%;而 在SR 组 中1、3 和5年 的RFS分 别 为94.3%、60.9%和42.9%。RFA 组患者的RFS 显著差于SR组(P<0.05,图4B)。
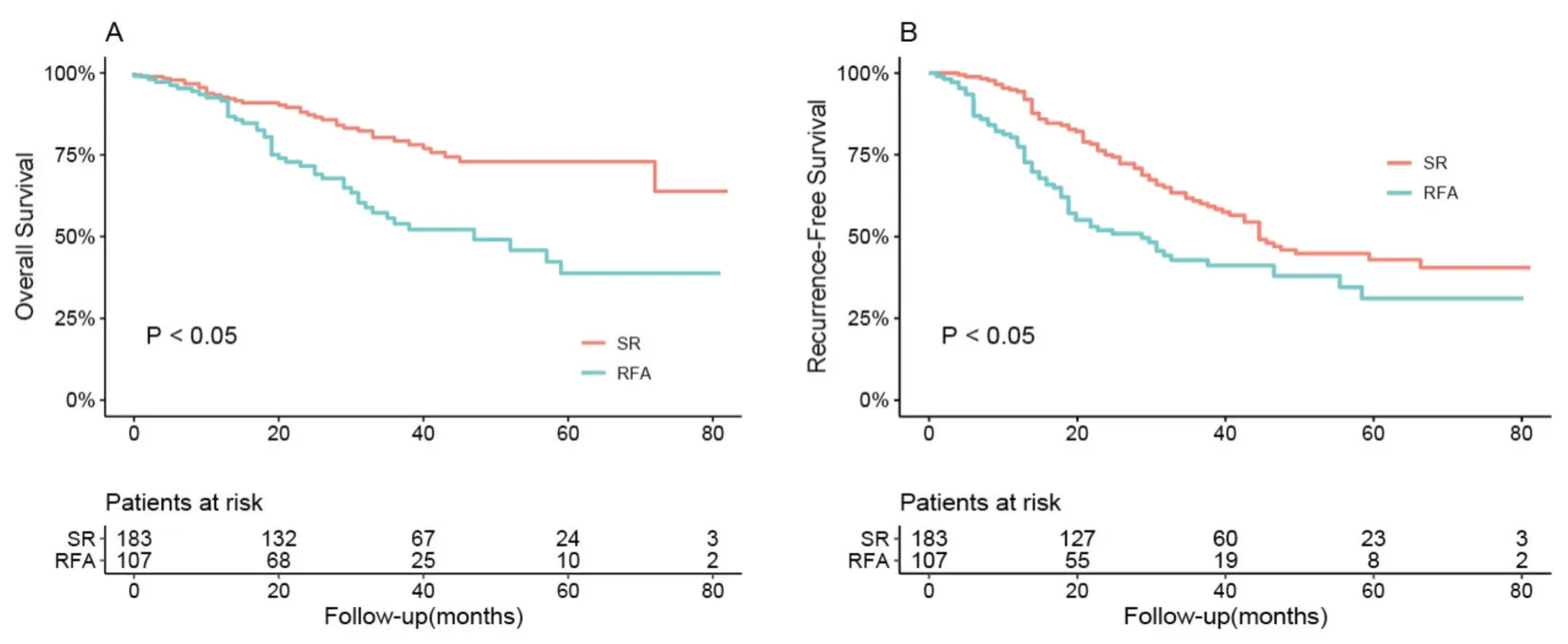
图4 C 组人群中RFA 与SR 组临床预后的ROC
2.6 比较不同肿瘤直径临床病理特征
通过比较SR 组中各亚组的术后临床病理资料,结果发现C 组的微血管浸润(MVI)率为32.2%,明显高于A 组的15.7%和B 组的15.6%,差异具有统计学差异(P<0.05)。而其他临床病理资料无统计学差异(P>0.05,表2)。而对于行RFA 的患者,C 组和B 组年龄较A 组的患者年龄明显要大,差异具有统计学意义(P<0.05,表3),其余临床基本资料大致相等,差异无统计学意义(P>0.05,表3)。
表2 在SR 组中不同肿瘤直径的亚组临床病例资料的比较[n(%)](±s)
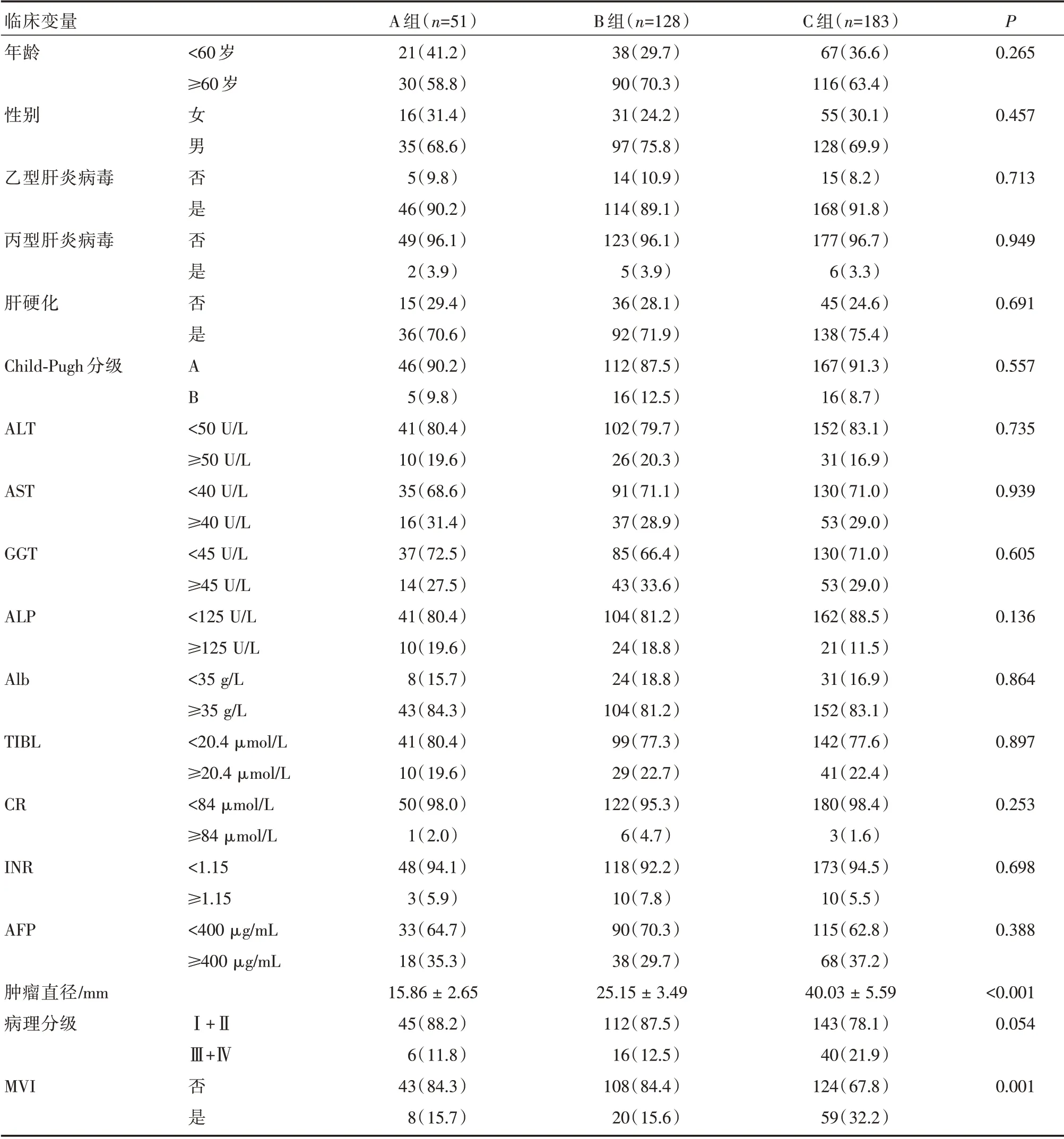
表2 在SR 组中不同肿瘤直径的亚组临床病例资料的比较[n(%)](±s)
注:ALT:谷丙转氨酶;AST:天冬氨酸转氨酶;GGT-γ:氨基丁酸转氨酶;ALP:碱性磷酸酶;Alb:白蛋白;TIBL:总胆红素;CR:肌酐;INR:标准化国际比值;AFP:甲胎蛋白;MVI:微血管浸润
临床变量年龄P<60 岁≥60 岁0.265性别0.457乙型肝炎病毒0.713丙型肝炎病毒0.949肝硬化0.691 Child-Pugh分级女男否是否是否是AB 0.557 ALT 0.735 AST 0.939 GGT 0.605 ALP 0.136 Alb 0.864 TIBL 0.897 CR 0.253 INR 0.698 AFP<50 U/L≥50 U/L<40 U/L≥40 U/L<45 U/L≥45 U/L<125 U/L≥125 U/L<35 g/L≥35 g/L<20.4 μmol/L≥20.4 μmol/L<84 μmol/L≥84 μmol/L<1.15≥1.15<400 μg/mL≥400 μg/mL 0.388肿瘤直径/mm病理分级Ⅰ+ⅡⅢ+Ⅳ<0.001 0.054 MVI否是A 组(n=51)21(41.2)30(58.8)16(31.4)35(68.6)5(9.8)46(90.2)49(96.1)2(3.9)15(29.4)36(70.6)46(90.2)5(9.8)41(80.4)10(19.6)35(68.6)16(31.4)37(72.5)14(27.5)41(80.4)10(19.6)8(15.7)43(84.3)41(80.4)10(19.6)50(98.0)1(2.0)48(94.1)3(5.9)33(64.7)18(35.3)15.86±2.65 45(88.2)6(11.8)43(84.3)8(15.7)B 组(n=128)38(29.7)90(70.3)31(24.2)97(75.8)14(10.9)114(89.1)123(96.1)5(3.9)36(28.1)92(71.9)112(87.5)16(12.5)102(79.7)26(20.3)91(71.1)37(28.9)85(66.4)43(33.6)104(81.2)24(18.8)24(18.8)104(81.2)99(77.3)29(22.7)122(95.3)6(4.7)118(92.2)10(7.8)90(70.3)38(29.7)25.15±3.49 112(87.5)16(12.5)108(84.4)20(15.6)C 组(n=183)67(36.6)116(63.4)55(30.1)128(69.9)15(8.2)168(91.8)177(96.7)6(3.3)45(24.6)138(75.4)167(91.3)16(8.7)152(83.1)31(16.9)130(71.0)53(29.0)130(71.0)53(29.0)162(88.5)21(11.5)31(16.9)152(83.1)142(77.6)41(22.4)180(98.4)3(1.6)173(94.5)10(5.5)115(62.8)68(37.2)40.03±5.59 143(78.1)40(21.9)124(67.8)59(32.2)0.001
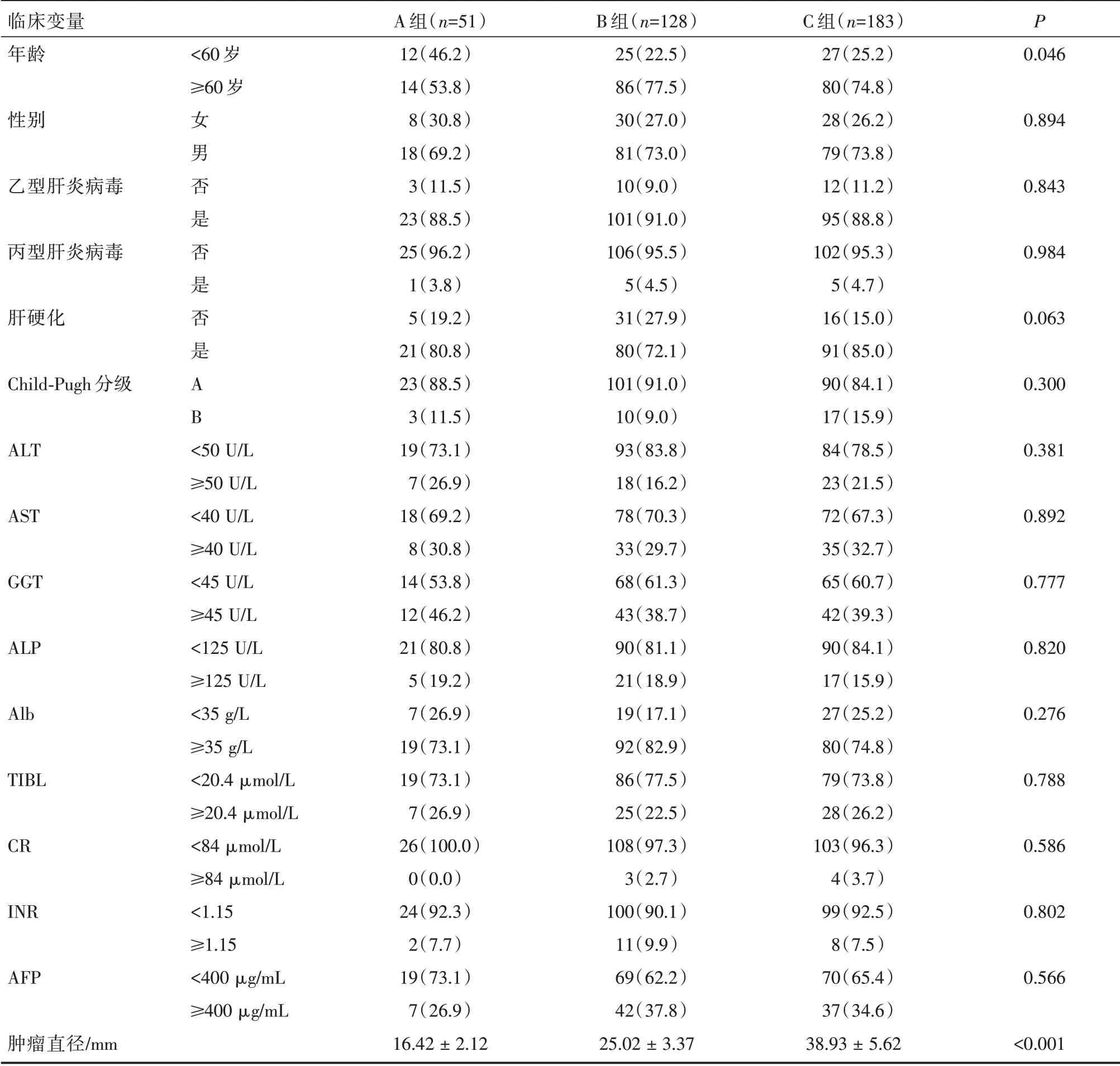
表3 RFA 组中不同肿瘤直径的亚组临床病例资料的比较(n,%)
3 讨 论
在本项回顾性的研究中,我们根据肿瘤直径对患者进行分层并在各亚组中比较RFA 和SR 组患者的RFS 和OS。结果发现对于肿瘤直径≤2 cm的HCC 患者,RFA 可以达到与SR 的相同的疗效,这与过去的研究结论基本一致[8,9]。Peng 等人开展一项回顾性的临床研究表明对于≤2 cm 的HCC,RFA 的临床疗效完全可以与SR 相媲美,而且他们也建议RFA 更加适合肿瘤位置较深的患者[8]。另一项来自于意大利的多中心回顾性研究也指出对于≤2 cm 的HCC 患者,SR 组与RFA 组的RFS 和OS无显著差异[9]。
足够宽的手术切缘是减低HCC 术后复发的重要因素[10-12],一些学者认为手术切除的安全切缘宽度为1~2 cm[13,14],外科手术切除的优势就在于能够保证足够宽的安全的手术边距。目前,一般RFA 的有效直径范围甚至可达到5 cm[8]。所以对于直径≤2 cm 的HCC,RFA 完全可以使肿瘤本身坏死的同时创造出一个直径至少1 cm 的安全边缘。正因为如此APASL 指南也建议将RFA 作为治疗直径≤2 cm 孤立性HCC 的一线方案[15],与SR相比,RFA 创伤更小、费用更低,肿瘤复发时可重复性更高。所以我们有理由相信对于此类HCC 患者,RFA 能作为一线的治疗方案。
RFA 是否可以达到SR 的疗效,这一问题目前尚且存在很大争议[16]。Lee 等[17]研究认为RFA 治疗肿瘤直径3~5 cm HCC 的疗效与SR 相差不大,但亦有多项回顾性的研究发现SR 较RFA 能明显提高患者总体生存率和无瘤生存率[18,19]。然而上述研究结论皆为单中心、小样本的研究,为了进一步探究该争议,我们联合国内大型医学中心的数据,研究发现对于肿瘤直径超过3 cm 的HCC 患者,无论是RFS 还是OS,SR 均优于RFA。
在直径大小2~3 cm 的HCC 的治疗策略上亦存在争议。EASL 认为RFA 完全可以替代SR。APASL 指南则建议将RFA 作为治疗直径≤2 cm孤立性HCC 的一线方案[15],而没有将直径大小2~3 cm的HCC纳入到RFA的治疗范围内。AASLD指南建议则将RFA 治疗范围临界值设定为2.5 cm,而当肿瘤直径2.5~3.0 cm 时则慎重选择RFA[20]。过去很少有研究针对2~3 cm 的HCC 群体对此开展相关研究。我们的研究表明SR 的OS 和RFS 均优于RFA。从射频消融的效率来看,对于直径<2 cm的HCC,其完全消融率为97.2%,而肿瘤直径<3 cm时,其完全消融率只有90%[9,21]。这提示RFA 在治疗2~3 cm HCC 时有相当数量的患者存在不完全消融。所以对于直径为2~3 cm 的HCC 患者应慎重选择RFA。综上,RFA 的适应人群应设定为肿瘤直径小于2 cm 的极早期肝细胞癌,而对于直径>2 cm 的HCC 患者应优先选择SR。
此外,我们也比较了不同肿瘤直径患者的临床病理资料,结果发现肿瘤直径与微血管浸润(MVI)阳性率相关。肿瘤直径>3 cm 的HCC 人群MVI 的阳性率为32.2%,而肿瘤直径<3 cm 组患者的MVI 阳性率仅为15%左右。这与国内学者研究结论大致相同[22]。从病理学的角度上说,HCC 的病灶不仅仅包括主癌灶,也包括及其周围的MVI和卫星结节[23]。肿瘤直径越大,MVI分布范围更宽[24]。而如今的影像学无法确切地评估MVI 的有无以及MVI分布范围,RFA 只能保证主病灶消融质量,却不能保证MVI 是否得到有效清除,这势必影响RFA 的疗效。而在RFA 组中,我们发现在肿瘤直径较大患者中年龄≥60 岁较多,这一结果也是符合临床实践的。
因此,考虑到中体积的HCC 的MVI 阳性率高、浸润范围广等因素,RFA 难以充分地对其受侵犯的周围组织进行彻底清除,所以对于直径>2 cm 的HCC 并不推荐行RFA 治疗。
