胃上部癌行近端胃切除双通道吻合与全胃切除Roux-en-Y 吻合临床疗效比较的meta分析
2022-09-22刘辉惠远见狄茂军刘焱伟李俊谭华勇
刘辉,惠远见,狄茂军,刘焱伟,李俊,谭华勇
近年来,胃上部癌的发病率呈现上升趋势,胃上部癌主要包括食管胃结合部癌、胃底癌和部分胃体上段癌[1,2],该部位肿瘤的手术治疗方式争议颇多,主流手术方式为近端胃切除伴食管残胃吻合及全胃切除伴食管空肠吻合术[3]。行近端胃切除伴食管残胃吻合患者术后须忍受胃瘫、严重的胃食管反流等并发症[4,5],而全胃切除伴食管空肠吻合术降低了反流相关并发症,且在肿瘤根治方面存在优势,但同样带来术后贫血、营养状态不佳等问题,主要原因为食物不通过十二指肠径路,导致胰腺内分泌及外分泌功能减退、分泌延迟等,继而出现食物消化吸收不充分、术后低营养状态[6]。为改善术后生活质量,近年有学者探索近端胃切除,保留残胃的双通道重建术[7],理论上该术式可克服传统近端胃切除食管残胃吻合反流的不足,同时可从一定程度上改善术后营养状态[8],但目前该术式的安全性及临床疗效仍存在争议[9,10]。本研究旨在收集胃上部癌行近端胃根治,残胃空肠双通道重建与全胃切除Roux-en-Y 吻合的临床研究,采用Meta分析方法比较两种术式的临床安全性及疗效。
1 资料与方法
1.1 文献检索
中文数据库选定中国知网(CNKI)、万方数据库及维普中文期刊网,外文数据库选定PubMed 数据库、Cochrane Library、Embase 数据库,文献检索时间限制为建库至2021年03月29 日。中文检索词为“胃癌”或“胃上部癌”,“双通道”或“双通道吻合”或“双通道重建”加“全胃切除”或“全胃根治术”等。英文检索词为(“gastric cancer”or“upper gastric cancer”or“proximal gastrectomy”or“gastric neoplasms”or“stomach neoplasms”)AND(“double tract reconstruction”or“double tract anastomosis”or“dual-channel”)AND(“gastrectomy”or“total gastrectomy”or“gastroenterostomy”)
1.2 文献纳入与排除标准
纳入标准:①研究类型:随机对照试验(RCT)和病例对照试验,研究文献为全文文献,语种限定中文和英文;②研究对象:胃上部癌行全胃切除或近端胃切除,双通道吻合术的患者,对年龄、性别、国家等无特殊要求;③干预措施:纳入研究的试验组采用胃近端切除联合食管-空肠与残胃-空肠双通道吻合术治疗胃上部癌(PG-DT 组),对照组采用全胃切除联合食管空肠Roux-en-Y 吻合术治疗胃上部癌(TG-RY 组);手术方式采用传统开腹、腹腔镜、机器人均可;④结局指标:纳入研究须至少包含或通过计算可得出以下一项结局指标:手术时间,术中出血量,术中淋巴结清扫数目,围手术期并发症,严重并发症(Clavien-Dindo 并发症分级3a 级以上),远期并发症(主要为倾倒综合征、反流性食管炎),术后1年营养相关指标(包括术后1年血红蛋白水平,术后1年总蛋白水平及白蛋白水平)。
排除标准:①研究对象肿瘤进展无法达到根治性切除;研究对象术前行新辅助治疗;②手术方式同时合并开胸术式;③不同文献中涉及的重复研究、文献综述、病例报告等;④无法找到全文及无足够的原始数据、所需的数据不完整及数据无法分析的试验。
1.3 文献筛选及资料提取
由两名专业人员严格按纳入和排除标准进行筛选,独立完成后交叉查对,按以下流程行文献筛选:遇有争议的文献,则求助第三方决定是否对有争议的研究予以纳入。分别应用Jadad 量表及Newcastle-Ottawa Scale 量表(NOS 量表)进行文献质量评价(随机对照试验采用Jadad 量表评价,病例对照试验采用NOS 量表评价)[11,12]。
1.4 统计学分析
本研究用Cochrane 协作网提供的RevMan 5.30软件进行统计分析,计量资料使用均数差(MD)及其95%CI,计数资料采用比值比(OR)及其95%CI分析统计量,以P<0.05 为差异有统计学意义。文献中各个研究间的异质性检验的检验效能设定为α=0.1,若无明显异质性(P≥0.1 或I2≤50%),使用固定效应模型进行合并;否则采用随机效应模型。若异质性较大,需进一步明确异质性来源,可试行敏感性分析,必要时对部分明显影响整体研究间同质性的文献在进行Meta 合并时予以剔除。对有明显临床异质性的研究,只进行描述性分析。
2 结 果
2.1 纳入文献一般情况
初步检索得到中文及英文文献共345篇,查阅摘要后阅读全文按照文献排除标准得到与本研究要求一致的文献共16篇,包括中文9篇及英文7篇。文献筛选流程见表1。所有研究中共有1346 例患者,纳入研究的基线指标如作者及发表年限、年龄、性别比例等见表1。
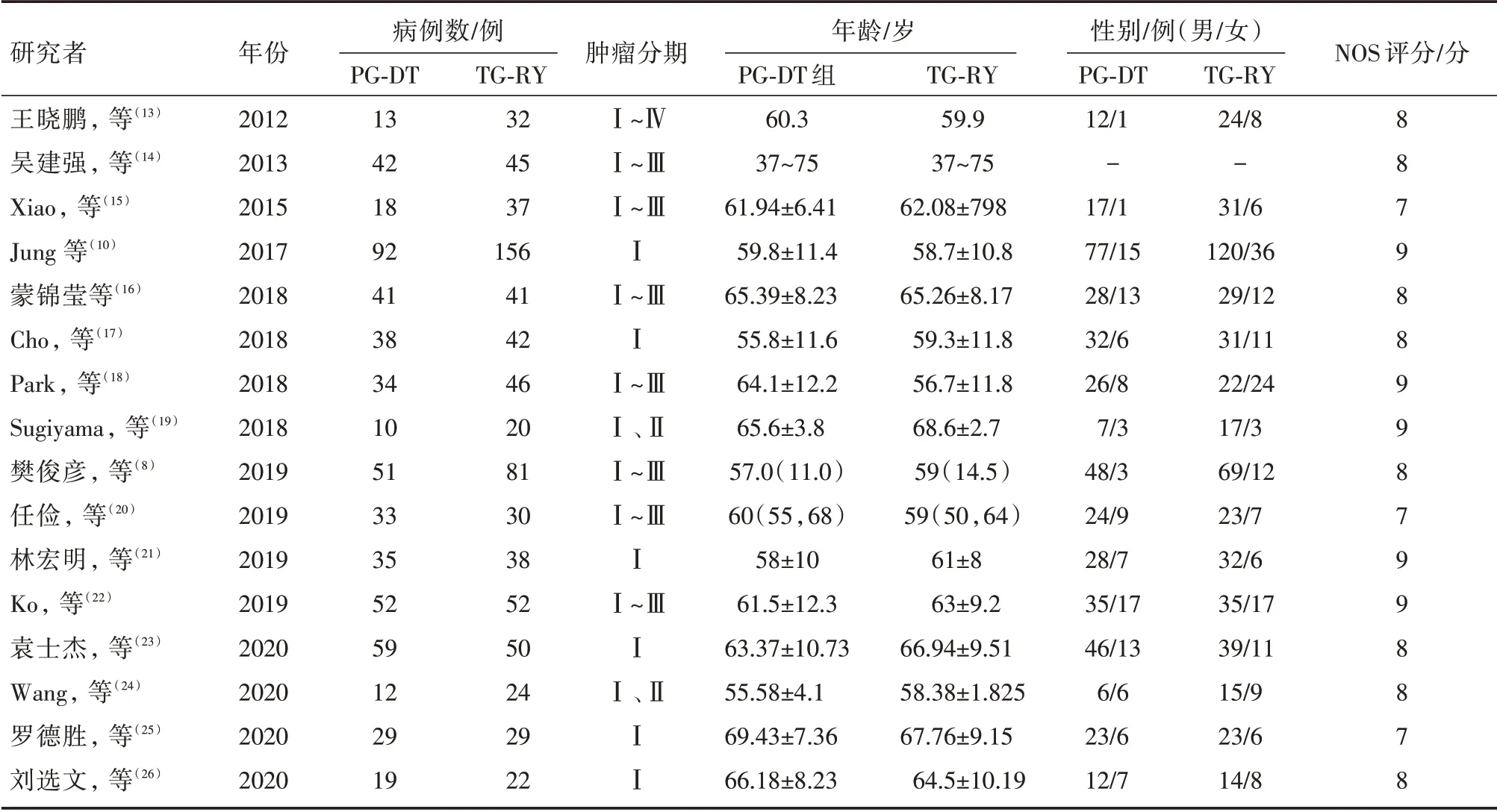
表1 示纳入文献一般情况
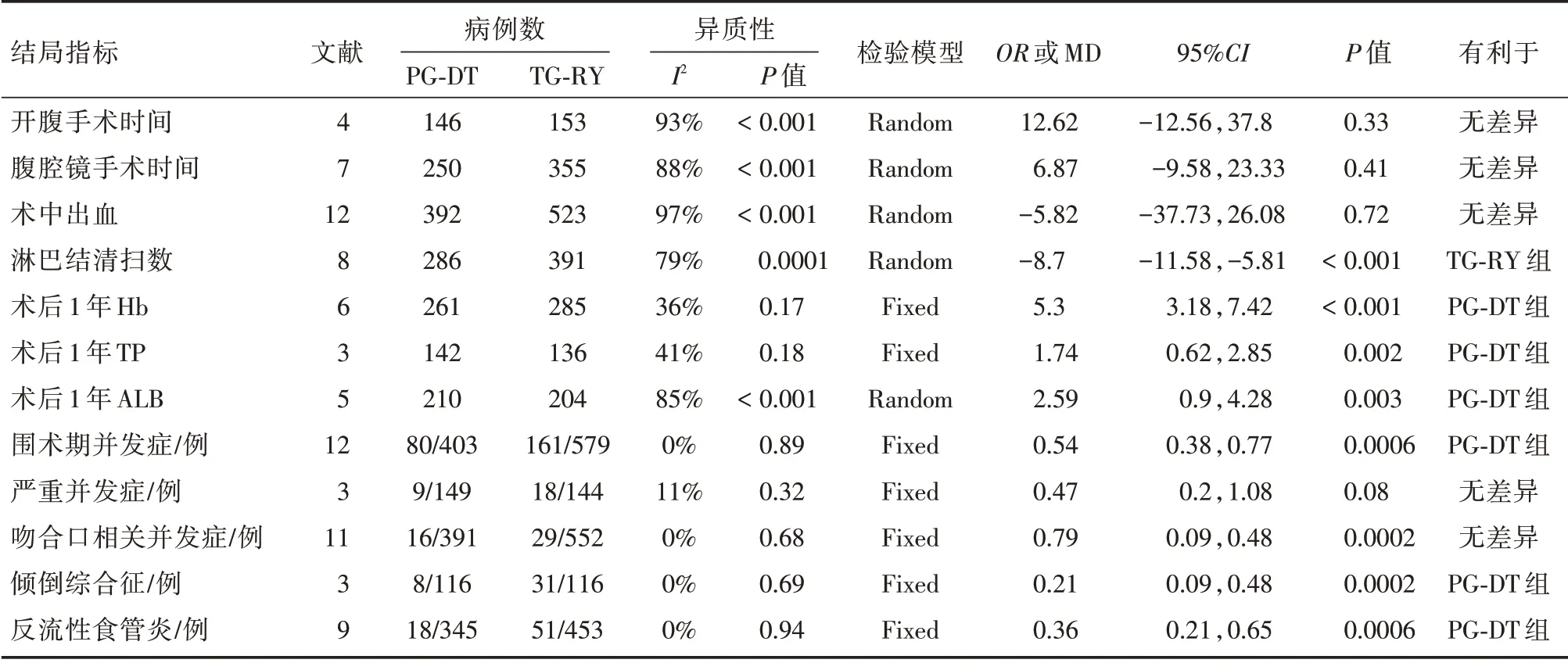
表2 示各结局指标行meta分析情况
2.2 纳入研究的质量评价
纳入研究的试验类型均为病例对照试验,采用NOS 量表评分,所有纳入研究研究对象均明确,有明确的纳入及排除标准,试验组及对照组均控制了最重要的混杂因素,其中7篇文献未明确说明退出及失访病例。纳入16篇文献NOS 量表评分结果示:3篇文献评分7分,8篇文献评分8分,5篇文献评分9分。均为高质量研究。见表1。
2.2.1 手术时间 手术时间存在开腹手术及腹腔镜手术差异,本研究分开腹手术亚组及腹腔镜手术亚组,分别行Meta分析。有14 项研究提及手术时间,其中1 项研究[26]数据无法提取,另2 项研究[14,15]研究对象未明确区分开腹及腹腔镜。剩余11项研究中,其中4 项研究[13,16,20,23]为开腹手术,各研究间统计学异质性较大(P<0.001,I2=95%),随机效应模型分析结果显示,PG-DT 组与TG-RY组间手术时间差异无统计学意义。见图2。当排除蒙锦莹等[16]的研究后,各研究间异质性降为0,行敏感性分析提示,结果稳定性较好(MD=13.68,95%CI:-14.69~42.04,P=0.34)。另外7 项研究[10,17-19,21,24,25]为腹腔镜手术,各研究间存在统计学异质性(P<0.001,I2=88%),随机效应模型分析结果显示,PG-DT 组与TG-RY 组间手术时间差异亦无统计学意义,行敏感性分析示,结果稳定性较 好(MD=1.76,95%CI:-14.33~17.86,P=0.83)。见图3。
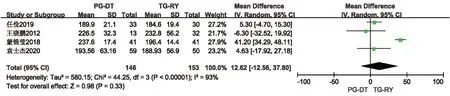
图2 PG-DT 组与TG-RY 组开腹手术时间比较
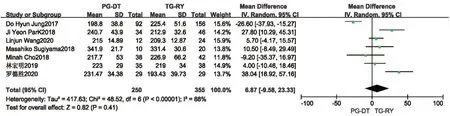
图3 PG-DT 组与TG-RY 组腹腔镜手术时间比较
2.2.2 术中出血量及术中淋巴结清扫个数 有14项研究提及术中出血量,其中2 项研究[8,18]数据无法分析,对另外12 项研究[10,13,15-17,19-22,24-26]进行分析,各研究间统计学异质性较大(P<0.001,I2=97%),使用随机效应模型分析,结果提示:PG-DT 组与TG-RY 组间术中出血量差异无统计学意义,行敏感性分析,稳定性亦较好(MD=-5.82,95%CI:-37.73~26.08,P=0.72)。见图4。因异质性较大,同时行描述性分析,14 项研究中,其中3 项研究[10,13,16]结果显示PG-DT 组较TG-RY 组术中出血量少,另11 项研究[8,15,17-22,24-26]均显示两组间术中出血量差异无统计学意义。此处异质性考虑为各个研究中心来源的研究对象肿瘤分期、肿瘤大小、位置不同,手术难度各异,且术者手术操作熟练程度不同所致。共有8 项研究[10,17-19,22,24-26]报道了术中淋巴结清扫个数,各研究间存在统计学异质性(P<0.001,I2=79%),使用随机效应模型,Meta分析结果提示TG-RY 组术中淋巴结清扫个数较多,差异有统计学意义,行敏感性分析提示,稳定性较好(MD=-7.35,95%CI:-8.55~-6.15,P<0.001)。见图5。
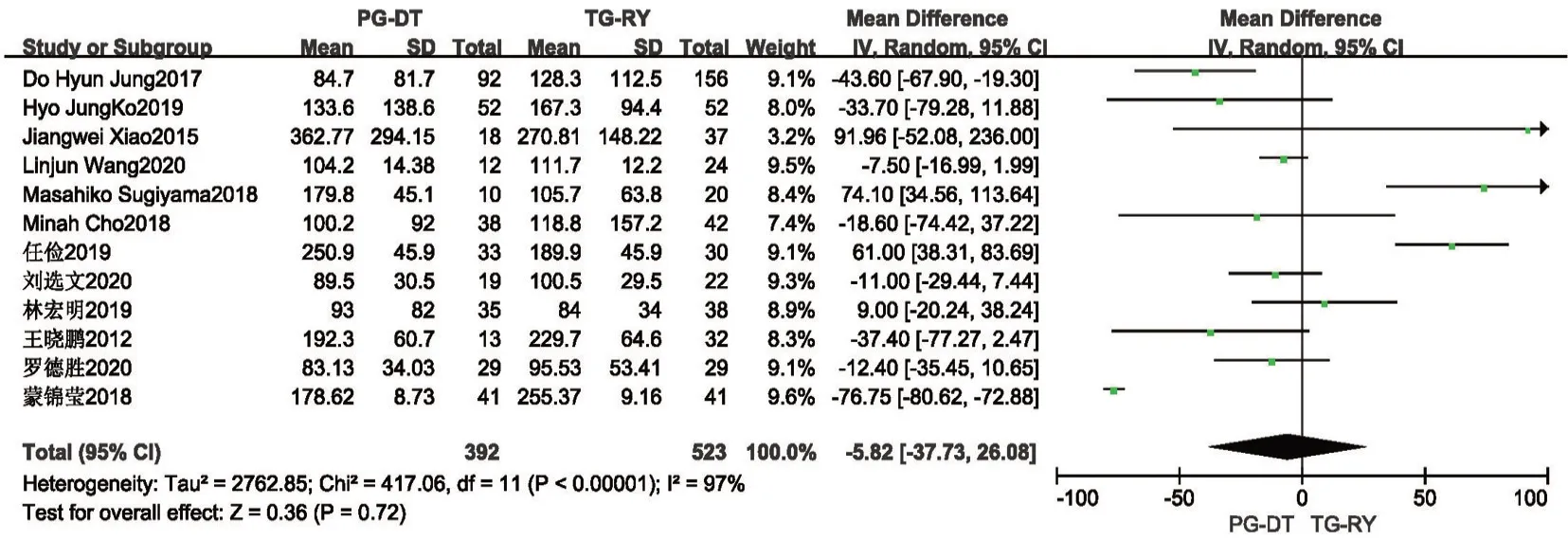
图4 PG-DT 组与TG-RY 组术中出血量比较
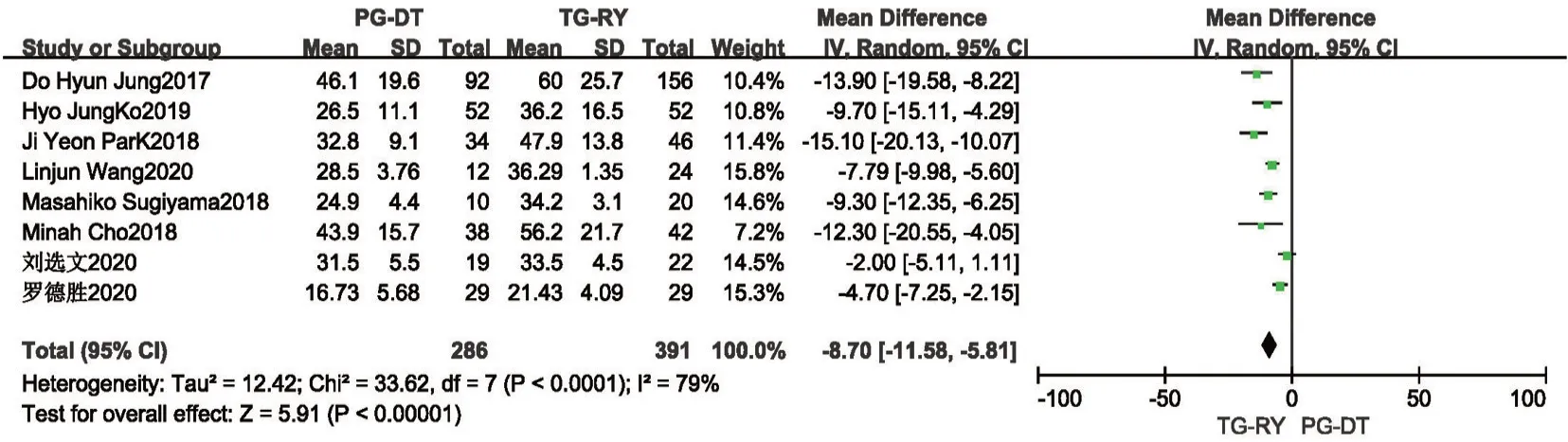
图5 PG-DT 组与TG-RY 组术中淋巴结清扫数目比较
2.2.3 围手术期总并发症、严重并发症及吻合口相关并发症 术后并发症按照Clavien-Dindo分级标准,1~2 级为轻微并发症,3a~4 级为严重并发症[27]。共12 项研究[8,10,13,15,17-19,21,22,24,25]报道了围手术期总并发症(部分文献描述为术后早期并发症,包括术后出血、腹腔感染、吻合口瘘及出血、肺部感染、切口感染等),各研究间无统计学异质性(P=0.89,I2=0%),使用固定效应模型,Meta分析结果提示PG-DT 组(19.8%)较TG-RY 组(27.1%)围手术期总并发症发生率低,差异有统计学意义(OR=0.56,95%CI:0.39~0.79,P<0.001)。见图6。共有3 项研究[17,22,23]报道了围手术期严重并发症(即Clavien-Dindo分级3 级以上并发症),各研究间无统计学异质性(P=0.32,I2=11%),使用固定效应模型,Meta分析结果提示两组间严重并发症差异无统计学意义(OR=0.47,95%CI:0.2~1.08,P=0.08)。见图7。其中单独列出吻合口相关并发症(包括吻合口瘘、出血、狭窄),共11 项研究[8,10,13,15-17,19,21,22,24,25]报道了吻合口并发症,各研究间无统计学异质性(P=0.32,I2=11%),使用固定效应模型,Meta分析结果提示PG-DT 组与TG-RY组术后吻合口并发症发生率差异无统计学意义(OR=0.75,95%CI:0.4~1.39,P=0.35)。见图8。

图6 PG-DT 组与TG-RY 组围手术期总并发症比较
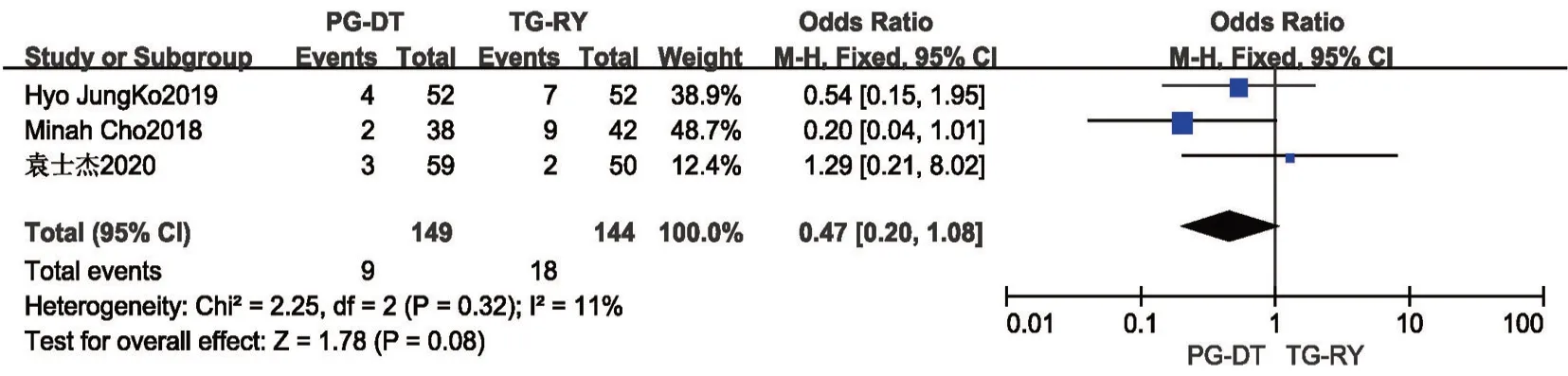
图7 PG-DT 组与TG-RY 组严重并发症比较
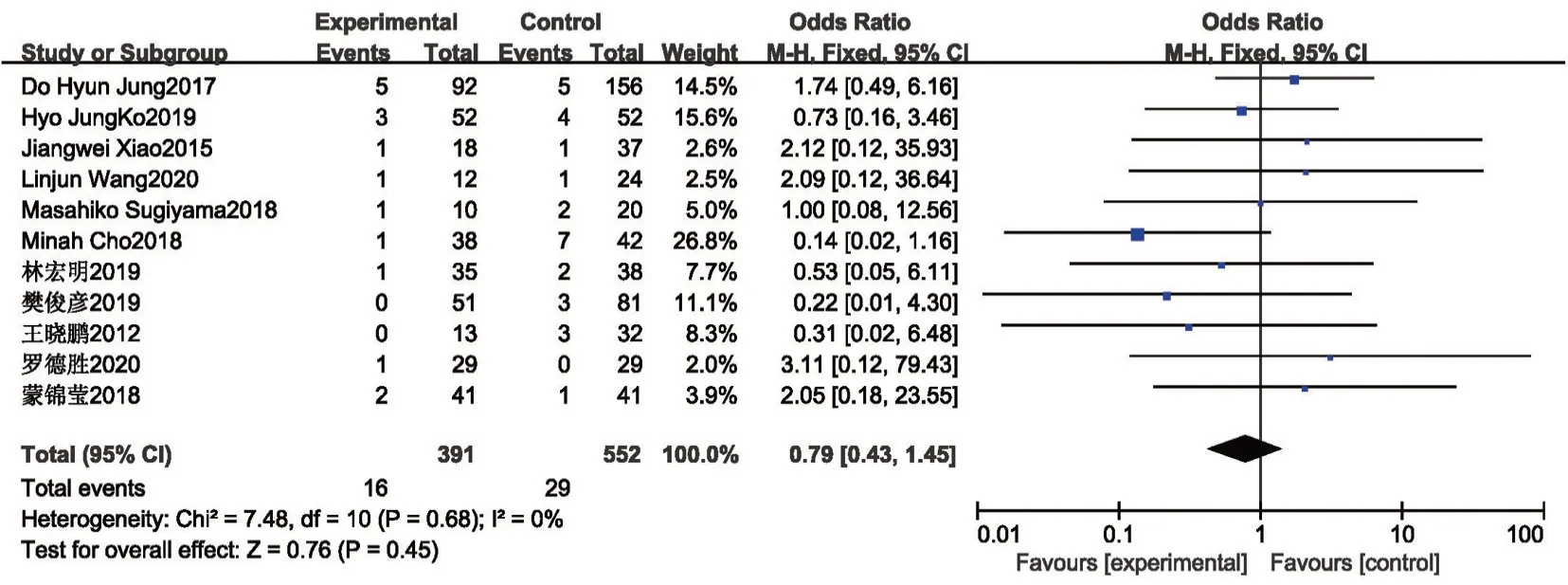
图8 PG-DT 组与TG-RY 组吻合口相关并发症比较
2.2.4 远期并发症(倾倒综合征、反流性食管炎)远期并发症中倾倒综合征与反流性食管炎对患者术后生活质量影响较大,本研究中分别予以分析。共有3篇文献[14,16,20]报道了倾倒综合征,各研究间无统计学异质性(P=0.69,I2=0%),使用固定效应模型,Meta分析结果提示PG-DT 组(6.8%)较TG-RY 组(26.7%)倾倒综合征发生率低,差异有统计学意义(OR=0.21,95%CI:0.09~0.48,P<0.001)。见图9。共有9篇文献[10,13-16,20-22,26]报道了反流性食管炎,各研究间无统计学异质性(P=0.94,I2=0%),使用固定效应模型,Meta分析结果提示PG-DT 组(5.2%)较TG-RY 组(11.25%)反流性食管炎发生率低,差异有统计学意义(OR=0.36,95%CI:0.21~0.65,P<0.001)。见图10。
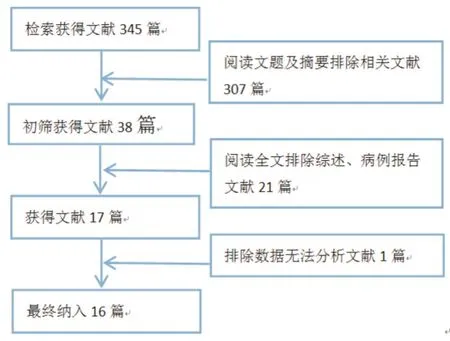
图1 文献选择流程图
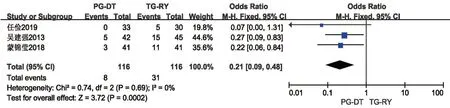
图9 PG-DT 组与TG-RY 组倾倒综合征比较
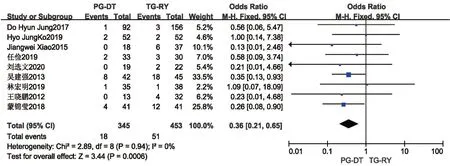
图10 PG-DT 组与TG-RY 组反流性食管炎比较
2.2.5 术后1年营养指标 包含血红蛋白水平、总蛋白水平、白蛋白水平此3 项结局指标。共6 项研究[8,14,16,20,21,23]报道了术后1年血红蛋白水平,各研究间统计学异质性小(P=0.17,I2=36%),使用固定效应模型,Meta分析结果提示PG-DT 组较TGRY 组术后1年血红蛋白水平高,差异有统计学意义(MD=5.3,95%CI:3.18~7.42,P<0.001)。见图11。共3 项研究[14,16,23]报道了术后1年总蛋白水平,各研究间统计学异质性小(P=0.41,I2=41%),使用固定效应模型,Meta分析结果提示PG-DT 组较TGRY 组术后1年总蛋白水平高,差异有统计学意义(MD=1.74,95%CI:0.62~2.85,P<0.001)。见图12。共5 项研究[14,16,20,21,23]报道了术后1年白蛋白水平,各研究间存在统计学异质性(P<0.001,I2=85%),使用随机效应模型,Meta分析结果提示PG-DT 组较TG-RY 组术后1年白蛋白水平高,差异有统计学意义,行敏感性分析,稳定性较好(MD=2.59,95%CI:0.9~4.28,P<0.001)。见图13。
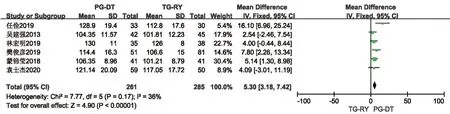
图11 PG-DT 组与TG-RY 组术后1年血红蛋白水平比较
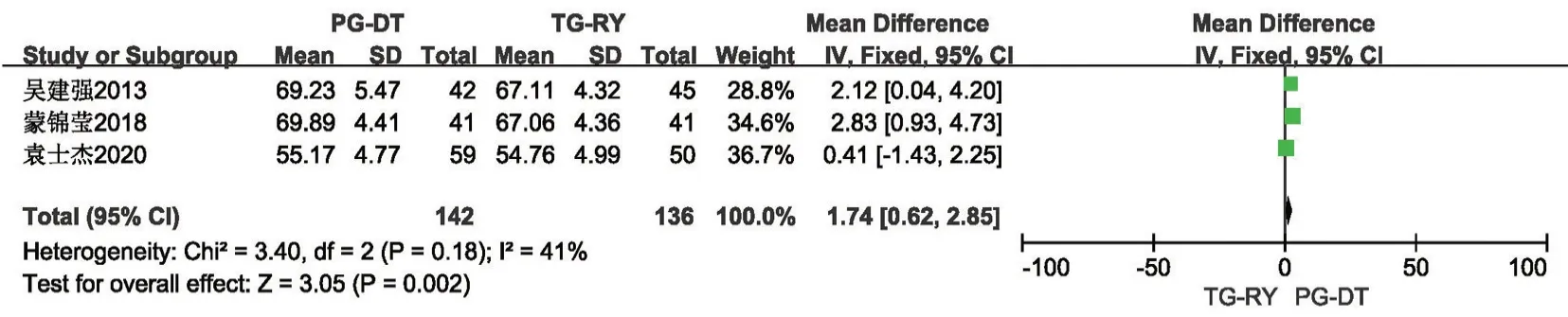
图12 PG-DT 组与TG-RY 组术后1年总蛋白水平比较
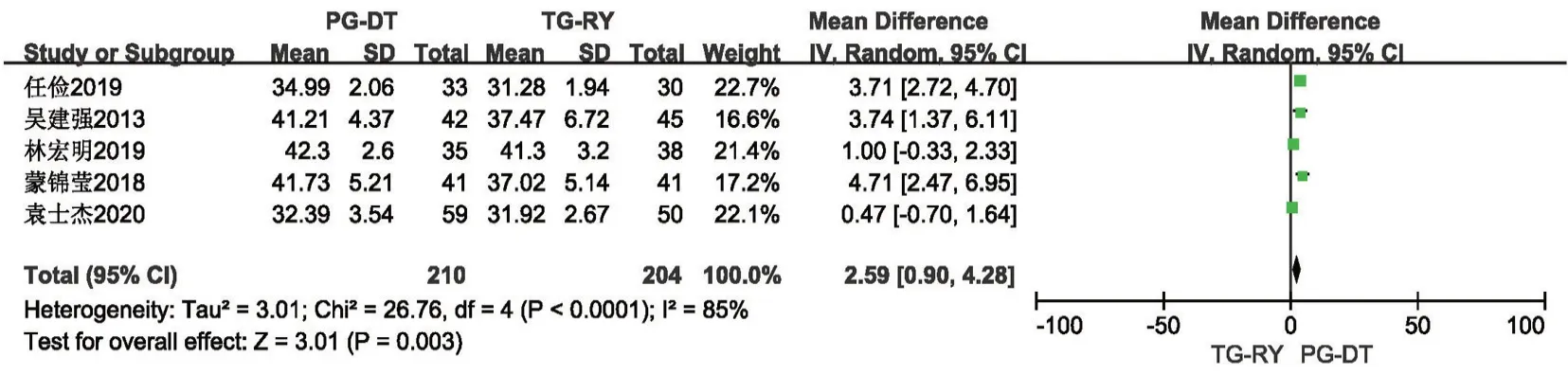
图13 PG-DT 组与TG-RY 组术后1年白蛋白水平比较
2.3 发表偏倚
对纳入文献进行漏斗图分析,散点大致分布在倒置漏斗内,且左右基本对称,纳入研究潜在发表偏倚的风险较小。见图14。
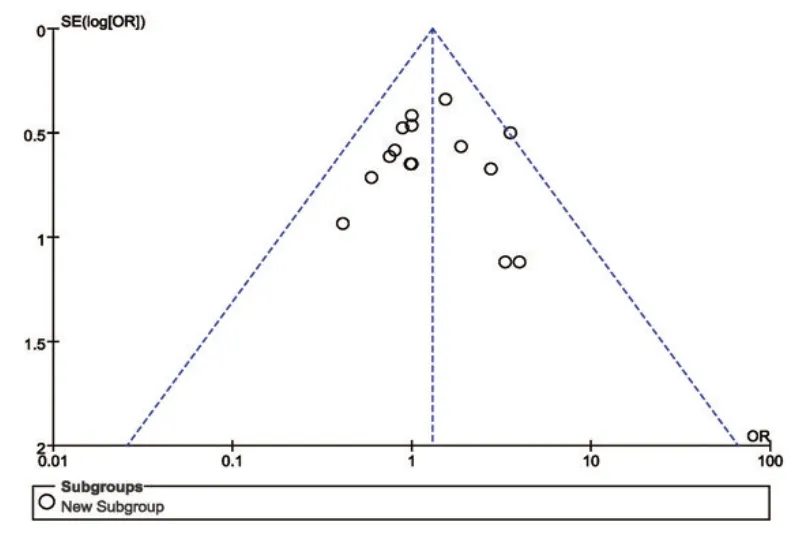
图14 漏斗分析图
3 讨 论
胃上部癌的手术方式目前存在争论,近端胃切除食管残胃吻合及全胃切除Roux-en-Y 吻合各有优缺点。近年来近端胃切除双通道吻合术备受关注[28]。本研究Meta分析结果提示,相比于全胃切除Roux-en-Y 吻合在手术时间、术中出血量方面的差异均无统计学意义,该术式并不会增加手术难度及术中出血风险。本研究提示近端胃切除双通道吻合术较全胃切除Roux-en-Y 吻合围手术期并发症发生率更低,差异有统计意义,且两种术式在严重并发症(C-D 并发症分级3 级以上并发症)及吻合口瘘发生率方面的Meta分析结果未见明显差异。分析原因,笔者认为全胃切除Roux-en-Y 吻合术存在十二指肠残端,近端胃切除双通道吻合术式术中保留残胃,同时保留胃网膜右血管,而残胃存在胃网膜右血管的血供,故吻合口瘘发生率并未见增加。两种术式吻合方式及消化道重建结构上的差异主要为十二指肠残端和残胃空肠吻合的差异,本研究中涉及的两种术式术后吻合口瘘发生率及围手术期并发症发生率均未见明显差异,也直接说明近端胃切除双通道吻合术式在安全性及可操作性方面并不逊色于全胃切除Roux-en-Y 吻合术。
本研究同时将部分反映远期生活质量的指标和营养状态方面指标纳入分析,结果提示近端胃切除双通道重建组较全胃切除组术后倾倒综合征、反流性食管炎的发生率更低。近端胃切除双通吻合术式术后1年血红蛋白水平、术后1年总蛋白及白蛋白水平提示较全胃切除Roux-en-Y 吻合术组高,差异均有统计学意义。究其原因,考虑近端胃切除双通道重建保留了残胃十二指肠路径,残胃有储袋作用,食糜可在残胃内充分混合,食糜通过时间延长,且通过残胃十二指肠通道可刺激胆汁及胰酶排泄,并刺激胰岛素分泌,可改善营养状态,同时可改善早期及晚期倾倒综合征[29,30]。另一方面,残胃仍存在内因子分泌功能,可改善维生素B12 的吸收,从一定程度上减少贫血的发生[8]。
从肿瘤根治的角度比较两种术式,全胃切除Roux-en-Y+D2 淋巴结清扫范围更大,手术更彻底,从该角度看,近端胃切除双通道吻合存在一定局限性,近端胃双通道重建因保留远端残胃,术中未清扫4d、5、6 组淋巴结。本研究中近端胃切除双通道组比全胃切除Roux-en-Y 组术中清扫淋巴结更少,也印证了这一点。近端胃切除术式由于保留残胃,残胃本身存在肿瘤复发风险[31]。但按照14 版《日本胃癌治疗指南》,对于胃上部癌,第5、6组淋巴结被定义为D3 站淋巴结[3],即按照全胃切除范围以及全胃切除概念下的D2 站淋巴结清扫术治疗胃上部癌存在扩大手术范围嫌疑。查阅《中国临床肿瘤学会(CSCO)原发性胃癌指南(2018.V1)》明确指出近端胃淋巴结清扫范围为D1+,即需要清扫1、2、3、4sa、4sb、7、8a、9、11p,并未提及需清扫5 组、6 组淋巴结。故对于胃上部癌,原则上行近端胃切除及D1 站淋巴结清扫范围即足够。
本研究中纳入文献所涉及肿瘤分期含早期及进展期病例,从手术适应症方面看,2018年第5 版《日本胃癌治疗指南》指出,早期胃上部癌,若行R0 切除后能保留远端1/2 残胃者,推荐行近端胃切除术。那针对于部分进展期胃癌,若行近端胃切除双通道吻合术,保留远端胃,是否会增加肿瘤复发风险,而降低远期生存率,诸多研究显示,即使是进展期胃上部癌,远端胃周围淋巴结转移率低[32,33]。且关于术后生存率,国内外学者多中心研究结果[34]显示胃上部癌行近端胃切除及全胃切除,术后5年生存率无统计差异。故笔者认为,对于部分进展期胃上部癌,近端胃切除双通道吻合术式并不会增加肿瘤复发风险,临床上做术式选择时,可适当放宽指征。但本研究存在一定局限性,所纳入文献无充足的术后生存率数据,无法行meta分析,无法给出相关结论。
故本研究结果认为,针对胃上部癌,单纯从围手术期安全性及术后生活质量、营养状态方面考量,行近端胃切除双通道吻合术安全有效,可明显改善术后生活质量及营养状态,是治疗胃上部癌较为理想的手术术式之一。从肿瘤根治安全角度,推荐早期胃上部癌常规开展该术式,对于部分进展期胃上部癌,可适当放宽指征开展。当然,限于本文的局限性,需更多研究加以证实及改进。
