分光光度法测定分析实验室用水中可溶性硅
2022-09-21李莉莉闫善信瓦房店市疾病预防控制中心辽宁大连116300
李莉莉 闫善信 瓦房店市疾病预防控制中心 (辽宁 大连 116300)
内容提要: 目的:开展实验室用水中可溶性硅浓度的检测方法的可行性研究。方法:采用硅钼蓝分光光度法。结果:实验方法标准曲线的相关系数r=0.9998,本实验检测方法的灵敏度检出限0.00396mg/L,本实验检测方法精密度RSD 1.92%~5.16%,本实验检测方法准确度回收率92.2%~100.9%。结论:本方法具有灵敏度高,线性好,结果准确,试剂毒性小,设备简单,价格便宜适于在基层实验室开展和普及。
随着实验室检验检测技术的高速发展,检验检测仪器的灵敏度和精密度也得到了很大的提升,相对于检验检测中使用的试剂的纯度大多都也提出了要求[1],对实验室用水的等级要求也越来越高。现行国家标准要求实验室大型仪器使用过程中的分析实验用水必须满足一级水,其中对可溶性硅(以二氧化硅计)提出检测要求。
目前分析实验室用水规格和试验方法[2]中对可溶性硅采用单点比较法,我们采用硅钼蓝分光光度法[3],可以准确测定实验室用水中二氧化硅的含量,提高了方法的准确度。原方法中对蒸发设备要求采用铂皿,即可以蒸发浓缩水样也不会引入由玻璃容器带来的可溶性硅的干扰,但由于铂皿价值不菲,大多实验室无法满足要求,限制了基层实验室的发展,因此我们决定更改实验设备,选择相对平价设备进行操作,通过利用聚四氟乙烯消化罐[4]代替铂皿蒸发水样取得满意的实验效果,可以很好地突破这个瓶颈。另外该方法中使用的甲氨基酚硫酸盐存在一定的毒性,通过实验使用抗坏血酸[5]代替甲氨基酚硫酸盐,即简化了配制过程又降低试剂毒性,同时也取得了满意的实验效果。通过多次实验,获取了大量的有效数据,现对实验数据展开分析。
1.实验部分
1.1 实验原理
在酸性溶液中,水质中可溶性二氧化硅与钼酸铵反应,生成黄色可溶性的硅钼杂多酸络合物,再用抗坏血酸将其还原成硅钼蓝,在一定浓度范围内,其蓝色与二氧化硅浓度成正比[6],通过测定其吸光度值与二氧化硅标准曲线对照可求得可溶性二氧化硅的浓度。
1.2 仪器及试剂
UV752紫外可见分光光度计(上海佑科仪器仪表有限公司生产);JA5003电子天平(上海衡平仪器仪表厂);聚四氟乙烯消化罐;30孔防腐电热板(滨海市正红塑料厂生产);HH.S21-6-S数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);移液器;盐酸溶液(天津科密欧化学试剂有限公司生产,优级纯,1+1);二氧化硅标准溶液(1000µg/mL,国家有色金属及电子材料分析测度中心生产);钼酸铵(天津市大茂化学试剂厂生产,优级纯,聚乙烯瓶装);草酸(天津市大茂化学试剂厂生产,优级纯,聚乙烯瓶装);抗坏血酸(天津市大茂化学试剂厂生产,优级纯,聚乙烯瓶装);25mL比色管。
1.3 溶液配制
1.3.1 钼酸铵溶液:称取10.000g钼酸铵于烧杯中加入无硅水溶解,待钼酸铵完全溶解后移入100mL容量瓶中,加无硅水定容即可得到100g/L的钼酸铵溶液。
1.3.2 草酸溶液:称取7.500g草酸于100mL容量瓶中,加入无硅水约20mL,摇匀,加无硅水定容即可得到75g/L的草酸溶液。
1.3.3 抗坏血酸溶液:称取2.000g抗坏血酸于100mL容量瓶中,加入无硅水约20mL,摇匀,加无硅水定容即可得到20g/L的抗坏血酸溶液[7]。
1.4 实验方法
1.4.1 样品处理:取520mL新制分析用实验室用水,用聚四氟乙烯消化罐亚沸蒸发至约20mL,关闭电热板,冷却待测定。
在检测过程中也可以将新制的一定体积实验室用水分别用几个四氟乙烯消化罐分别蒸发至一定体积后,再合并至一罐中蒸发到约20mL的检测体积,这样可以减少消化时间[8],节省人力,同时不影响检测结果,实验室对这种方法检测过,实验也取得了令人满意的效果。
1.4.2 标准系列:取10mL二氧化硅国家标准样品于1000mL容量瓶中,定容,配置成10mg/L标准应用液,准确移取0.25mL、0.5mL、0.75mL、1.0mL、2.0mL、3.0mL、5.0mL的标准应用液,加入无硅水至20mL。定值浓度为0.04mg/L,0.10mg/L,0.20mg/L,0.30mg/L,0.40mg/L,0.80mg/L,1.2mg/L,2.0mg/L。
1.4.3 样品测定:向待测水样和标准系列中分别加入0.4mL盐酸溶液,摇匀后分别加入1.0mL钼酸铵溶液,摇匀后放置5min,分别加入草酸溶液后摇匀放置1min,分别加入1.0mL抗坏血酸溶液,摇匀后移入25mL比色管中,并用无硅水稀释至刻度,60℃水浴5min。于810nm波长,10mm比色皿条件比色,绘制标准曲线,水样溶液中可溶性硅含量根据标准曲线求得[9]。
2.结果与讨论
2.1 线性范围与检出限
根据实验方法测定不同浓度二氧化硅标准溶液的吸光度值,绘制浓度与吸光度值的关系曲线,结果见表1。二氧化硅含量在0.04~2.0mg/L范围内与吸光度呈线性关系。直线回归方程为Y=0.3891X-0.0028,相关系数r=0.9998;对空白溶液进行11次平行测定,得出方法检出限(3s/k)为0.00396mg/L。
2.2 硅钼蓝最大波长的选择
在660~840nm波长范围内分别测定浓度为0.3mg/L的标准样品吸光度,测得810nm波长处测定吸光度值最高且稳定,所以本试验选择810nm波长进行检测。见表2。

表2.不同波长的检测吸光度值
2.3 溶液酸度和显色温度的选择
2.3.1 酸度对本实验有很大影响,分别在浓度为0.3mg/L的标准样品加入0.3mL,0.4mL,0.5mL,0.6mL,0.7mL的盐酸溶液,测得的吸光度值有很大差异,其中加入0.4mL盐酸溶液吸光度值最高,对应的PH为1.22,因此决定盐酸的加入量为0.4mL。
2.3.2 显色温度:硅钼黄的生成速度及稳定性与温度有关,提高温度可以增大显色的酸度范围和加快显色速度,有的实验室认为过高温度会降低硅钼杂多酸的稳定性,使硅的测定结果偏低或无温测定[3],但本实验室依据《分析实验室用水国家标准》中的可溶性硅检验方法的相关温度要求也取得了满意的效果。
2.4 干扰试验
水样中的磷酸根与钼酸铵生成磷钼蓝对试验有正偏差[10],当水中磷酸盐大于0.1mg/L时会对二氧化硅测定有一定干扰,草酸可以破坏磷钼蓝[11],消除磷酸盐干扰。在0.40mg/L标准管中我们加入不同体积已知浓度的磷酸溶液,按本法检测吸光度值,至少27mg/L的磷酸盐对实验结果无干扰。
2.5 还原剂的选择
常用还原剂有甲氨基酚硫酸盐,二氯化锡,抗坏血酸,硫酸亚铁铵等,由于甲氨基酚硫酸盐具有一定的毒性,二氯化锡还原能力比较强,容易将游离钼酸还原,且本身易被氧化[12]。因此多采用后两种,本法采用抗坏血酸。
2.6 还原剂的用量[13]
水中二氧化硅和钼酸铵反应生成黄色硅钼杂多酸,不利于测定,加入抗坏血酸将其还成蓝色络合物,灵敏度得到提高,但若加入抗坏血酸溶液的量太少,会因为还原能力不够使硅钼酸黄的还原不完全[14],导致测定结果偏低;如果加入抗坏血酸溶液的量高时,会因还原力过强导至钼酸铵还原[15],硅钼蓝颜色加深,影响比色。我们测定了0.5~3.0mL的加入量,实验结果表明加入1.0mL左右,还原剂显色完全,本法选择1.0mL。
2.7 反应生成的硅钼蓝稳定性
对浓度为0.3mg/L的标准样品在不同时间测定吸光度值,至少4h内无变化,因此稳定性好[16]。
2.8 方法的精密度与加标回收率
在线性浓度范围内,对1份520mL浓缩水样和2份合成水样,连续5d进行平行测定。
由表3得出本方法的RSD(%)分别为5.16,2.44,1.92;由表4得出回收率(%)为92.2,100.9,100.2;本实验具有较高的精密度和准确度[17]。
2.9 本实验中采用聚四氟乙烯消解罐不含有硅,并具有在强酸或强碱的环境下,消解难溶物质效果好,能消解许多传统方法难以消解的样品,适应面广,尤其是适用于批量样品消解,操作简单,耐高温,投入少,使用方便等优点。本实验中利用其不含硅且能耐受高温等特点,在180℃温度下对实验室用水样品进行蒸馏,取得满意结果。
30孔防腐电热板,表面经特氟龙涂层处理,耐腐蚀,铸铝加热板块升温速度快,加热均匀,无交叉污染,PID温控,温控精度正负1℃。有效的保证了快速准确的加热,保证实验过程样品处理的温度恒定。
3.结束语
通过以上实验数据分析,本方法操作灵活简单,精密度高(见表2),结果准确(见表3),设备简单,试剂毒性小,综上所述,本实验适宜在基层实验室开展普及。
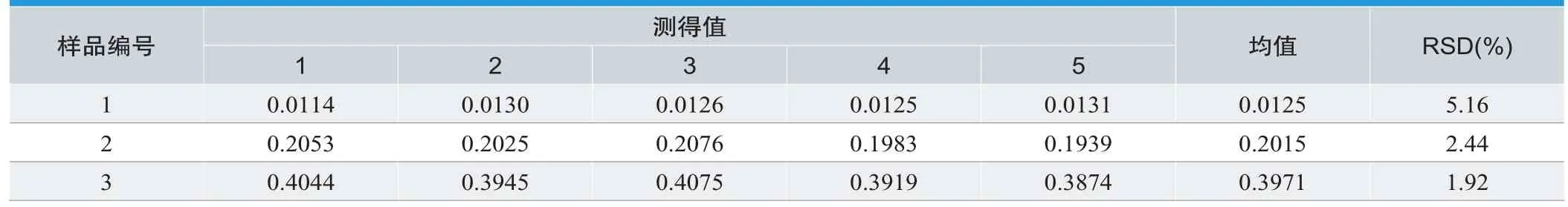
表3.方法精密度试验结果(mg/L)
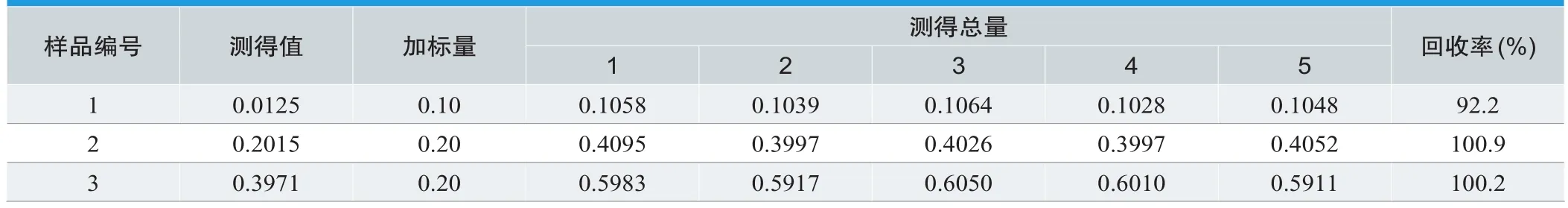
表4.方法准确度试验结果(mg/L)
