基于网络药理学探索痹症宁方抗类风湿关节炎的分子机制
2022-09-21李蒋凤肖静静何东初
李蒋凤,肖静静,何东初,
(1. 湖北中医药大学,湖北 武汉 430060;2. 中国人民解放军中部战区总医院,湖北 武汉 430070)
类风湿关节炎(Rheumatoid arthritis,RA)是一种可导致进行性关节破坏和血管、代谢、骨骼、心理领域等疾病共病的慢性炎症性自身免疫性疾病[1]。其临床特征多以手、手腕、脚和膝盖的疼痛和肿胀为主(多发性关节炎),可受累其他关节,也可能出现单性关节炎或少关节炎,发展后期引起慢性炎症和不可逆的关节或其他器官损伤,表现为多个疾病亚群的临床综合征,如间质性肺病、心包炎、胸腔积液或支气管扩张等[2]。RA的全球发病率约为0.5%~1%,关节损伤和残疾的结果严重影响工作和生活,并且增加死亡率,对女性的影响尤为剧烈,通常是男性的2~3倍[3]。研究表明,免疫介导的基质组织失调是慢性炎症和关节破坏的病理基础,RA前阶段持续数月至数年,其特征是存在循环自身抗体、炎症细胞因子和趋化因子的浓度及范围升高、代谢改变,临床发病阶段主要病理变化为滑膜炎合并血管、代谢、骨骼等系统的紊乱[4]。近年,尽管小分子激酶抑制剂和生物制剂的开发大大改善了临床结果,但仍不能达到免疫平衡和无药物缓解的治愈目标,且治疗费用昂贵,价格因地区和国家而异,每年从10 000美元到36 000美元不等[3,5]。因此,寻找更有效的具有调节免疫稳态、减轻炎症、缓解共病多重作用且价格低廉的药物仍是广大临床患者的迫切需求。
中医药基于整体观念以患者临床症状与证候为靶点,具有弥补西药靶点单一、药效单一的特点,辨证组方论治常收效颇好。RA属于中医“痹症”范畴,痹症宁方为常用治疗RA的经验用方,历时十余年,多次精简化裁,临床使用安全且不良反应少[6]。痹症宁方以“痹症”名方独活寄生汤为基础,祛风除湿时着重于温阳通络、疏肝调脾肾,以附子、青风藤、威灵仙为君药,温寒散风、除湿通络,以合《素问·痹症论》“风寒湿三气杂至,合而为痹也”之言;臣以细辛、桂枝、独活、徐长卿、生薏苡仁,独活善治伏风,除下焦筋骨之风寒湿邪,配伍细辛入少阴肾经温化阴经,桂枝入太阳膀胱经温经散寒、通利血脉,与细辛共治表里之寒湿,加用徐长卿益气入肝胃、生薏苡仁清热健脾肾;佐以当归、赤芍、白芍、鹿角胶养血和血、疏肝强骨,且血肉有情之品尤善填精益髓健脾,配伍生地清热凉血,除血虚、血瘀之热,加入地龙、蜈蚣搜风通络;使以甘草调和诸药。系统网络药理学是以药物作用的网络分析为途径之一,将系统方法、计算方法和实验方法相结合来阐明药物的分子机制的方法,可以较好地用于分析具有复杂性、多成分、多靶点的中草药和中药方剂[7]。本研究拟从网络药理学及分子对接的角度,探索痹症宁方抗RA的分子机制,为其临床应用提供新的理论依据。
1 材料与方法
1.1痹症宁方有效成分和作用靶点筛选 将痹症宁方的主要药物利用中药系统药理学分析平台TCMSP数据库检索得到药物有效成分,并按照口服生物利用度(OB)和类药性(DL)两个关键参数对成分进行筛选,筛选条件为OB≥30%并且DL≥0.18。其次,记录筛选后有效成分的MOL编号并在平台“Related Targets”项目下对每个成分分别进行检索得到药物有效成分相应的靶点基因名称。最后,在STRING数据库中将药物有效成分相应的靶点基因名称转换成gene symbol。佐药中地龙、蜈蚣、鹿角胶、生地黄药物则利用BATMAN-TCM数据库检索进行补充,筛选条件为score≥20,Adjusted P-value≤0.05,得到药物的有效成分和靶点基因。
1.2痹症宁方抗类风湿关节炎的靶点预测 利用GeneCards、OMIM数据库检索“rheumatoid arthritis”,并将两个数据库中检索到与类风湿关节炎疾病相关的基因合并去重作为疾病的相关靶点基因。将痹症宁方有效成分的靶点基因与类风湿关节炎疾病相关的靶点基因取交集,得到痹症宁方抗类风湿关节炎的预测靶点,利用Venn软件绘制维恩图交集图。根据痹症宁方有效药效成分、药效成分相对应的靶点基因与类风湿关节炎疾病相关靶点基因,使用Cytoscape3.6.0 软件建立“方药配伍-有效成分-作用靶点-治疗疾病”的映射图。
1.3蛋白质相互作用网络的构建 首先,将痹症宁方有效成分抗类风湿关节炎疾病的预测靶点基因导入到STRING数据库,且将物种限定为人,绘制蛋白质相互作用网络,综合评分(z-score)大于0.4的为具有显著统计学意义,并输出“TSV”格式的结果,然后在Cytoscape软件中对结果进行修饰美化。
1.4GO和KEGG功能富集分析 将痹症宁方有效成分抗类风湿关节炎疾病的预测靶点基因,利用R软件中的“org.Hs.eg.db”“clusterProfiler”“enrichplot”“ggplot2”等package在基因本体联合会(GO)及京都基因和基因组百科全书(KEGG)数据库中进行功能和信号通路富集分析。最后,在R语言中将富集信息用图形来展示,以校正后的P值小于0.05为有显著的统计学意义。
1.5关键基因的筛选及其生物学过程分析 将预测的痹症宁方抗类风湿关节炎的靶点导入到Cytoscape软件中,利用Cytohubba插件中四种不同算法,分别为:degree,radiality,MCC(maximal clique centrality)和 EPC(edge percolated component),筛选出关键基因。同时,在STRING数据库,物种设置为人,绘制蛋白质相互作用网络,综合评分(z-score)大于0.4的为具有显著统计学意义。同1.4中利用R软件进行GO中生物学过程富集分析,以校正后的P值小于0.05为有显著的统计学意义。
1.6分子对接验证 利用Autodock(4.2.6)软件作为分子对接软件,对有效成分小分子和靶标蛋白质进行半柔性对接。选取关键基因中得分前5的基因所对应的蛋白质为靶标蛋白质,并在PDB数据库中下载其三维结构数据PDB格式。在PyMol(2.1.1)软件中将靶点蛋白的自身配体、水分子、重复序列清除。在AutoDockTools(1.5.6)软件对清理好靶点蛋白进行加氢、计算电荷、添加蛋白质类型,并保存为靶标蛋白“pdbqt”格式文件。其次,找到相应靶点的药物有效成分,并在ZINC、Pubchem数据库中下载其三维结构数据“mol2”或“sdf”格式,并可用OpenBabel(2.4.1)软件将“sdf”格式转换成“mol2”格式。在AutoDockTools软件中将每个成分进行加氢、计算电荷、加Root后,保存为小分子“pdbqt”格式文件。分别用处理好的靶标蛋白质与有效成分小分子利用Autodock软件进行对接,使用OpenBabel软件将PDBQT格式的对接文件转化为PDB格式,最后利用Pymol软件分析和观察小分子与靶标蛋白对接结果。
2 结 果
2.1痹症宁方有效成分和作用靶点的筛选结果筛选后得到君药附子、青风藤、威灵仙有效成分数各为:6个、4个、2个,靶点基因数各为:19个、51个、45个;臣药细辛、桂枝、独活、徐长卿、薏苡仁有效成分数各为7个、5个、5个、3个、3个,靶点基因数各为99个、44个、42个、13个、27个;佐药当归、赤芍、白芍、生地、地龙、蜈蚣、鹿角胶有效成分数各为:2个、10个、7个、4个、7个、5个、2个,靶点基因数各为45个、92个、83个、217个、305个、225个、13个;使药甘草有效成分数为18个,靶点基因数为134个。将君臣佐使药物有效成分和靶点基因合并后去重,得到君药有效成分数为11个,靶点基因数为65个;臣药有效成分数为21个,靶点基因数为124个;佐药有效成分数为29个,靶点基因数为669个;使药有效成分数为18个,靶点基因数为131个。最后,将痹症宁方所有药物有效成分和靶点基因合并后去重,得到总有效成分数69个,总靶点基因数727个,见表1。

表1 痹症宁方有效成分与靶点基因的筛选 个
2.2预测痹症宁方抗类风湿关节炎疾病的靶点通过GeneCards、OMIM数据库对类风湿关节炎疾病进行检索共得到340个与类风湿关节炎相关的基因。将痹症宁方中君臣佐使药物有效成分对应的靶点基因与类风湿关节炎疾病相关的靶点基因取交集,获得56个痹症宁方抗类风湿关节炎疾病潜在的靶点,并利用Venn软件实现可视化(见图1)。将痹症宁方君臣佐使4种药物配伍、34个主要有效成分、56个潜在靶点、类风湿关节炎疾病输入到Cytoscape软件,构建“方药配伍-有效成分-作用靶点-治疗疾病”的网络图(见图2)。
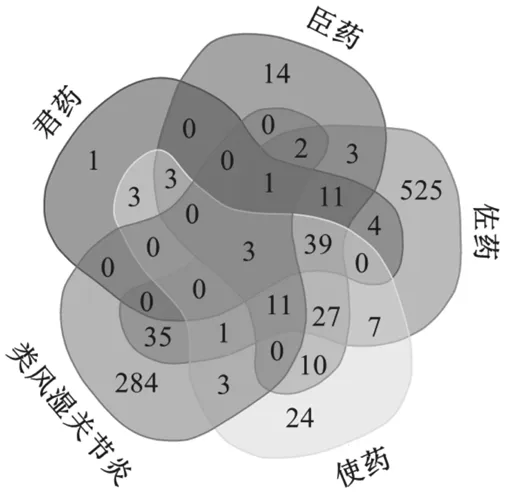
图1 痹症宁方配伍与类风湿关节炎共同靶点韦恩图
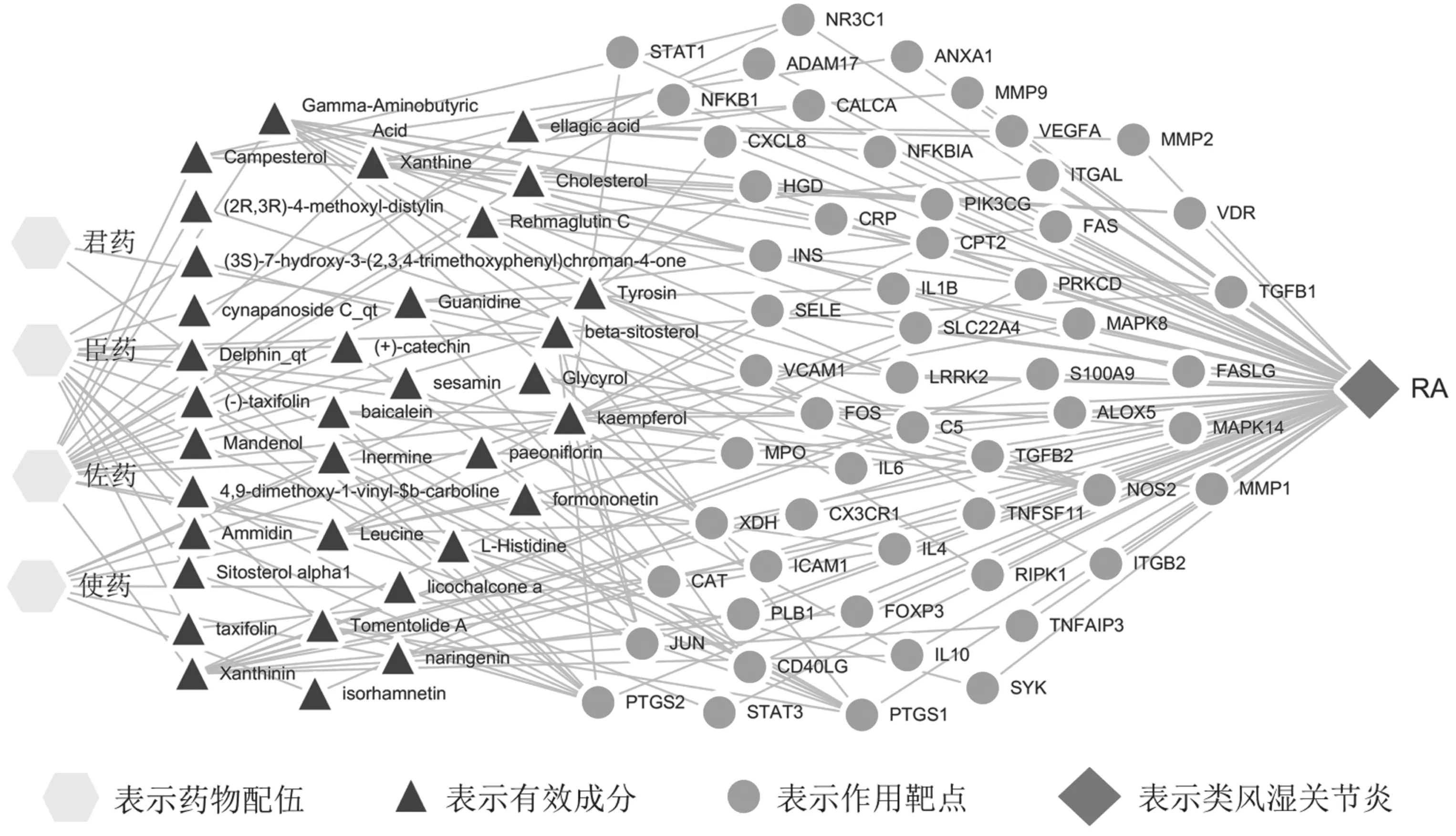
图2 痹症宁方抗类风湿关节炎“方药配伍-有效成分-作用靶点-治疗疾病”的网络图
网络图的节点分别表示药物配伍、有效成分、靶点基因、疾病,边表示的是药物配伍、有效成分、靶点基因、疾病之间的联络关系。在痹症宁方抗RA的主要活性成分中,君药2个,臣药13个,佐药17个,使药7个,君臣佐药物共有的活性成分为beta-sitosterol,臣佐使药物共有的活性成分为kaempferol,臣佐药物共有的活性成分为(+)-catechin。君臣佐使药物与类风湿关节炎均共有的靶点基因为PTGS2、PTGS1、JUN。
2.3蛋白质网络互作和功能富集分析结果 在STRING数据库中设置minimum required interaction score为0.4,获取average node degree为23.1并且由56个节点和648条边所映射组成痹症宁方抗RA的靶点基因相互作用图(见图3)。在R软件中对痹症宁方抗RA的作用靶点进行GO和KEGG富集分析,总共获得1 507条记录,其中生物学过程(BP)1 447条,主要涉及炎症反应的调节、DNA结合转录因子活性的调节、活性氧代谢过程、细胞趋化作用、对脂多糖的反应、白细胞趋化性、对细菌源分子的反应、骨髓白细胞迁移、细胞对化学应激的反应等;细胞组分(CC)19条,主要关联细胞膜与质膜、胞质囊腔、分泌颗粒内腔等;分子功能(MF)41条,主要具有整合素结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、细胞因子活性、肿瘤坏死因子(Tumor necrosis factor,TNF)受体结合、生长因子受体结合、信号受体激活因子的活性、抗氧化活性等功能(见图4)。KEGG富集通路共115条,选取前30条进行可视化(见图5),其中与类风湿关节炎通路相关的基因有IL6、FOS、CXCL8、VEGFA、ITGB2、ITGAL、TGFB2、TNFSF11、IL1B、ICAM1、MMP1、JUN、TGFB1。由此可见中药复方参与人体多个复杂的生物学过程与通路,整体调节人体物质代谢。

图3 痹症宁方抗类风湿关节炎靶点的蛋白互作网络图

图4 痹症宁方抗类风湿关节炎靶点的GO富集图

图5 痹症宁方抗类风湿关节炎靶点的KEGG富集图
2.4关键基因的筛选结果与生物过程学分析 利用Cytohubba插件对痹症宁方抗类风湿关节炎的潜在靶点进行关键基因分析,根据degree、radiality、MCC、EPC 4种算法分别取得分前10的基因,再取交集,得到7个关键基因,分别为IL6、IL1B、CXCL8、IL10、VEGFA、PTGS2、JUN,见表2。更进一步对关键基因进行生物学过程分析,发现主要涉及正向调节血管生成和发育、细胞及白细胞趋化性、神经炎症反应、平滑肌细胞增殖的正调控、对脂多糖及细菌源分子的反应等过程,见图6。
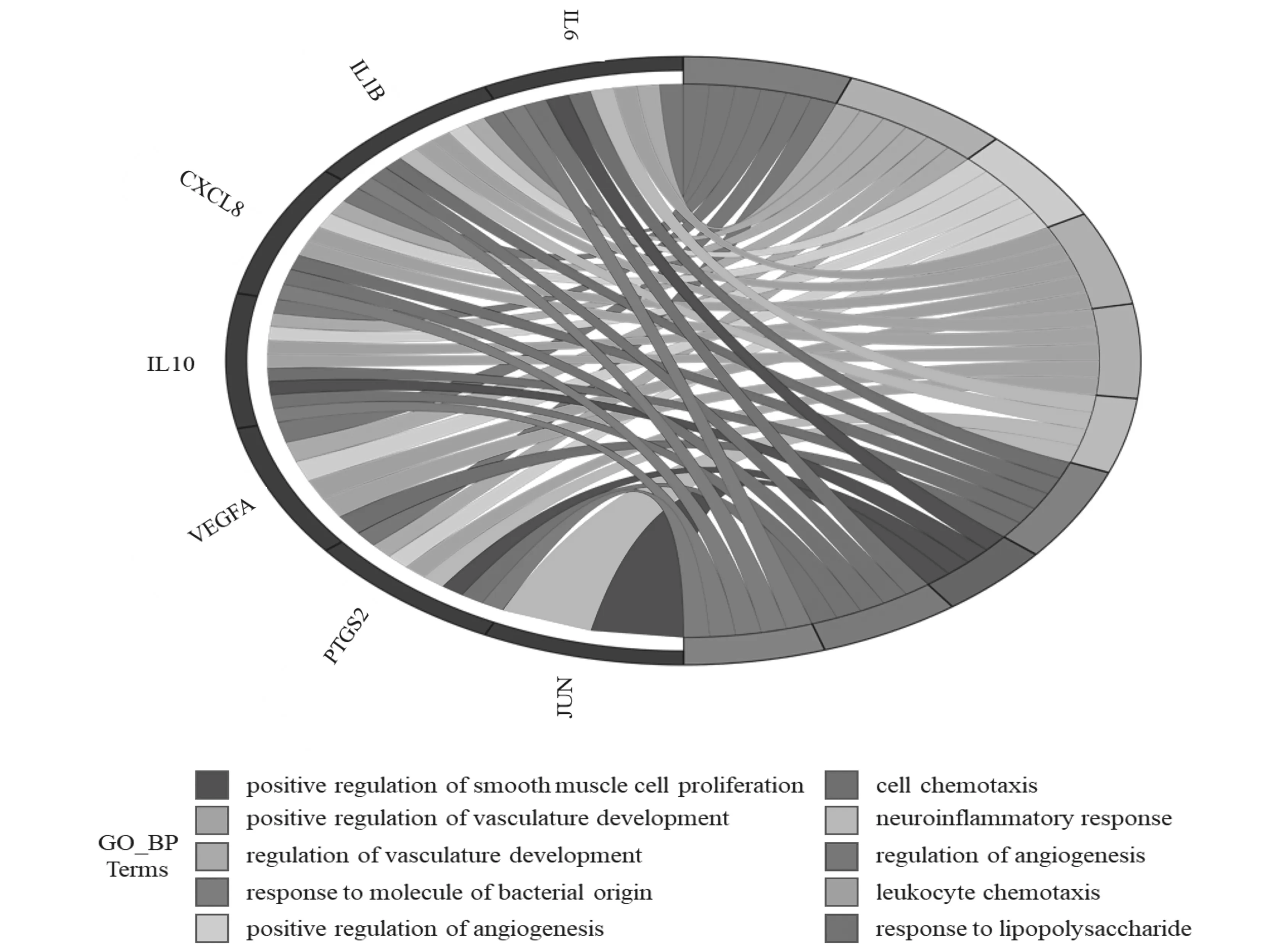
图6 痹症宁方抗类风湿关节炎关键基因的生物学过程图

表2 关键基因的筛选
2.5分子对接验证分析 选取前5个关键基因所对应的蛋白质为靶标蛋白质,与药物有效成分进行分子对接,进一步验证药物作用的分子机制。药物的主要作用成分有paeoniflorin、Guanidine、ellagic acid、Tyrosin、sesamin、Xanthinin,靶标基因主要为IL6、IL1B、VEGFA、CXCL8、IL10。痹症宁方的主要有效成分的结合能均小于0(见表3),说明其能与靶点产生自发性结合。利用PyMol绘制药物主要有效成分与靶点蛋白质对接模式图,以结合距离最短为最优结合方式(见图7)。paeoniflorin-IL6的结合位点为ARG-113氨基酸残基,Guanidine-IL1B的结合位点为GLU-51氨基酸残基,Tyrosin-CXCL8的结合位点为LYS-42氨基酸残基,ellagic acid-CXCL8的结合位点为LYS-11氨基酸残基,sesamin-IL10的结合位点为PHE-111氨基酸残基,Xanthinin-IL10的结合位点为GLY-58氨基酸残基,ellagic acid-VEGFA的结合位点为GLU-67氨基酸残基。从总体上进行推测,分子对接显示痹症宁方的主要有效成分与核心靶点有较好的结合活性。

注:(a)表示paeoniflorin与IL6的结合位点为ARG-113氨基酸残基;(b)表示Guanidine与IL1B的结合位点为GLU-51氨基酸残基;(c)表示Tyrosin与CXCL8的结合位点为LYS-42氨基酸残基;(d)表示ellagic acid与CXCL8的结合位点为LYS-11氨基酸残基;(e)表示sesamin与IL10的结合位点为PHE-111氨基酸残基;(f)表示Xanthinin与IL10的结合位点为GLY-58氨基酸残基;(g)表示ellagic acid-VEGFA的结合位点为GLU-67氨基酸残基
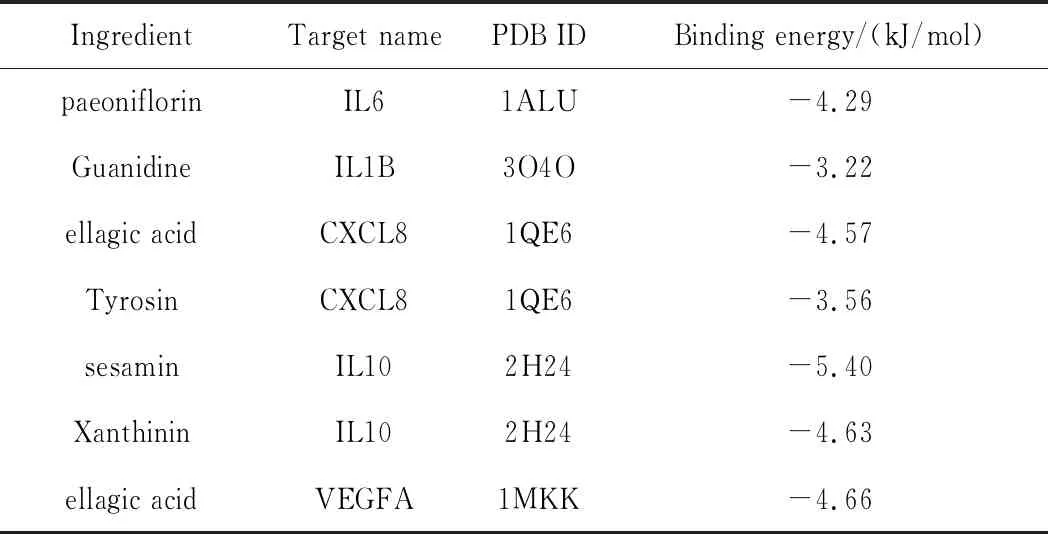
表3 分子对接结合能的结果
3 讨 论
近年来根据基因多态性及其易感性,从基因靶点新角度挖掘调节RA中先天免疫与后天免疫的疾病修饰疗法的研究越来越多[8]。RA以免疫介导的慢性炎症为基础,抗炎药物(非甾体类抗炎药、缓解病情抗风湿药、糖皮质激素)虽然能够缓解或者抑制炎症,但停药后仍易复发且不良反应多,不能从根本上调节内免疫稳态环境和平衡炎症反应。在前期研究中,已经证实了痹症宁方可阻抑滑膜组织中MMP-9、MMP-3的表达,并使血清炎症因子ESR、CRP减少,缓解关节炎指数评分,具有抗炎消肿、调节免疫的作用[9]。现基于系统网络药理学和分子对接技术,拟从基因层面进一步揭示痹症宁方抗类风湿关节炎的作用机制及其靶点。
痹症宁方抗RA的主要有效成分有β-谷固醇(beta-sitosterol)、山柰酚(kaempferol)、(+)儿茶素[(+)-catechin]等;潜在靶点有IL6、MMP2、FOS、CXCL8等。目前,已有研究证实β-谷固醇、山柰酚、儿茶素具有抗炎作用,抑制RA-FLS异常增殖和侵袭[10-12]。其中,56个潜在靶点的GO富集结果表明主要参与对细菌源分子及脂多糖的反应、炎症反应的调节、细胞趋化作用、白细胞趋化性、骨髓白细胞迁移、活性氧代谢过程、DNA结合转录因子活性的调节、细胞对化学应激的反应等生物学过程,具有的分子功能主要与细胞因子如TNF、生长因子受体结合、抗氧化活性等功能相关。RA除了伴随着由细胞因子和交叉反应(自身)抗原介导的长期炎症,也存在一种(休眠)微生物组,它可以释放强效炎症原脂多糖,从而激活细胞因子如IL-6、TNF-α催化炎症发生以及促进细胞毒性β-淀粉样蛋白的形成[13]。在RA持续炎症中,促炎细胞因子如TNF和IL-1β等细胞因子激活成纤维细胞样滑膜细胞,诱导生产如炎性分子和基质降解酶,增强白细胞和巨噬细胞的活跃性,进一步侵袭和破坏周围组织[14]。虽然RA以慢性全身性炎症为主,但长期激活状态下免疫细胞和基质细胞对生物能量和生物合成的需求也在增加,滑膜细胞代谢的改变和局部缺氧、缺乏营养的微环境在RA关节的病理表现中尤为突出,其中代谢变化是由响应营养、能量和氧水平以及生长因子、模式识别和细胞因子受体的信号通路协调的[15]。表观基因组上相似的区域存在于RA细胞中,与活性增强子和启动子以及特定的转录因子结合基序有关,当重塑表观基因组或改变增强子活性时,可以调节侵掠性RA成纤维细胞样滑膜细胞行为[16]。当DNA修复机制的表观调节功能异常,氧化应激诱导内源性DNA损伤的积累,可能触发细胞凋亡,引起自身抗体、受损细胞溶胶DNA和微核的产生,导致全身免疫性疾病表达[17]。据此,痹症宁方可以从细菌源头(血液微生物环境)、炎症反应(促炎因子和免疫系统)、局部缺氧及代谢改变(氧糖代谢)、表观遗传、应激过程等多个方面发挥抗RA的作用。
痹症宁方的KEGG通路除了富集在类风湿关节炎通路上,与脂质代谢、动脉粥样硬化、糖尿病并发症中的晚期糖基化终末产物-受体(AGE-RAGE)信号通路、非酒精性脂肪肝、乙型肝炎、炎症性肠病、致病性大肠杆菌感染、Th17细胞分化、TNF、IL-17、NF-κB信号通路、EB病毒、疱疹病毒感染等通路密切相关。其中,脂质代谢和动脉粥样硬化、AGE-RAGE及TNF信号通路上聚集基因最多。不平衡的脂质代谢在自身免疫反应中具有致病作用,不仅是动脉粥样硬化形成的基础,更是RA的危险因素[18]。AGEs的积累和RAGE的激活诱导了血管组织中持续的氧化应激,抑制AGE/RAGE信号通路可以减轻血管内皮的氧化应激从而保护血管[19]。有研究表明RA中心血管合并症、2型糖尿病、高血脂症、肠道菌群失调及细菌易位等共病与RA疾病活动具有相关性,且某些共病与RA有因果关系[13]。TNF-α可以激活RA-FLSs的自噬及NF-κB信号通路,当自噬被阻断时,FLSs的自噬水平明显降低,TNF-α诱导的增殖/凋亡失衡被逆转[20]。TNF-α可刺激致病性Th17细胞的分化并产生IL17、GM-CSF,扩大炎症反应,但TNF-α和IL-17/Th17通路在RA发病机制中并不完全融合,IL-17/Th17通路仍为RA的非冗余治疗目标[21]。因此,痹症宁方能摒弃西药治疗疾病单一或加重某些共病的缺点,对于RA合并脂质代谢紊乱、动脉粥样硬化、糖尿病血管并发症、乙型肝炎、非酒精性脂肪肝、炎症性肠病等共病的治疗具有天然优势。
痹症宁方抗RA的关键基因分别为IL6、IL1B、CXCL8、IL10、VEGFA、PTGS2、JUN,主要参与的生物学过程有正向调节血管生成和发育、细胞及白细胞趋化性、神经炎症反应、平滑肌细胞增殖的正调控、对脂多糖及细菌源分子的反应等,并且经过分子对接技术考证,提示痹症宁方与关键基因有较好的聚合活性。IL6在RA中先天免疫和适应性免疫都至关重要,IL6产生失调导致持续性炎症,且抗IL6药物是RA较好的候选药物[22]。IL1B的遗传变异与RA易感性相关,ACPA阳性RA患者中IL1B水平升高,ACPAs可以促进巨噬细胞产生IL1B[23-24]。已有研究证实RA滑膜液中IL-6、IL-8、IL-10和MCP-1浓度较高,可能通过细胞因子-细胞因子受体相互作用和IL-17信号通路介导RA中性粒细胞自噬[25]。VEGFA是新生血管形成的启动因子,新生血管在RA发病机制中促进炎症细胞的入侵和局部疼痛受体的增加,从而导致结构损伤和疼痛[26]。RA滑膜成纤维细胞介导PTGS2信号上调单核细胞中TREM-1的表达,增加单核细胞的炎症反应微环境[27]。JUN可直接激活促炎因子环氧合酶-2,间接抑制抗炎因子精氨酸酶-1,调节巨噬细胞的活化状态,促进关节炎的发生[28]。血管的生成和增殖不仅为滑膜的生长提供了更多的营养,而且为细胞因子和炎症细胞提供了扩散通道,阻断血管生成可以抑制滑膜炎症和血管翳的形成[29]。神经炎症显著促进从急性疼痛到慢性疼痛的过渡以及神经病变疼痛的永久化,主要病理为血管通透性改变、白细胞聚集及释放炎症介质、激活中枢神经系统的小胶质及星形胶质细胞,加重炎症性疼痛及慢性疼痛的中枢敏感化,RA的持续性慢性关节痛与此密切相关[30-31]。总之,痹症宁方的主要作用靶点有IL6、IL1B、CXCL8、IL10、VEGFA、PTGS2、JUN,参与血管的生长发育、炎症的触发、形成及神经炎症等生物学过程,着重于延缓关节局部结构损伤和慢性疼痛。
综上所述,痹症宁方可能通过调节血液微生物环境、炎症反应、局部氧供及代谢、表观遗传、应激过程等多个方面发挥抗RA的作用;主要候选靶点有IL6、IL1B、CXCL8、IL10、VEGFA、PTGS2、JUN,着重于延缓关节局部结构损伤和慢性疼痛;并对于脂质代谢紊乱、动脉粥样硬化、糖尿病血管并发症、炎症性肠病等共病的治疗有优势。本研究拓展了痹症宁方新的作用机制,但也需要进一步基础实验验证,可以为后续的课题研究提供新的方向和思路。
利益冲突:所有作者均声明不存在利益冲突。
