枸杞多糖基于AMPK-mTOR通路对鱼藤酮诱导的帕金森病大鼠神经元保护作用研究
2022-09-21戴芷晴姚心怡徐小媛焦旭颖管金山王月飞
戴芷晴,姚心怡,徐小媛,焦旭颖,管金山,王月飞
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
帕金森病是一种主要表现为进行性锥体外系功能障碍的中枢神经系统退行性疾病,表现为静止性震颤、肌肉强直、运动迟缓和共济失调等运动症状,和嗅觉减退、睡眠障碍、认知功能障碍或自主神经功能障碍等非运动症状[1-2]。帕金森病以中脑黑质多巴胺能神经元变性丢失为主要特征,线粒体损伤是这一结果的主要成因[3-4]。腺苷酸活化蛋白激酶(AMPK)-哺乳动物雷帕霉素靶蛋白(mTOR)通路可通过抗氧化及调控自噬的方式参与机体线粒体保护。有研究证实,激活或过表达AMPK,能够减轻鱼藤酮致帕金森病大鼠的多巴胺能神经元损伤,AMPK参与了帕金森病的病情进展[5]。枸杞多糖是枸杞的主要功效成分,其能自由通过并调节血脑屏障,具有抗氧化、调节免疫、抗癌、抗衰老和神经保护等多种生物活性,且无毒副作用[6]。既往有研究证明,枸杞多糖能够通过激活磷脂酰肌醇-3激酶(PI3K)/Akt通路保护多巴胺能神经元[7]。本实验通过观察枸杞多糖对鱼藤酮致帕金森病大鼠神经元及AMPK-mTOR通路的影响,进一步探讨了枸杞多糖保护多巴胺能神经元的可能作用机制。
1 实验材料与方法
1.1实验动物 雄性SD大鼠45只,体重约250 g,购于辽宁长生生物技术股份有限公司,动物许可证号:SCXK(辽)2020-0001。动物适应性饲养1周后进行实验。所有实验程序均经齐齐哈尔医学院伦理委员会批准(2021196)。
1.2药物与试剂 鱼藤酮晶体(Rhawn公司,批号:RH239743),枸杞多糖粉末(西安圣青生物科技有限公司,批号:SQGQ201910012),二甲基亚砜(Bio Froxx公司,批号:EZ2921C395),辛酸/癸酸甘油三酯(MIGLYOL 812N,上海信守助剂有限公司,批号:20201207);AMPK酶联免疫吸附试剂盒(批号:202105481)、磷酸腺苷酸活化蛋白激酶(p-AMPK)酶联免疫吸附试剂盒(批号:202105236)、mTOR酶联免疫吸附试剂盒(批号:202105269)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)酶联免疫吸附试剂盒(批号:202105509)、线粒体氧化呼吸酶Ⅰ酶联免疫吸附试剂盒(批号:202105387)均购于厦门惠嘉生物科技股份有限公司。
1.3主要仪器 离心机(Thermo);酶标仪(Labsystems Multiskan MS);洗板机(Thermo Labsystems);隔水式恒温培养箱(上海精宏);电子天平(Sartorius);体视显微镜(MOTIC)。
1.4实验方法 将大鼠随机分为对照组、帕金森病组及枸杞多糖组,每组15只。枸杞多糖组给予枸杞多糖50 mL/kg灌胃预处理,帕金森病组及对照组给予等量蒸馏水灌胃预处理,均1次/d,持续3 d。预处理结束后,帕金森病组及枸杞多糖组参考文献[8]方法,于颈背部皮下注射鱼藤酮(2 mg/kg溶解于二甲基亚砜及MIGLYOL 812N中,比例为1∶50)造模,对照组注射等量等比不含鱼藤酮的二甲基亚砜及MIGLYOL 812N混合溶液。注射3 h后,枸杞多糖组给予枸杞多糖水溶液50 mg/kg灌胃,对照组及帕金森病组给予等量蒸馏水灌胃,均1次/d,连续28 d。实验过程中由于进食障碍,帕金森病组大鼠死亡4只。
1.5观察指标及方法
1.5.1大鼠行为学表现 实验过程中观察记录各组大鼠行为学表现。
1.5.2脑黑质电镜下病理观察 干预结束后,每组随机选取2只大鼠,禁食12 h后用15%水合氯醛(3.5 mL/kg)腹腔麻醉,麻醉后快速断头取脑,体视显微镜下分离黑质,置于2.5%戊二醛中固定,送至齐齐哈尔医学院临床病理中心进行后续处理,之后在透射电镜下观察、照相。
1.5.3纹状体线粒体氧化呼吸酶Ⅰ及AMPK-mTOR通路相关蛋白含量 取每组剩余大鼠,禁食12 h后用15%水合氯醛(3.5 mL/kg)腹腔麻醉,麻醉后快速断头取脑,在冰面上迅速分离双侧纹状体置于液氮中,后转移至-80 ℃冰箱中冷冻储存。用匀浆器将采集到的纹状体标本制成15%的组织匀浆,以3 000 r/min离心20 min取上清液,按照试剂盒使用说明检测AMPK、p-AMPK、mTOR、p-mTOR含量,计算p-AMPK/AMPK和p-mTOR/mTOR比值。
2 结 果
2.1大鼠行为学表现 造模7 d后,帕金森病组大鼠首先出现相关行为异常,表现为体重减轻、毛色发黄杂乱、精神状态不佳,同时出现步态不稳、偏侧旋转及静止性震颤等症状。随着造模时间延长,帕金森病组大鼠症状持续加重,并出现偶发缓慢旋转、躯体僵直及口鼻出血;枸杞多糖组大鼠也出现相关症状,但对比帕金森病组,症状更轻;对照组大鼠未出现明显的行为异常。至28 d造模结束时,帕金森病组4只大鼠因严重进食障碍死亡,枸杞多糖组和对照组无大鼠死亡。
2.2大鼠黑质区多巴胺能神经元的超微结构 透射电镜下显示,对照组大鼠线粒体形态正常;帕金森病组大鼠黑质内神经元出现线粒体广泛肿胀变性,部分线粒体发生空泡样变,内质网出现肿胀以及脱颗粒;枸杞多糖组大鼠神经元线粒体仅发生可逆性的轻度水肿,溶酶体增多。见图1。
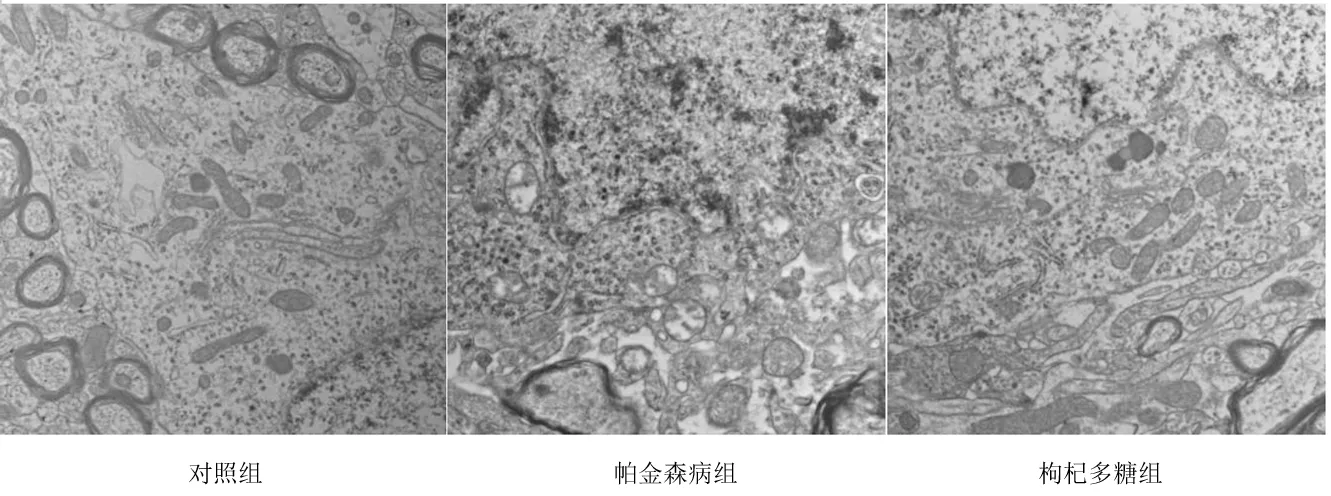
图1 对照组及帕金森病各组大鼠黑质神经元超微结构(TEM,×20 000)
2.3大鼠纹状体线粒体氧化呼吸酶Ⅰ含量及AMPK-mTOR通路相关蛋白比值比较 与对照组比较,帕金森病组大鼠纹状体线粒体氧化呼吸酶Ⅰ含量明显升高(P<0.05),p-AMPK/AMPK比值明显降低(P<0.05);与帕金森病组比较,枸杞多糖组大鼠纹状体线粒体氧化呼吸酶Ⅰ含量明显降低(P<0.05),p-AMPK/AMPK比值明显升高(P均<0.05);3组p-mTOR/mTOR比值比较差异均无统计学意义(P均>0.05)。见表1。
表1 对照组及帕金森病各组大鼠纹状体氧化呼吸酶Ⅰ含量和AMPK-mTOR通路相关蛋白比值比较
3 讨 论
神经细胞能量储存较少而需求极高。线粒体电子传输链(ETC)作为氧化呼吸、产生ATP的重要环节,其异常将导致线粒体出现明显功能损伤,最终严重影响神经细胞的正常生命活动。ETC在氧化呼吸过程中产生氧化呼吸副产物,即活性氧(ROS)。通常情况下,ROS可在抗氧化剂的作用下最终被转化为无毒的水[9]。ETC中任何环节受抑制均会引起供能异常、线粒体破坏,导致ROS大量产生而无法清除[10]。当ROS异常蓄积至超出机体清除能力时,氧化应激将被启动[11]。在氧化应激状态下,自由基将攻击多巴胺能神经元,导致蛋白错误折叠并蓄积[12],而错误折叠的α-突触核蛋白与其他蛋白共同形成的路易小体是帕金森病的病理特征之一。另外高浓度的ROS是细胞自噬的激活因素[13],自噬是一种细胞自食现象,在此现象中,细胞形成包含聚集蛋白质、细胞器、大分子复合物等物质的双膜自噬体,与溶酶体融合后,发挥降解细胞内成分作用[14]。生理情况下,机体可以通过自噬功能选择性地去除异常蛋白和受损线粒体,防止线粒体ROS聚集导致的神经损伤,维持细胞内环境稳态;自噬功能异常会导致异常蛋白堆积,引起神经元损伤。
既往研究证实,鱼藤酮可以抑制神经细胞中作为ETC起始端的线粒体氧化呼吸酶Ⅰ,可有效建立帕金森病大鼠模型[15]。线粒体氧化呼吸酶Ⅰ含量的升高提示ETC异常,进而提示线粒体破坏,神经元受损,故通过测定线粒体氧化呼吸酶Ⅰ的含量可反映鱼藤酮建模效果。本实验结果显示,帕金森病组大鼠黑质内神经元出现线粒体肿胀变性,部分线粒体发生空泡样变,内质网出现肿胀以及脱颗粒,线粒体氧化呼吸酶Ⅰ含量明显升高;枸杞多糖组大鼠黑质区神经元内线粒体及内质网损伤较轻,溶酶体增多,线粒体氧化呼吸酶Ⅰ含量明显降低。提示枸杞多糖通过抑制氧化应激及激活细胞自噬起到减轻多巴胺能神经元损伤、减缓帕金森病进程的功效。
AMPK是细胞内重要的能量感受器,其广泛表达于中枢神经系统中,在维持神经元的活性和功能中起着至关重要的作用。mTOR是PI3K蛋白激酶类家族成员,是自噬的负性调节因子[16]。活化的mTOR可通过影响mTORC1复合体的形成,使 mAtg13和ULK1高度磷酸化,从而抑制细胞自噬[17]。AMPK能磷酸化mTOR使其转换为失活的p-mTOR,从而解除mTOR对自噬的抑制作用,进而促进多巴胺能神经元内α-突触核蛋白及活性氧簇的清除,减少异常蛋白蓄积及氧化应激对神经元线粒体的毒性作用[18]。本实验结果显示,帕金森病组大鼠纹状体中p-AMPK/AMPK比值明显降低,枸杞多糖组大鼠纹状体中p-AMPK/AMPK比值明显升高,3组p-mTOR/mTOR比值变化不明显。提示AMPK-mTOR通路可能与帕金森病细胞自噬及氧化应激调控存在联系,枸杞多糖抗氧化及调控细胞自噬的作用可能基于AMPK-mTOR通路。
综上所述,枸杞多糖可能通过 AMPK-mTOR信号通路,抑制氧化应激及调控细胞自噬,起到保护黑质纹状体系统多巴胺能神经元的作用。本研究为临床应用枸杞多糖防治帕金森病提供了一定的实验依据和理论基础。
利益冲突:所有作者均声明不存在利益冲突。
