祛瘀解毒方调节炎症微环境抗结直肠癌肝转移的作用及机制研究
2022-09-21赵红伟孙玲玲吴健彬林丽珠
赵红伟,肖 茜,孙玲玲,吴健彬,林丽珠
(1. 广州中医药大学第一临床医学院,广东 广州 510405;2. 广州中医药大学第一附属医院,广东 广州 510405;3. 深圳市中医院,广东 深圳 518033;4. 江门市五邑中医院,广东 江门 529000)
结直肠癌是世界上最常见的恶性肿瘤之一,在所有恶性肿瘤中其发病率位居第三,病死率位居第二[1]。肝脏是结直肠癌血行转移最常见的解剖部位,据统计超过50%的结直肠癌患者会发生肝转移,结直肠癌肝转移是结直肠癌患者最常见的死亡原因[2]。炎症是恶性肿瘤的一个标志,与肿瘤的发生、发展和转移等密切相关[3-4]。既往研究显示,结直肠癌患者的中医证型与炎症因子表达具有相关性,其中瘀毒内阻证结直肠癌患者的炎症因子水平更高[5]。在中医理论中,“瘀”和“毒”被认为是两种关键的致病因素。《说文解字》中说:“瘀,积血也。”毒有内毒和外毒之分,外毒为有形之毒,内毒为脏腑功能失调产生的病理产物,恶性肿瘤的毒被归属为内毒。祛瘀解毒方是林丽珠教授根据多年临床经验总结的经验方,广泛用于瘀毒内阻证结直肠癌患者的治疗,有助于改善中晚期结直肠癌患者的生活质量,提高患者的生存率,延长生存时间[6-9],但其作用机制尚不明确。本研究以肿瘤炎症微环境为切入点,通过动物实验探讨了祛瘀解毒方对结直肠癌肝转移的作用及其可能机制。
1 实验材料与方法
1.1动物 雌性BALB/c小鼠20只,SPF级,6~8周龄,体重17~20 g,购于北京维通利华实验动物技术有限公司,生产许可证:SCXK(京)2016-0006。所有动物饲养于广东药科大学SPF 级实验动物中心。本实验已通过广东药科大学实验动物伦理委员会审查(gdpulacSPF2017265)。
1.2细胞 采用BALB/c小鼠同源的、荧光素酶标记的小鼠结肠癌细胞CT26.WT-luc,购于南京科佰生物科技有限公司(ADCC细胞源)。于37 ℃下5%CO2细胞培养箱中培养。
1.3药物 祛瘀解毒方由桃仁12 g、苦参12 g、土茯苓24 g、地榆15 g、槐花15 g、薏苡仁30 g、蒲公英30 g、土鳖虫6 g组成,药材均购于广州中医药大学第一附属医院。所有药材混匀后加水浸泡30 min,武火煮沸后改为文火,微沸慢煎40 min,过滤后收集一煎药液,同法二煎30 min,2次药液混合即为祛瘀解毒方汤剂。纱网过滤后,用旋转蒸发仪进行减压旋蒸(65 ℃,45~50 r/min),得到祛瘀解毒方浸膏。将浸膏置于-20 ℃冷冻过夜,用真空冷冻干燥机冻干[生药:冻干粉=9.756,小鼠等效剂量为2.22 mg/(g·d)],-20 ℃密封保存备用。
1.4主要试剂与仪器 Beetle Luciferin(Potassium Salt)(E1605)购于Promega。白细胞介素-1β(IL-1β,MEA563Mu)、白细胞介素-10(IL-10,MEA056Mu)、白细胞介素-6(IL-6,MEA079Mu)、肿瘤坏死因子-α(TNF-α,MEA133Mu)、转化生长因子-β(TGF-β,MEA124Mu)、CXC型趋化因子配体2(CXCL2,MEA603Mu)、CC型趋化因子配体2[CCL2,即单核细胞趋化蛋白-1(MCP-1),MEA087Mu]、CC型趋化因子配体3样蛋白1[CCL3L1, 即巨噬细胞炎性蛋白-1α(MIP-1α), MEA092Mu]ELISA检测试剂盒购于武汉优尔生科技有限公司;Anti-E-钙黏蛋白(E-cadherin)抗体(GB11082)、Anti-波形蛋白(Vimentin)抗体(GB11192)购于武汉赛维尔生物技术有限公司;Anti-细胞增殖标志物(Ki67)抗体(ab16667)、重组Anti-趋化因子C-C-基元受体2(CCR2)抗体(ab273050)购于Abcam。冷冻干燥机(宁波新芝生物科技股份有限公司,SCIENTZ-10N);CO2细胞培养箱(ThermoFisher,4111FO);全自动细胞计数仪(NEXCELOM,MINI-004-0205);小动物活体成像仪(PERKINELMER,PerkinElmer IVIS Spectrum);组织匀浆仪(MP Biomedicals Co. Ltd., FastPrep-24);酶标仪(赛默飞世尔上海仪器有限公司, Multiskan Mk3型);倒置显微镜(OLYMPUS,IX73)。
1.5实验方法 将20只BALB/c小鼠按体重随机分成模型组、祛瘀解毒方低剂量组、祛瘀解毒方中剂量组、祛瘀解毒方高剂量组,每组5只。4组小鼠均建立结直肠癌肝转移模型:术前禁食12 h,用2%阿佛丁(每10 g体重给药170 μL)腹腔注射麻醉,术野皮肤脱毛。固定小鼠呈右侧卧位,依次用碘酒和75% 酒精各消毒术野1次,采用左上腹斜切口,长度约1.0 cm,逐层开腹,用组织镊将脾脏从腹腔中轻轻牵出少许,必要时可轻轻牵拉脾脏周围脂肪,以便更好地暴露脾脏。用胰岛素注射器从小鼠脾脏上极进针约3 mm,进针方向与脾脏长轴平行,将CT26.WT-luc细胞悬液缓慢注入小鼠脾脏,每只小鼠注射细胞悬液5×105/50 μL,可见脾脏包膜肿胀、变白,注射时间2~3 min。轻轻拔出针头,用75%酒精棉签按压针眼处2 min以压迫止血及避免癌细胞外渗造成腹腔内种植转移。确认进针处无出血,将脾脏轻轻送回原位,随后全层缝合腹壁。手术过程严格遵守无菌操作原则。术后第3天开始,祛瘀解毒方低、中、高剂量组小鼠分别给予2.22 mg/(g·d)、4.44 mg/(g·d)、8.88 mg/(g·d)的祛瘀解毒方灌胃,模型组小鼠给予等体积的生理盐水灌胃,均1次/d,给药体积均为10 μL/g,连续灌胃14 d。
1.6检测指标及方法
1.6.1肝转移瘤形成情况 术后第17天,各组小鼠按照10 μL/g(即10 g的小鼠,注射100 μL 1.5 mg的荧光素底物)的剂量腹腔注射15 mg/mL Beetle Luciferin(Potassium Salt)工作液,约5 min后异氟烷气体吸入麻醉,约10 min小鼠麻醉完成,行小鼠活体成像,计算肝区荧光光子通量,评估结直肠癌肝转移情况。次日同法注射底物及麻醉后处死小鼠,取出小鼠肝脏,置于6孔板中,成像仪检测肝脏的荧光光子通量,进一步明确肝脏转移瘤的形成情况。
1.6.2肝组织病理观察 取各组小鼠部分肝组织,用10%中性福尔马林固定液固定后行石蜡包埋,切片机切成厚4 μm的薄层,行常规HE染色,脱水封片,镜下观察肝组织的病理形态。
1.6.3肝转移瘤组织中相关蛋白表达情况 取各组小鼠液氮冻存肝转移瘤组织,免疫组织化学法检测组织中Ki67、E-cadherin、Vimentin、CCR2蛋白表达情况。采用Image-Pro Plus 6.0软件分析图片的累积光密度值(IOD)以及组织的像素面积(Area),计算面密度(面密度=IOD/Area)。
1.6.4肝转移瘤组织中相关炎症因子及趋化因子含量 采用酶联免疫法检测各组小鼠肝转移瘤组织中炎症因子IL-1β、IL-6、TNF-α、TGF-β、IL-10及趋化因子CXCL2、CCL2、CCL3L1的含量,所有操作严格按照说明书进行。采用Sigma Plot 12.0软件绘制标准曲线,计算待测样品的浓度值。

2 结 果
2.1各组小鼠结直肠癌肝转移情况 活体成像显示,祛瘀解毒方各组小鼠的肝区荧光光子通量均较模型组低,其中祛瘀解毒方低剂量组与模型组比较差异有统计学意义(P<0.05),见图1。肝脏体外成像显示,祛瘀解毒方各组小鼠肝脏的荧光光子通量均明显低于模型组(P均<0.05),见图2。

图1 术后第17天各组结直肠癌肝转移小鼠活体成像生物发光情况及肝脏荧光光子通量
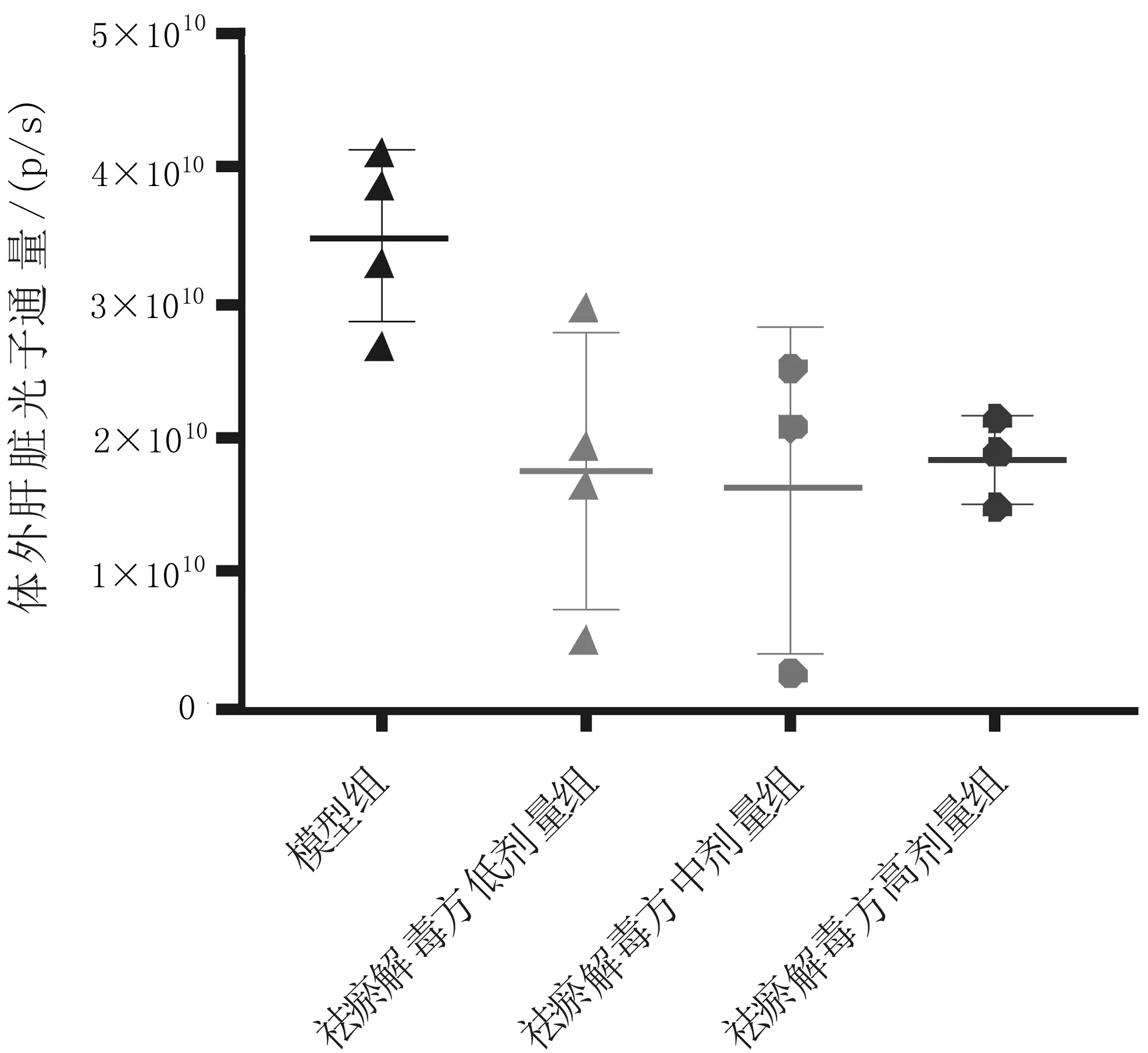
图2 术后第18天各组结直肠癌肝转移小鼠体外肝脏荧光光子通量
2.2各组小鼠肝脏HE染色情况 术后第18天,各组小鼠肝脏中均可观察到转移瘤的形成。见图3。
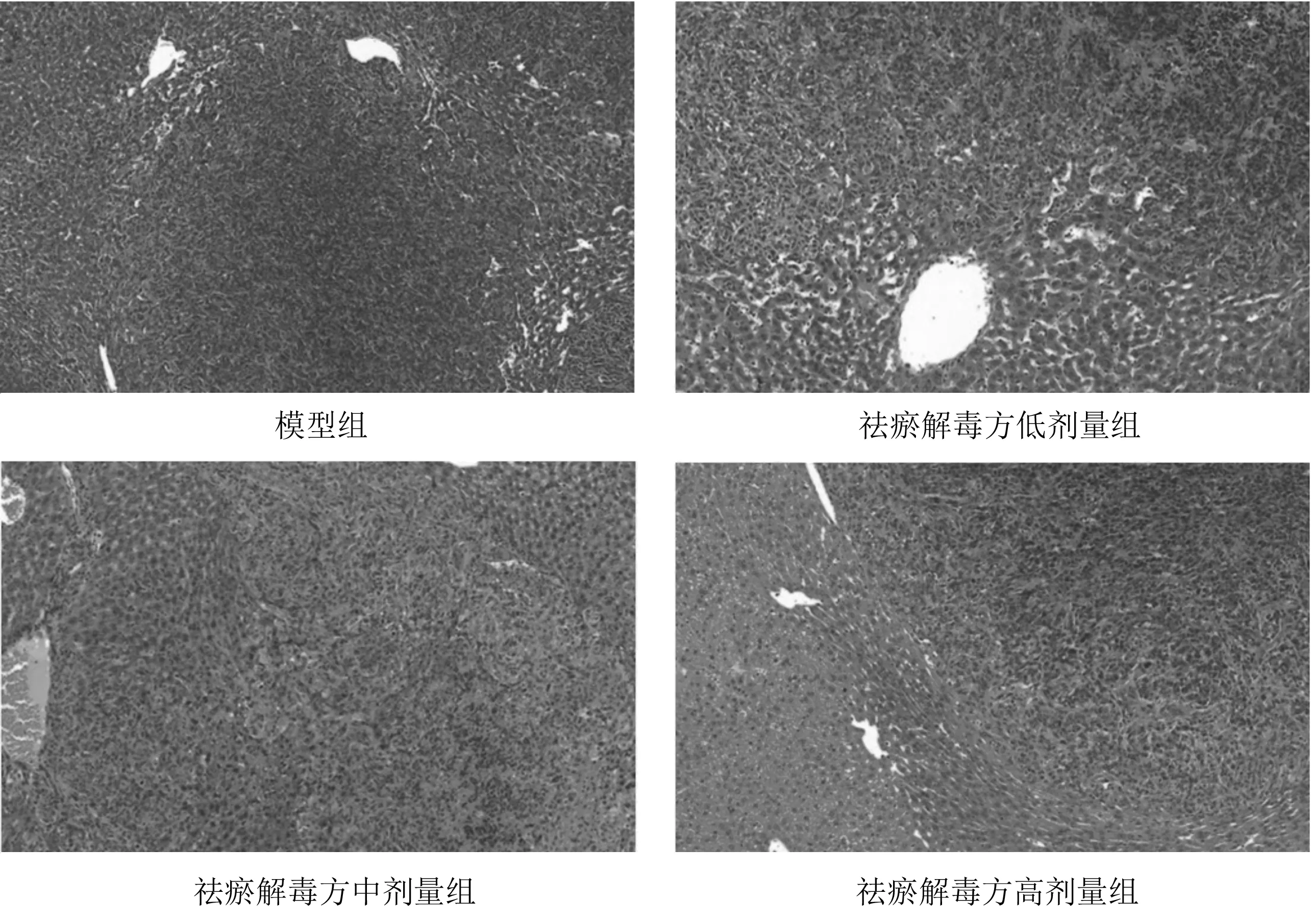
图3 术后第18天各组结直肠癌肝转移小鼠肝脏HE染色表现(×100)
2.3各组肝脏转移瘤组织中Ki67表达情况 祛瘀解毒方低、高剂量组肝脏转移瘤组织中Ki67表达面密度明显低于模型组(P均<0.05),祛瘀解毒方中剂量组也呈降低趋势,但与模型组比较差异无统计学意义(P>0.05)。见图4。

图4 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中Ki67表达情况(×400)
2.4各组肝脏转移瘤组织中E-cadherin表达情况祛瘀解毒方中、高剂量组肝脏转移瘤组织中E-cadherin面密度均明显高于模型组(P均<0.05)。见图5。

图5 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中E-cadherin表达情况(×400)
2.5各组肝脏转移瘤组织中Vimentin表达情况各组小鼠肝脏转移瘤组织中Vimentin表达面密度比较差异均无统计学意义(P>0.05)。见图6。

图6 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中Vimentin表达情况(×400)
2.6各组肝脏转移瘤组织中CCR2表达情况 祛瘀解毒方各组小鼠肝脏转移瘤组织中CCR2表达面密度均明显低于模型组(P均<0.05)。见图7。

图7 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中CCR2表达情况(×400)
2.7各组肝脏转移瘤组织中炎症因子表达情况祛瘀解毒方低剂量组IL-6含量、祛瘀解毒方中剂量组TNF-α和IL-10含量、祛瘀解毒方高剂量组IL-10含量均明显低于模型组(P均<0.05),各组IL-1β、TGF-β含量比较差异均无统计学意义(P均>0.05)。见图8。

图8 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中各炎症因子含量
2.8各组肝脏转移瘤组织中趋化因子表达情况祛瘀解毒方各组CXCL2含量、祛瘀解毒方中剂量组和高剂量组CCL2含量均明显低于模型组(P均<0.05),各组间CCL3L1含量比较差异均无统计学意义(P均>0.05)。见图9。
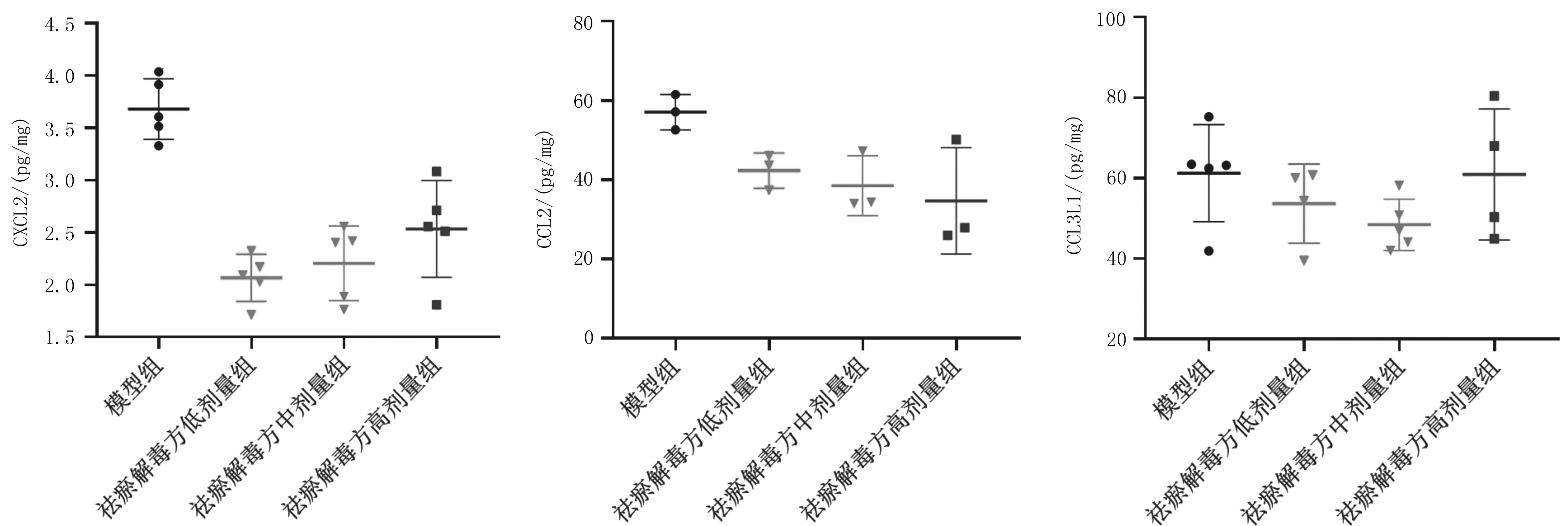
图9 术后第18天各组结直肠癌肝转移小鼠肝脏转移瘤组织中各趋化因子含量
3 讨 论
结直肠癌是我国最常见的消化道恶性肿瘤之一,防治结直肠癌肝转移是结直肠癌诊疗过程中最具挑战性的任务之一。炎症在多个层面上影响肿瘤的侵袭、上皮间质转化和细胞迁移等[10]。细胞核Ki67蛋白反映了细胞的增殖状态,其在肿瘤细胞中常高度过表达,是广泛运用的肿瘤增殖预后指标之一[11-12]。本实验证实祛瘀解毒方具有抑制结直肠癌肝转移的作用,并且显著降低了肿瘤细胞的增殖能力。上皮间质转化是指上皮细胞获得间质特征的过程,与肿瘤细胞的侵袭、转移等密切相关。上皮间质转化通常由上皮标志物E-cadherin的丢失和间质标志物Vimentin的表达增加来标识。E-cadherin是上皮细胞中的特异性蛋白,可介导钙依赖性同型细胞之间的黏附,具有维持组织结构完整性的作用,其低表达提示肿瘤具有更强的转移倾向。在结直肠癌细胞中,由于p53基因变异导致E-cadherin表达下调,使肿瘤细胞更易发生局部浸润和远处转移[13]。本实验结果表明,祛瘀解毒方可以上调小鼠肝脏转移瘤中E-cadherin蛋白的表达,调节上皮间质转化。
肿瘤转移是由诸多复杂因素相互作用引起的,受异常表达的细胞因子、生长因子和异常激活的癌基因的调节[14-15]。当荷瘤小鼠的肿瘤免疫功能发生紊乱时,促炎细胞因子IL-6分泌增加,进而促进结肠癌细胞的转移定植[16]。TGF-β参与正常组织细胞增殖、分化、免疫调节、凋亡和维持体内平衡等多种过程,在肿瘤形成的晚期阶段,TGF-β对恶性肿瘤和间质细胞具有促进作用,表现为促进肿瘤的侵袭和转移。本实验发现,祛瘀解毒方各组转移瘤中IL-6、TNF-α、IL-10、TGF-β含量均有不同程度降低,表明祛瘀解毒方的抑瘤作用与调节肿瘤微环境中炎症因子水平有关。
近年来,越来越多的证据支持趋化因子及其受体在癌症中的重要作用,通过调节肿瘤组织中趋化因子的表达,可影响肿瘤免疫逃逸和肿瘤转移[17-18]。CXCL2又叫生长调节致癌基因β(GROβ),其是一种原癌基因编码蛋白,来源于单核细胞、成纤维细胞、内皮细胞,CXCL2是CXCR2的配体,具有趋化中性粒细胞、初始T淋巴细胞和成纤维细胞的作用。最近研究表明,中性粒细胞和髓源性抑制细胞可通过CXCL/CXCR2信号促进肿瘤的进展[19]。CXCL2和巨噬细胞迁移抑制因子(MIF)通常在肿瘤微环境中过度表达,并与肿瘤浸润白细胞的募集相关[20]。在膀胱癌中,肿瘤细胞通过CXCL2/MIF-CXCR2信号通路,诱导骨髓来源的抑制性细胞聚集到肿瘤微环境中,引起免疫抑制,进而促进肿瘤发展,并且CXCL2的表达量越高,疾病分期和患者预后越差[21]。CCL2主要由内皮细胞、上皮细胞、髓样细胞、平滑肌细胞和成纤维细胞分泌,是CCR2的配体,其对单核细胞、嗜碱性粒细胞、T淋巴细胞和自然杀伤细胞具有很强的趋化作用,与肿瘤的病情和预后密切相关。有文献报道,肿瘤相关成纤维细胞(CAFs)和组织中常驻成纤维细胞可以通过炎症激活IL-6及CCL2,形成促进结直肠癌肝转移的微环境[22]。CCL3L1又叫巨噬细胞炎性蛋白-1α(MIP-1α),来源于单核细胞、T淋巴细胞、肥大细胞、成纤维细胞,是CCR1、CCR3和CCR5的配体,对单核细胞、T淋巴细胞、自然杀伤细胞具有趋化作用。本实验结果显示,祛瘀解毒方各组小鼠肝转移瘤中CXCL2、CCL2含量及CCR2表达面密度均低于模型组,提示祛瘀解毒方可以干扰趋化因子及其受体的表达。
综上所述,本研究通过小鼠活体成像、体外成像及上皮间质转化、炎症微环境角度初步证实了祛瘀解毒方具有抑制小鼠结直肠癌肝转移的作用,机制与降低肝转移瘤中炎症因子IL-6、TNF-α、IL-10和趋化因子CXCL2、CCL2的含量,下调趋化因子受体CCR2的表达有关,为后续进一步研究祛瘀解毒方的作用机制提供了思路。但本实验中尚未观察到祛瘀解毒方明显的剂量梯度效应,其抗肝转移的最优剂量仍有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
