丝素蛋白材料对成神经分化人脐带间充质干细胞生长的影响
2022-09-20许键炜解小芬匡涛胡光线王道勇冉渺杨小军伍徐娴
许键炜,解小芬,匡涛,胡光线,王道勇,冉渺,杨小军,伍徐娴
神经再生与神经系统功能重建一直是世界性的难题。每年全球因为意外损伤导致的瘫痪和神经系统退行性变导致的如帕金森病、阿尔茨海默症等患者高达5 300万[1-3],给患者、家庭及社会带来了巨大的经济负担。近年来,随着对干细胞研究的深入,有关干细胞移植治疗神经损伤和神经系统退行性变的研究取得了一定的进展。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSC)因其具有自我更新、多向分化及免疫调节等能力,在组织再生与修复领域备受关注[4]。课题组前期发现hUC-MSC在碱性成纤维生长因子、二甲基亚砜及丁羟基茴香醚等的诱导下,可成神经样细胞分化,表达神经细胞特异性标志物神经上皮干细胞蛋白和神经元特异性烯醇化酶[5]。移植hUC-MSC治疗大鼠脊髓损伤模型,发现hUC-MSC有明显的靶向归巢损伤部位的特性[6]。然而,对于一些较大的脑组织缺损如胶质瘤切除术后及脊髓损伤等,仅依靠hUC-MSC成神经分化,难以修补组织的缺损,最终难免发展成病理性的胶质瘢痕,阻碍神经功能的重建。因此,寻找生物相容性和机械性能良好的材料,联合干细胞治疗神经损伤成为研究的焦点。本研究利用天然产物家蚕丝素蛋白(silk fibroin,SF)制备成的SF薄膜与成神经分化hUC-MSC共培养,探讨SF薄膜对成神经分化hUC-MSC生物学特性的影响,为hUC-MSC作为种子细胞联合生物材料治疗神经损伤提供实验基础。
1 材料与方法
1.1 材料
新生儿脐带由贵州医科大学附属医院妇产科提供,经产妇知情同意,并通过医院人体伦理委员会审批。SF(亳州市德亿利药业销售有限公司),干细胞基本培养基(Gibco 公司),丙酮酸钠、L-谷氨酰胺(上海生工生物工程技术服务有限公司),B27(Gibco 公司),多聚赖氨酸(Poly-L-lysine,PLL)、FITC 标记的β-Ⅲ-Tubulin 抗体(Chemicon公司),Annexin-V FITC凋亡试剂盒(美国BD公司)。U-LH100L-3活细胞工作站(日本OLYMPUS公司),CO2培养箱(美国ThermoForma公司),酶标仪(BioTek,Winooski,美国VT公司),FACSCantot Ⅱ流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 SF水溶液的制备
家蚕丝分别用质量分数为0.5%的碳酸钠溶液煮沸脱胶,经3次煮沸,每次30 min,前2次每次煮沸后用60 ℃双蒸水清洗3遍,最后1次用双蒸水煮沸并清洗。脱胶所得纯SF于LiBr∶C2H5OH=40∶60 (质量比)、(80±2)℃恒温水浴搅拌溶解,获得再生SF溶液。经冷却后,将SF溶液用截流分子量为10 000的透析袋流水透析2 d,再用双蒸水透析1 d,每隔2 h换1次水,得SF水溶液。过滤后密封保存于冰箱中备用。
1.2.2 SF薄膜的制备
取已处理过的盖玻片若干,用SF溶液包被盖玻片,于烘箱中60 ℃烘烤2 h,然后用酒精覆盖盖玻片将其固定过夜。之后用双蒸水清洗7~8 次,每次20 min,在室温下自然风干。所得SF薄膜材料使用前放置于培养皿中并在超净台紫外灯下照射30 min进行无菌处理。
1.2.3 hUC-MSC的培养、扩增及鉴定
取健康的新生儿脐带(足月儿,不带细菌及病毒等),无菌生理盐水清洗,去除血凝块,75%酒精中浸泡30 s,用无菌生理盐水冲洗3遍去除残余酒精。将清洗后的脐带内的动、静脉血管剥离丢弃,再分离出血管周围的华通氏胶,用无菌的眼科镊将华通氏胶放入无菌的玻璃小瓶,用无菌眼科剪将华通氏胶剪碎成约1 mm3大小的组织块,将剪碎的华通氏胶均匀地铺在培养瓶中,放入37 ℃,5% CO2培养箱中培养。待原代细胞从华通氏胶组织块爬出后对其进行半换液,细胞融合至80%左右,可以对其进行传代培养。收集P3代细胞行流式细胞仪检测细胞表面分子标志物CD105、CD44、CD90及CD73等。
1.2.4 hUC-MSC成神经样分化及鉴定
选取生长状况良好的第4代hUC-MSC,按5×104/mL 接种于含包被PLL盖玻片的35 mm培养皿中。实验组:用hUC-MSC生长培养基(L-DMEM+10% FBS)培养。接种24 h后观察细胞生长状况,待细胞60%铺满盖玻片时,弃生长培养基,加入含10 μg/L bFGF的诱导培养基。诱导24 h后,换成无血清的诱导培养基[含2%二甲基亚砜(DMSO)和200 μmol/L 丁羟基茴香醚(BHA)]继续诱导6 h即诱导30 h。维持18 h即诱导48 h,之后继续维持24 h即诱导72 h。对照组:始终以hUC-MSC常规培养基(10%FBS+L-DMEM液)培养。定期观察细胞,取诱导前、诱导24 h、诱导30 h、诱导48 h、诱导72 h的细胞进行固定,并进行神经细胞特异性标志物巢蛋白(nestin)和神经元特异性烯醇化酶(neuron specific enolase,NSE)的免疫荧光染色检测。
1.2.5 成神经样分化hUC-MSC在SF薄膜上的培养及细胞生物学性状观察
取上述成神经样分化hUC-MSC制成单细胞悬液,计数细胞活力后,按2.5×104/mL密度接种于35 mm培养皿中,37 ℃、5% CO2条件下静置培养。培养48 h及72 h后,分别去除培养基,用PBS 清洗1 次,4%多聚甲醛、4 ℃冰箱内固定过夜。 PBS清洗后,加FITC 标记的羊抗鼠β-Ⅲ-Tubulin 抗体(1∶200),室温下放置1 h,PBS 清洗,50%甘油封片,U-LH100L-3活细胞工作站观察并采集图片。使用细胞计数试剂盒-8(CCK-8,Sigma-Aldrich)检测不同材料对细胞增殖的影响。培养72 h后,用10 mL CCK-8和90 mL L-DMEM组成的100 mL溶液转移到96孔培养板中。培养2 h后,通过酶标仪在450 nm处测量吸光度。用流式细胞仪对细胞凋亡和死亡进行定量,检测细胞与培养材料的生物相容性。分别对在PLL和SF膜上培养72 h的成神经样分化hUC-MSC用0.25%的胰蛋白酶消化,PBS 清洗1次后,用异硫氰酸荧光素(fluorescein isothiocyanate isomer I,FITC)结合的膜联蛋白V和碘化丙啶(propidium iodide,PI)双重染色后进行检测,并使用FlowJo软件进行分析。
1.3 统计学方法
实验数据通过 NIH ImageJ 软件处理,所有实验数据和统计量化图由SYSTAT.Sigma Stat计算并绘制。
2 结果
2.1 hUC-MSC的培养、扩增及鉴定
脐带华通氏胶组织碎块接种第3天,倒置荧光显微镜下可观察到少量长梭状细胞爬出贴于皿底,4~5 d,细胞迅速增多,汇聚后细胞排列紧密,呈群落样生长,聚合的细胞呈漩涡状。原代细胞融合达80%左右,可进行传代。经过数代培养后,细胞形状无明显变化,增殖能力无明显变化(图1)。流式细胞仪检测结果显示CD105、CD44、CD90及CD73呈阳性表达。
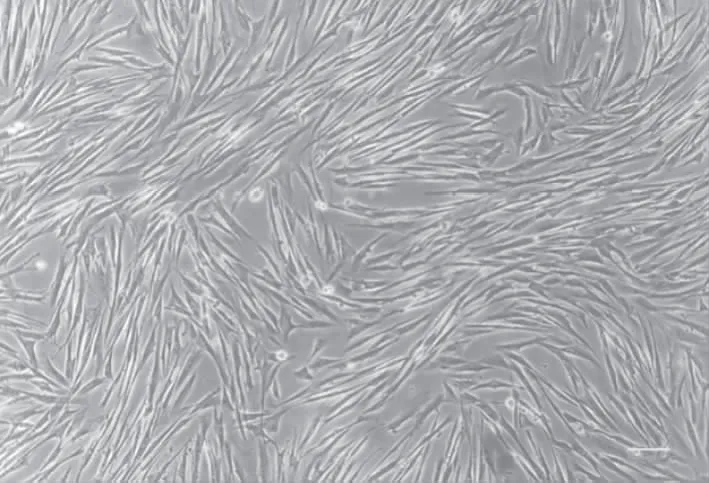
图1 P3代的hUC-MSC的细胞形态(标尺=100 μm)
2.2 hUC-MSC成神经样分化
经上述方法诱导30 h,hUC-MSC由不规则多角长梭形逐渐变圆,折光性增强,伸出细长的突起,并且多为两极突起。继续维持培养48 h后,发生形态改变的细胞数目进一步增加,细胞出现3个或更多分叉及次级分叉,呈现出典型的神经元样(图2)。
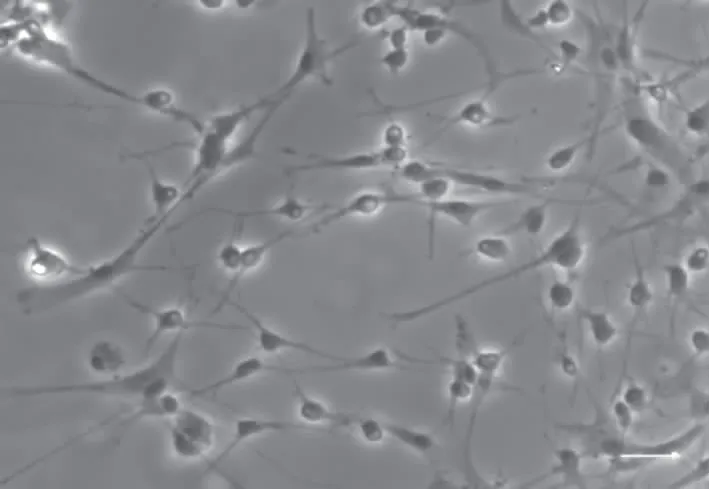
图2 hUC-MSC成神经样分化图(标尺=100 μm)
通过免疫荧光技术检测nestin和NSE的表达,整个诱导分化过程中,nestin的表达呈现出先增高后降低的趋势。NSE在诱导期和维持前期均为阴性,在整个过程的中、末期才开始表达,到维持72 h时有75%左右的细胞表达。不同诱导时间的hUC-MSC免疫荧光结果统计见图3。
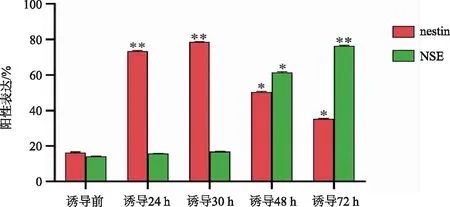
注:* P<0.05,** P<0.01,表示与对照组比较差异有显著意义。图3 不同诱导时间的hUC-MSC免疫荧光结果的统计学分析图
2.3 成神经样分化hUC-MSC在SF膜上的生长及生物学性状
成神经样分化hUC-MSC培养在SF膜及PLL上,在上述配制的细胞培养液中培养1~3 d会保持圆形或椭圆形,两极或更多分叉及次级分叉,伸出细长的突起。培养24 h,β-Ⅲ-Tubulin免疫荧光染色均呈阳性表达,SF膜上细胞树枝状分叉数与常规包被液PLL相似。培养72 h,β-Ⅲ-Tubulin免疫荧光染色均持续呈阳性表达,SF膜上细胞树枝状分叉数多于常规包被液PLL上的细胞树枝状分叉数。对每个培养皿随机观察5个视野的活细胞进行统计,结果显示,培养24 h,SF膜上附着大量活细胞,细胞数量较接种时没有明显减少,与PLL包被的培养皿相比,细胞密度相似。培养至72 h后,SF膜上细胞数量较PLL包被的培养皿上的细胞数量明显增多。CCK-8分析结果表明,三维SF膜培养比二维PLL涂层培养更有利于成神经样分化hUC-MSC的扩展,细胞在三维SF膜上的活性随着培养时间的延长而增加,显著高于在二维PLL涂层培养皿中的活性。2组细胞的存活率第1天至第3天均增加,第3天以后存活曲线趋于平稳。成神经样分化hUC-MSC在SF膜及PLL上的生长情况见图4。
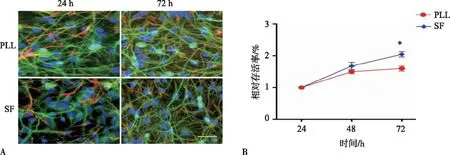
注:A为β-III-Tubulin(绿)/Hoechst 33258(蓝) /GFAP(红)免疫荧光染色(Scale bar=100 μm),B为成神经样分化hUC-MSC在不同材料上的相对存活率。*P<0.05。图4 成神经样分化hUC-MSC在不同材料上的生长情况
对培养72 h成神经样分化hUC-MSC进行Annexin-V和PI染色,流式细胞术检测其凋亡和死亡情况。在SF膜及PLL包被的培养皿上成神经样分化hUC-MSC大多数是活的,SF膜上活细胞数量占97.5%,PLL包被的培养皿中活细胞数量占94.5%。这些结果表明,SF膜无毒,具有良好的生物相容性,可使成神经样分化hUC-MSC粘附、扩散,并具有良好的增殖能力。成神经样分化hUC-MSC在SF膜及PLL上的存活率见图5。
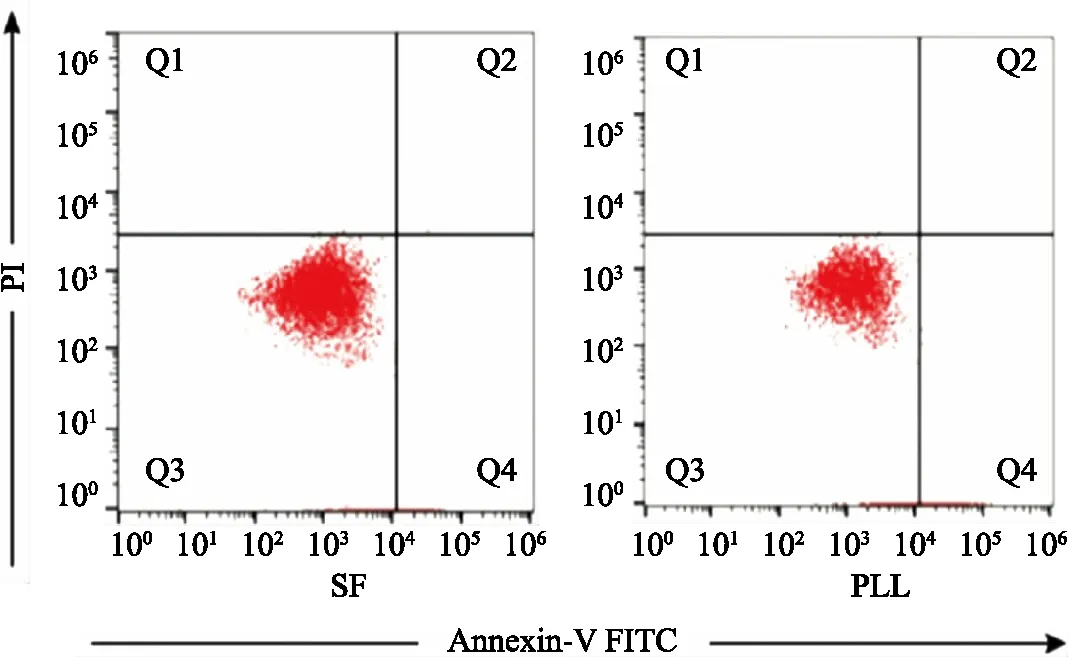
图5 成神经样分化hUC-MSC在不同材料上的存活率
3 讨论
课题组前期研究发现,家蚕SF对于细胞的附着、生长及增殖具有良好的效果[7]。丝素来源于蚕丝中心,是一种高纯度的天然蛋白,因其具有无毒、无刺激、无抗原性及易降解等优点[8],目前已经在手术缝合线、创面保护材料、人工器官及药物缓释体等生物材料方面得到了广泛的应用。本实验以hUC-MSC作为种子细胞,诱导其向神经元样细胞分化,并表达神经细胞特异性标志物nestin和NSE,说明hUC-MSC可以分化为神经样细胞,这为间充质干细胞移植治疗神经系统疾病提供了实验支持。通过对成神经样分化的hUC-MSC在SF膜上的生长情况及生物学性状的实验观察,结果表明SF膜对成神经样分化的hUC-MSC具有良好的生物相容性和支持作用。与PLL相比,SF膜更能促进成神经样分化的hUC-MSC的成活和成熟。通过β-Ⅲ-Tubulin特异性免疫荧光染色,随机选取荧光视野内β-Ⅲ-Tubulin阳性细胞,计算单个细胞的树枝状分叉总数、一级分叉数,并测量细胞树枝状分叉总长度发现,SF膜上的成神经样分化的hUC-MSC与常规包被的PLL上的成神经样分化hUC-MSC一样具有较高的复杂度,说明SF膜非常适合成神经样分化hUC-MSC的生长,并促进其分化。CCK-8及流式细胞检测结果证明SF膜具有良好的生物相容性,能更好地支持成神经样分化的hUC-MSC的生长,促进其增殖,并提高其成活率。
神经系统损伤后,炎症因子可通过激活内源性神经干细胞,使其再进入细胞循环,并诱导其增殖、分化,产生各种神经细胞来代替缺损的细胞[9-11]。但在动物实验及临床研究中发现,中枢神经系统损伤导致内源性神经干细胞增殖产生的几乎全是胶质细胞[12-13]。由内源性干细胞产生的神经组织可能不足以代替损伤后缺失的神经组织,尤其在诸如脑和脊髓损伤以及大脑胶质瘤切除术后等较为严重的缺损下,这就限制了内源性神经干细胞的临床应用。若直接将大量外源性细胞移植注入损伤部位,又会因为细胞缺乏支撑条件而大量死亡[14]。因此,利用组织工程技术开发SF膜来为种子细胞的生存和迁移创造条件,对于提高细胞的存活率并发挥功能提供了可能。SF膜是一种极具开发潜力的神经组织工程的生物材料,并可能为探讨神经系统损伤或神经系统退行性变的有效治疗及干预,促进神经修复及功能重建提供新的途径。
