miR-455-3p过表达对宫颈癌C33a细胞放疗敏感性的影响研究
2022-09-19王建新
崔 瑶 时 沛 王建新
近年来,临床对中晚期宫颈癌患者通常采用同步放化疗方式,但部分患者效果并不理想,原因与其对放疗不敏感或产生抗性密切相关[1]。因此,研究宫颈癌放疗抗性机制,增强肿瘤细胞放疗敏感性是改善该病预后的重要途径。微小RNA(microRNA,miR)是一种具有进化保守性,长度19~22个核苷酸的单链非编码RNA,研究表明其与细胞发育、增殖、分化、死亡等生物过程有关,且参与肿瘤发病及进展[2-3]。近年来,miR-455-3p被发现异常低表达于涎腺腺样囊性癌、卵巢癌、宫颈癌等恶性肿瘤中,参与调控细胞增殖、侵袭、转移、凋亡等肿瘤生物学行为[4-6]。然而,目前鲜有关于miR-455-3p过表达对宫颈癌细胞放疗敏感性的影响及机制研究。本研究通过建立miR-455-3p过表达的宫颈癌C33a细胞系,研究其对宫颈癌细胞放疗敏感性的影响,并探究相关机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 宫颈癌C33a细胞株,购于上海康朗生物科技有限公司。培养条件:含10%胎牛血清、1%双抗(青霉素、链霉素)的RPMI培养基,标准条件(饱和湿度,37 ℃,5% CO2)培养箱。
1.1.2 主要试剂和仪器 带有绿色荧光标记的miR-455-3p过表达质粒miR-455-3p mimics、阴性对照质粒miR-NC(武汉生命之美科技有限公司),LipofectamineTM2000试剂盒(上海阳光生物科技有限公司),qRT-PCR检测试剂盒、全蛋白提取试剂盒、BCA试剂盒(美国Sigma公司),二甲基噻唑(dimethylthiazole,MTT)溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)溶液、FITC-Anexin V染液、碘化丙啶(propidium iodide,PI)染液(上海懋康生物科技有限公司),兔抗人去乙酰化酶2(histone deacetylase2,HADC2)、磷脂酰肌醇3-激酶(phosphatei-dylinositol 3 kinase,PI3K)、p-PI3K、蛋白激酶B(protein kinase B,AKT)、p-AKT一抗,山羊抗兔IgG二抗(美国Santa cruz公司)。
NIB900-FL倒置荧光显微镜(德国莱卡显微系统有限公司),CFX96 QRT-PCR仪(美国Bio-rad公司),Elekta Synergy直线加速器(瑞典Elekta公司),Amnis® ImageStream®X MK Ⅱ流式细胞仪(德国Luminex公司)。
1.2 方法
1.2.1 细胞培养、转染及分组 取对数期C33a细胞,倒置显微镜观察其生长状态,待细胞铺满瓶底75%左右时,胰酶消化,调整密度至1×105个/孔,接种至6培养板传代。细胞再次融合至70%左右时,按照LipofectamineTM2000试剂盒说明书操作要求将带有绿色荧光标记的miR-455-3p过表达质粒miR-455-3p mimics、阴性对照质粒miR-NC转染至C33a细胞,分别设为miR-455-3p mimics组、miR-NC组,每组设置5个复孔,转染48 h后经荧光显微镜观察转染效率,取稳定转染细胞进行后续实验。取未经处理的细胞设为空白组。
1.2.2 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)、Western blot检测miR-455-3p mRNA,HADC2 mRNA与蛋白相对表达量 qRT-PCR检测miR-455-3p、HADC2 mRNA相对表达量:取各组细胞,Trizol试剂盒提取总RNA,检测纯度与浓度后,逆转录获取cDNA,琼脂糖凝胶电泳鉴定后根据qRT-PCR检测试剂盒说明书要求设置反应体系及反应条件:SYBR Green Mix 9.5 μL,上、下游引物各1 μL,DNA模板1.5 μL,加入双蒸水使总反应体系至20 μL,95 ℃ 35 s,60 ℃ 30 s,72 ℃ 30 s重复40个循环,72延伸5 min。以GAPDH为内参基因,2-△△CT法计算miR-455-3p、HADC2 mRNA相对表达量。实验所用引物:miR-455-3p:上游:5'-GTCACGTGCATGCGCGCACGCTGC-3';下游:5'-GCACGTGTGCACGTGCGCACGCAC-3';GAPDH:上游:5'-TGACGTCGTGCAGGACGTGCATGC-3';下游:5'-AGGCGCTGCATGCCGTACGTGACG-3'。所有实验重复3次取平均值。
Western blot检测HADC2蛋白相对表达量:取各组细胞,经RIPA细胞裂解液冰上裂解30 min,8 000 r/min,离心半径8 cm离心10 min,全蛋白提取试剂盒提取总蛋白,沸水浴10 min变性,BCA试剂盒定量。取30 μg待测蛋白,混合上样缓冲液,电泳后湿转至PVDF膜,5%脱脂奶粉室温封闭2 h,TBST洗涤,加入兔抗人HADC2一抗稀释液(1∶1 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔IgG二抗稀释液(1∶8 000),常温孵育2 h,TBST洗涤,加入ELC发光液,暗室中显影、定影,凝胶成像系统扫描分析,以HADC2/GAPDH灰度值表示其蛋白相对表达量。所有实验重复3次取平均值。
1.2.3 生物信息学软件及双荧光素酶实验验证miR-455-3p与HADC2的靶向关系 采用生物信息学软件TargetScan、miRwalk初步预测,含有miR-455-3p结合位点的HADC2 mRNA 3'UTR,由北京信诺金达生物科技有限公司对其进行鉴定与扩增,构建HADC2 3'UTR野生型(HADC2-WT)、突变型(HADC2-MT)双荧光素酶报告载体。取对数期C33a细胞,细胞融合至75%左右时开始转染,参照LipofectamineTM2000试剂盒说明书要求,将HADC2-WT、HADC2-MT与内参海肾荧光素酶质粒pRLTK共转染至空白组、miR-455-3p mimics组、miR-NC组,孵育48 h,PBS清洗细胞,加入Promega细胞裂解液(110 μL/孔),孵育20 min,根据荧光素酶试剂盒操作要求对荧光素酶强度进行检测,并计算相对荧光素酶活性,相对荧光素酶活性值=萤火虫荧光素酶活性/海肾荧光素酶活性。所有实验重复3次取平均值。
1.2.4 MTT法检测不同照射剂量对C33a细胞增殖抑制率 采用直线加速器,6 MV X射线照射,距离100 cm,吸收剂量率200 cGy/min,将1.5 cm补偿胶覆盖于培养板上用以模拟皮肤,将培养板放置于水槽上。取各组细胞,调整密度至1×105个/孔,接种至6培养板,待细胞融合至75%左右时,分别采用2、4、6、8 Gy照射剂量处理24 h,加入新鲜制备MTT溶液(20 μL/孔,5.00 g/L),2 h后弃上清,加入DMSO溶液(150 μL/孔),充分振荡10 min,结晶完全溶解后采用酶标仪检测各组吸光度值(A490 nm),计算细胞增殖抑制率(%)=(1-不同照射剂量组A490 nm/空白对照组A490 nm)×100%,并绘制抑制率曲线,获取放疗对C33a细胞的半数抑制剂量(half inhibitory concentration,IC50)。
1.2.5 流式细胞术检测细胞凋亡率 取各组细胞,调整密度至1×105个/孔,接种至6培养板,待细胞融合至75%左右时,8 Gy照射剂量处理24 h,PBS洗涤,2800 r/min,离心半径12 cm离心10 min,4 ℃ binding buffer标记液重悬细胞,与5 μL AnnexinV-FITC混合均匀,4 ℃避光孵育15 min,加入5 μL PI染液染色5 min,过滤,60 min内经流式细胞仪检测细胞凋亡情况,CellQuest软件分析数据。
1.2.6 PI染色检测细胞周期 取各组细胞,细胞融合至75%左右时8 Gy照射剂量处理24 h,采用胰蛋白酶消化,加入培养基终止,轻吹细胞,转移至离心管(15 mL),4 ℃ 3 000 r/min,离心半径10 cm离心10 min,4 ℃ PBS冲洗后继续离心10 min;加入PBS重悬细胞,与1 mL 70% 4 ℃乙醇混合均匀,4 ℃固定24 h,离心、冲洗后加入PI染液(RNaseA 10 μL,染色缓冲液0.5 mL,PI染液25 μL),避光冰浴30 min;300目滤网过滤,流式细胞仪检测细胞周期分布情况。
1.2.7 Western blot检测PI3K、p-PI3K、AKT、p-AKT蛋白相对表达量 取各组细胞,蛋白收集、定量、电泳、转膜等方式同1.2.2,加入兔抗人PI3K、p-PI3K、AKT、p-AKT一抗(1∶1 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶10 000),孵育、显色、计算方式同1.2.2。
1.3 统计学方法
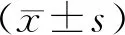
2 结果
2.1 转染效率观察
宫颈癌C33a细胞转染48 h后,荧光显微镜观察结果显示,miR-NC组、miR-455-3p mimics组转染效率均>80%,符合后续实验要求。见图1。

图1 荧光显微镜观察转染效率(×400)
2.2 各组miR-455-3p、HADC2表达比较
miR-455-3p mRNA,HADC2 mRNA及蛋白相对表达量组间比较,差异有统计学意义(P<0.05);miR-455-3p mimics组miR-455-3p mRNA相对表达量高于空白组、miR-NC组,HADC2 mRNA及蛋白相对表达量低于空白组、miR-NC组(P<0.05);空白组、miR-NC组miR-455-3p mRNA,HADC2 mRNA及蛋白相对表达量比较,差异无统计学意义(P>0.05),见表1。

表1 各组miR-455-3p、HADC2表达情况
2.3 生物信息学软件预测及双荧光素酶实验结果
生物信息学预测显示Has-miR-455-3p与HADC2基因的3'UTR存在互补结合位点。见图2。双荧光素酶实验结果显示,HADC2-WT相对荧光素酶活性值组间比较,差异有统计学意义(P<0.05),HADC2-MT相对荧光素酶活性值组间比较,差异无统计学意义(P>0.05);miR-455-3p mimics组HADC2-WT相对荧光素酶活性值低于空白组、miR-NC组(P<0.05);空白组、miR-NC组HADC2-WT相对荧光素酶活性值比较,差异无统计学意义(P>0.05)。见表2。

表2 双荧光素酶实验结果

图2 HADC2潜在上游miR-455-3p预测结果
2.4 不同照射剂量对C33a细胞增殖抑制率及IC50
不同照射剂量对C33a细胞增殖抑制率及IC50值组间比较,差异有统计学意义(P<0.05);miR-455-3p mimics组不同照射剂量对C33a细胞增殖抑制率高于空白组、miR-NC组,IC50值低于空白组、miR-NC组(P<0.05);空白组、miR-NC组不同照射剂量对C33a细胞增殖抑制率及IC50值比较,差异均无统计学意义(P>0.05),见表3、图3。

表3 不同照射剂量对C33a细胞增殖抑制率及
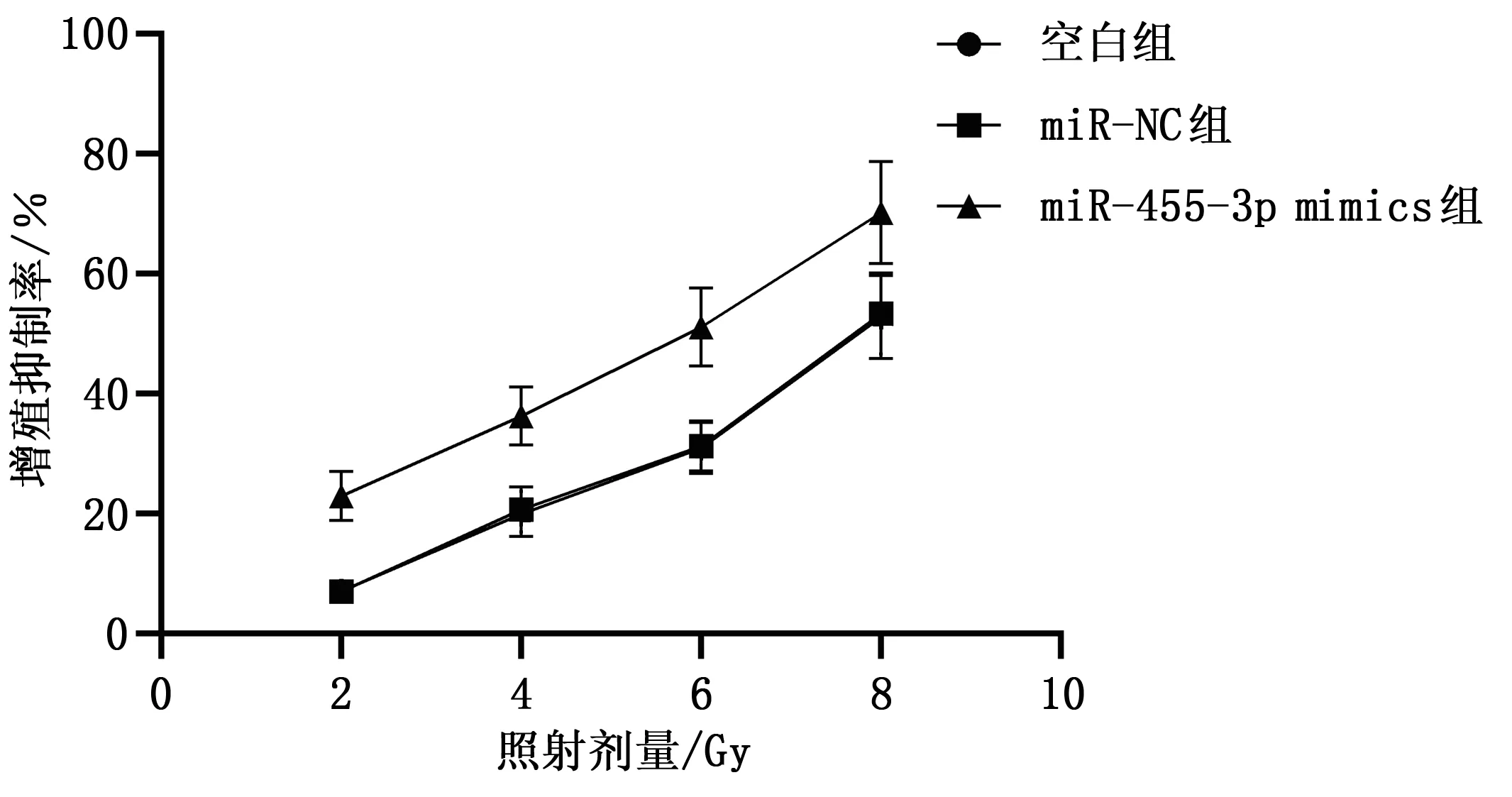
图3 不同照射剂量对C33a细胞增殖抑制率
2.5 各组凋亡率比较
空白组、miR-NC组、miR-455-3p mimics组凋亡率分别为(2.21±0.35)%、(2.36±0.41)%、(48.52±6.14)%,凋亡率组间比较,差异有统计学意义(F=281.348,P<0.001);miR-455-3p mimics组凋亡率高于空白组、miR-NC组(t=16.838、16.773,P<0.001);空白组、anti-miR-NC组凋亡率比较,差异无统计学意义(t=0.622,P=0.551)。见图4。

图4 流式细胞术检测细胞凋亡率
2.6 各组细胞周期分布比较
G0/G1、G2/M占比组间比较,差异有统计学意义(P<0.05);miR-455-3p mimics组G0/G1占比高于空白组、miR-NC组,G2/M占比低于空白组、miR-NC组(P<0.05);空白组、miR-NC组G0/G1占比、G2/M占比比较,差异无统计学意义(P>0.05);G0、S占比组间比较,差异无统计学意义(P>0.05),见表4。

表4 各组细胞周期分布比较
2.7 各组细胞p-PI3K/PI3K、p-AKT/AKT比较
p-PI3K/PI3K、p-AKT/AKT组间比较,差异有统计学意义(P<0.05);miR-455-3p mimics组p-PI3K/PI3K、p-AKT/AKT低于空白组、miR-NC组(P<0.05);空白组、miR-NC组p-PI3K/PI3K、p-AKT/AKT比较,差异无统计学意义(P>0.05),见表5。

表5 各组细胞p-PI3K/PI3K、p-AKT/AKT比较
3 讨论
宫颈癌是常见的生殖系统恶性肿瘤,且近年来呈发病率升高、年轻化趋势[7]。放疗是宫颈癌尤其是中晚期患者主要治疗方式之一,但部分患者由于对放射线不敏感而造成治疗中断或失败,导致预后不良。研究认为[8-9],宫颈癌放疗敏感性通常与细胞周期检测点无法被正确激活、信号转导通路异常、DNA双链损伤、细胞缺氧等有关,且局部或远处转移患者放疗抗性更强,不同病理类型放疗抗性也存在差异。因此,探索宫颈癌放疗增敏方式已成为目前该病研究热点。
miRNA转录后通过结合靶向蛋白编码基因mRNA的3'UTR,抑制其翻译或诱导其降解,发挥与原癌基因、抑癌基因类似的作用,进而影响细胞生物学进程如放疗抵抗相关机制[10-11]。近年来,miRNA在肿瘤进程中的关键作用使其逐渐成为肿瘤诊断血清标志物及潜在治疗靶标而备受关注。miR-455-3p在结直肠癌、上皮性卵巢癌等肿瘤中低表达,被认为是抑癌基因参与各种生物进程的调控[12-13]。Yi等[14]采用qRT-PCR检测miR-455-3p在骨肉瘤组织及细胞中的表达时发现其异常低表达,且与肿瘤体积、远处转移、临床分期有关,并对该病预后不良具有预测作用。Liu等[15]研究得出,miR-455-3p在人食管鳞状细胞癌肿瘤发生及化疗耐药中起重要作用,且通过使多个与干性相关的途径失活来减少CD90+和CD271+T细胞亚群,提示其与耐药相关性。本研究结果显示,与空白组、miR-NC组比较,miR-455-3p mimics组不同照射剂量对C33a细胞增殖抑制率、凋亡率、细胞G0/G1占比升高,IC50值、细胞G2/M占比降低,提示miR-455-3p过表达可增强宫颈癌C33a细胞放疗敏感性。王朝等[16]研究认为,miR-455-3p过表达可促进C33a细胞凋亡,增强其放射敏感性,本研究结果与其具有一致性,共同提示miR-455-3p过表达对宫颈癌细胞的放疗增敏作用。
HDAC2是HDAC家族成员,可催化蛋白发生去乙酰基化并结合带负电DNA,使染色质呈组抑结构,抑制特定基因如肿瘤抑制基因的表达。本研究显示,miR-455-3p mimics组HADC2 mRNA与蛋白相对表达量低于空白组、miR-NC组,且经双荧光素酶实验验证HADC2是miR-455-3p的靶基因。PI3K/AKT通路是机体重要的信号转导通路之一,研究证实其与肿瘤放疗抗性密切相关,过度激活该信号将导致放疗失败,抑制该通路可改善肿瘤细胞放疗抗性[17]。目前认为应激因素引发HDAC2表达及活性改变的主要机制是激活PI3K/AKT信号通路,细胞受到刺激后PI3K发生磷酸化,产生第二信使3,4,5-三磷酸磷脂酰肌醇,经磷酸化作用引起AKT活化,转移至胞浆或胞核中,介导下游底物促进肿瘤细胞增殖、转移、侵袭等行为,增强细胞缺氧抗力,减少细胞凋亡,增强肿瘤细胞放化疗抗性[18]。本研究结果中,miR-455-3p mimics组p-PI3K/PI3K、p-AKT/AKT低于空白组、miR-NC组,提示miR-455-3p可能通过下调HADC2,抑制PI3K、AKT发挥宫颈癌C33a细胞放疗增敏作用。
综上所述,miR-455-3p过表达可提高放疗对宫颈癌C33a细胞增殖抑制率,促进细胞凋亡,将细胞阻滞在G0/G1期,从而增强细胞放疗敏感性,推测其作用机制与下调HADC2从而抑制PI3K/AKT信号通路有关。
