lncRNA PANDAR通过TGF-β/Smad4通路抑制宫颈癌细胞的顺铂耐药
2022-09-19赵雄涛周冬梅
朱 骞 赵雄涛 张 潍 周冬梅
宫颈癌(cervical cancer)是临床上常见的恶性肿瘤,据全球癌症数据统计(the global cancer observatory,GLOBOCAN)2018年报告,宫颈癌是女性的第四大常见恶性肿瘤[1]。卫生部的相关数据显示,我国每年有超过13 万宫颈癌新发病例,占全球新发病例数的25%左右,死亡病例约2~3 万[2]。宫颈癌的诊断数据显示,将近一半的患者已处于疾病晚期,超过了手术治疗的最佳时期[3],因此化疗在宫颈癌的治疗中占有重要地位。以顺铂(cisplatin,DDP)为代表的铂类药物联合化疗被认为是宫颈癌的标准化疗方案[3-4]。在之前的研究中我们发现,LncRNA CDKN1A 反义链启动子DNA 损伤激动RNA(promoter of CDKN1A antisense DNA damage activated RNA,PANDAR)能够降低宫颈癌细胞株HeLa的顺铂耐药,并且降低HeLa细胞对顺铂的敏感性[5]。然而PANDAR究竟是通过何种机制抑制HeLa的顺铂耐药性尚不明确。上皮间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞打破细胞间和细胞间基质黏附状态的重要过程,赋予癌细胞化疗耐药性。本文在前期研究基础上,通过生物信息学预测PANDAR的靶基因并研究PANDAR介导的EMT在HeLa细胞顺铂耐药中的作用,旨在明确PANDAR对人宫颈癌细胞株HeLa顺铂耐药性的作用机制,提供理论依据并完善研究结果。
1 材料与方法
1.1 细胞和主要试剂
人宫颈癌HeLa细胞株购自上海拜力公司,顺铂购自Sigma 公司,HeLa-DDP耐药细胞株为本实验前期建立。LV-sh-PANDAR 慢病毒载体购自和元生物技术(上海)股份有限公司。RIPA裂解液和牛血清白蛋白购自美国Sigma公司,CCK-8 试剂盒购自上海碧云天生物技术公司;Annexin VFITC/PI 凋亡试剂盒购自南京建成生物工程研究所。转化生长因子-β1(transforming growth factor 1,TGF-β1)抗体,Smad4抗体,钙粘附蛋白E(E-cadherin)抗体及钙粘附蛋白N(N-cadherin)抗体购自Abcam。
1.2 细胞培养
HeLa 细胞培养在含10%胎牛血清、1%青霉素-链霉素双抗的RPMI 1640 培养液中,于5%CO2,37°C培养箱中培养。HeLa-DDP耐药细胞株由本实验前期建立,采用药物浓度梯度递增法获得[5]。
1.3 蛋白提取和免疫印迹Western blot
收集HeLa或HeLa-DDP细胞,弃掉培养液后每孔加入1 ml RIPA裂解液,冰上裂解10 min。BCA试剂盒检测裂解液蛋白浓度。每孔加入15 μg蛋白于聚丙烯酰胺凝胶上并进行电泳,电转至PVDF膜上;随后用5%牛血清白蛋白封闭1 h。4 ℃条件下一抗(E-cadherin,N-cadherin,TGF-β,Smad4)孵育PVDF膜并过夜,随后二抗孵育。ECL发光试剂盒检测目的蛋白的表达,Image-Pro Plus 6.0软件定量分析目的条带。
1.4 PANDAR靶基因预测
通过lncATLAS网站 (https://lncatlas.crg.eu/)预测PANDAR评估PANDAR的定位(位于细胞核)。通过RNAInter网站(http://www.rna-society.org/rnainter/)预测PANDAR潜在的靶基因;根据已有的实验结果和文献报道筛选靶基因。
1.5 CCK-8检测
0.25%胰蛋白酶消化细胞后计数,以5×104个细胞/孔的密度接种于6孔板,分别用不同浓度(0、1、2、4、8和16 μg/ml)顺铂处理,48 h后每孔加入10 μl CCK-8溶液孵育4 h,酶标仪上测定每孔在450 nm处的吸光值。
1.6 流式检测细胞凋亡
0.25%胰蛋白酶消化HeLa-DDP细胞并计数,以5×105个细胞/孔的密度接种在6孔板,37 ℃培养过夜。用无血清的培养基处理细胞8 h后加入10 ng/ml的TGF-β,37 ℃作用36 h。收集细胞,将细胞重悬于400 μL Binding Buffer,加入5 μL Annexin V-FITC 轻轻混匀,室温下避光孵育15 min,加入10 μL PI并混匀,冰浴避光放置5 min,30 min内于流式细胞仪上检测细胞凋亡。细胞随机分为四组:PANDAR,PANDAR + TGF-β,PANDAR + Cisplatin和PANDAR + Cisplatin + TGF-β。
1.7 统计学方法
应用SPSS 19.0软件进行数据的统计分析。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析及Bonferroni事后检验。P<0.05为差异具有统计学意义。
2 结果
2.1 细胞形态及EMT标志分子表达
显微镜下观察HeLa细胞及HeLa-DDP细胞形态发现,HeLa细胞形态规则,呈圆形或卵圆形,细胞间紧密相连。HeLa-DDP细胞形态不规则,呈长梭形,细胞间疏散。Western blot结果表明,与HeLa细胞相比,HeLa-DDP细胞中上皮标志物E-cadherin表达量下调,而间质分子标志物N-cadherin表达量上调(图1)。表明HeLa-DDP细胞发生了EMT变化。

图1 HeLa细胞及HeLa-DDP细胞形态及EMT标志分子表达
2.2 PANDAR对HeLa-DDP细胞EMT发生的影响
PANDAR过表达载体处理HeLa-DDP细胞,光学显微镜结果显示HeLa-DDPControl及HeLa-DDPNC细胞呈长梭形,而HeLa-DDPPANDAR细胞多呈圆形或卵圆形。Western blot结果表明与HeLa-DDPNC细胞相比,HeLa-DDPPANDAR细胞中E-cadherin表达量上升,N-cadherin表达量下降(图2A)。
光学显微镜结果显示,HeLa-DDPsh-PANDAR细胞与HeLa-DDPsh-NC细胞形态上差别不大,均呈长梭形。Western blot结果表明与HeLa-DDPsh-NC细胞相比,HeLa-DDPsh-PANDAR细胞E-cadherin表达量下降,N-cadherin表达量上升(图2B)。
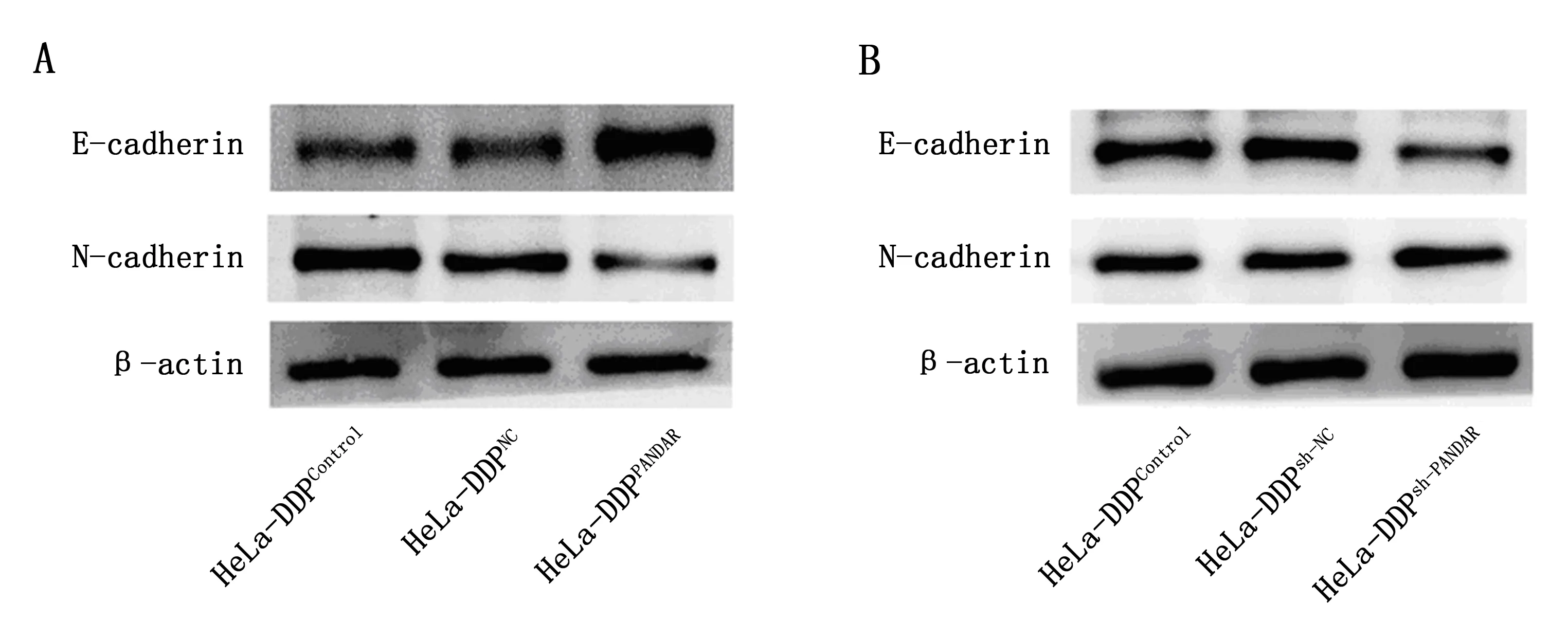
A为Western blot检测PANDAR过表达对E-cadherin及N-cadherin表达水平的影响;B为Western blot检测PANDAR敲减对E-cadherin及N-cadherin表达水平的影响。
2.3 PANDAR对HeLa细胞TGF-β/Smad4通路的影响
RNAInter预测网站(http://www.rna-society.org/rnainter/)显示Smad4为PANDAR潜在的靶基因,且这一预测结果得到ChIP-seq分析数据的支持[6-7]。Western blot结果显示,与HeLaNC细胞中TGF-β(0.96±0.13)和Smad4 (1.07±0.15)蛋白相对表达水平比较,HeLaPANDAR细胞中TGF-β(0.28±0.06)和Smad4(0.38±0.03)蛋白的相对表达水平较低,差异有统计学意义(P<0.05,图3A~B)。
HeLash-PANDAR细胞TGF-β蛋白相对表达水平为2.13±0.15,Smad4蛋白相对表达水平为2.67±0.18,与 HeLash-NC细胞(TGF-β:1.03±0.06;Smad4:1.05±0.03)比较,差异有统计学意义(P<0.05),见图3C~D。
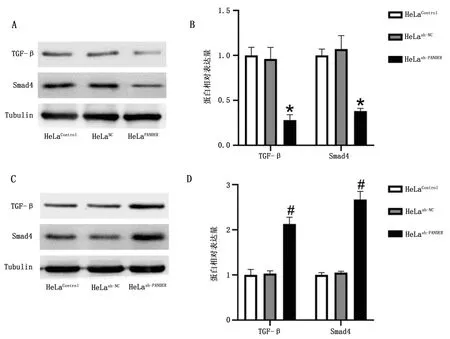
A为PANDAR过表达后TGF-β及Smad4蛋白表达水平;B为PANDAR过表达后TGF-β及Smad4蛋白相对定量结果;C为PANDAR敲减后TGF-β及Smad4蛋白表达水平;D为PANDAR敲减后TGF-β及Smad4蛋白相对定量结果。
2.4 TGF-β逆转PANDAR对EMT的影响
PANDAR过表达的HeLa/DDP细胞,加入10 ng/ml的TGF-β处理,检测EMT标志蛋白水平的变化。光学显微镜显示,TGF-β处理的HeLa-DDPPANDAR细胞排列不规则,多呈长梭形,细胞间疏散。Western blot结果显示,与HeLa-DDPPANDAR细胞中E-cadherin(1.00±0.08)和N-cadherin(1.00±0.03)蛋白相对表达水平比较,HeLa-DDPPANDAR+TGF-β细胞中E-cadherin蛋白表达水平(0.46±0.06)相对降低,N-cadherin蛋白相对表达水平(2.58±0.13)升高,差异有统计学意义(P<0.05,图4)。
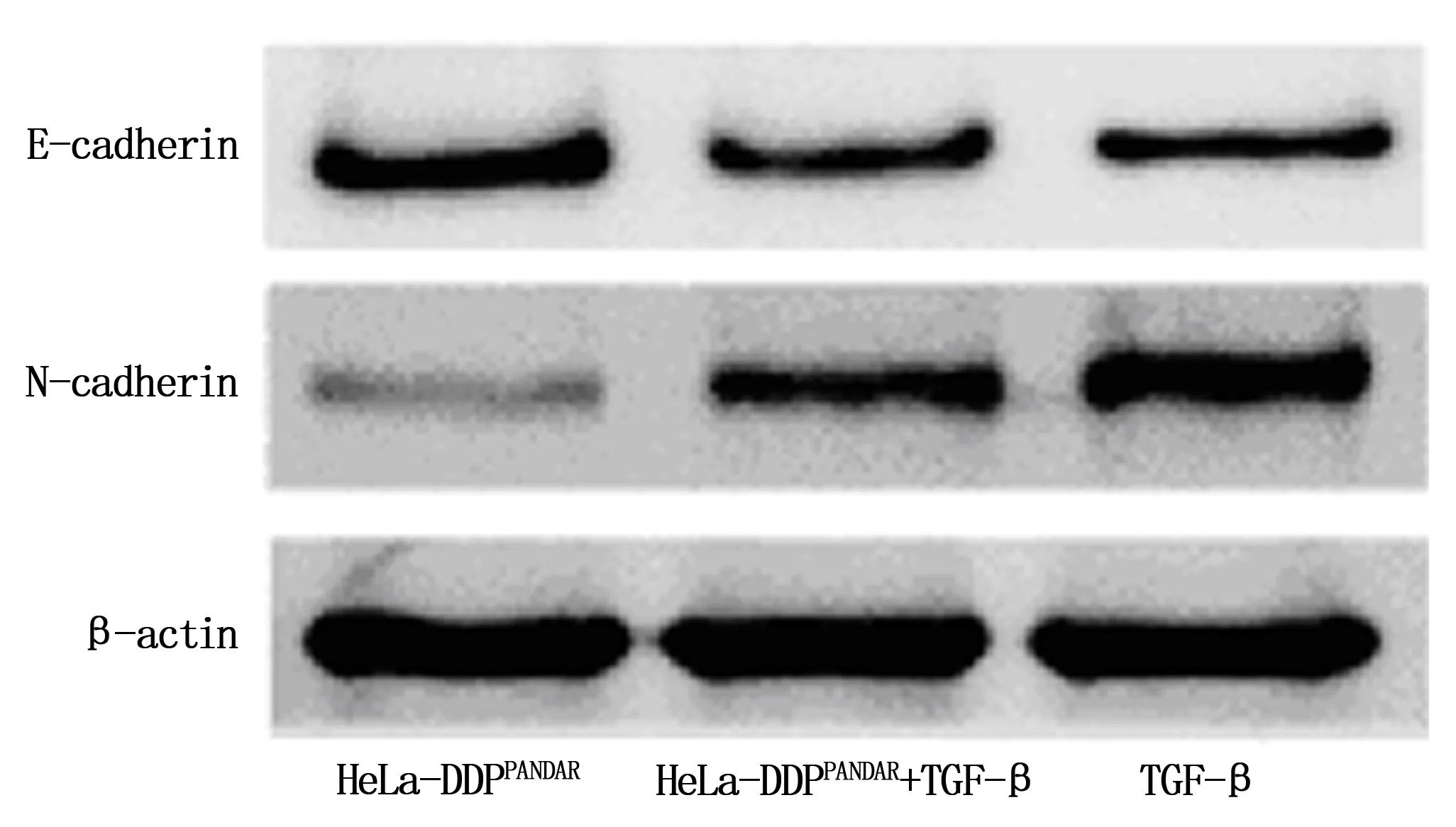
图4 Western blot检测E-cadherin及N-cadherin表达水平
2.5 TGF-β逆转PANDAR介导的HeLa-DDP细胞Cisplatin耐受
如图5A显示,随着Cisplatin浓度升高,HeLa-DDPPANDAR细胞OD450值逐渐降低。与TGF-β未处理相比,TGF-β处理的HeLa-DDPPANDAR细胞OD450值上调(图5A)。TGF-β处理显著降低Cisplatin诱导的HeLa-DDPPANDAR细胞凋亡(P<0.05),见图5B~C。
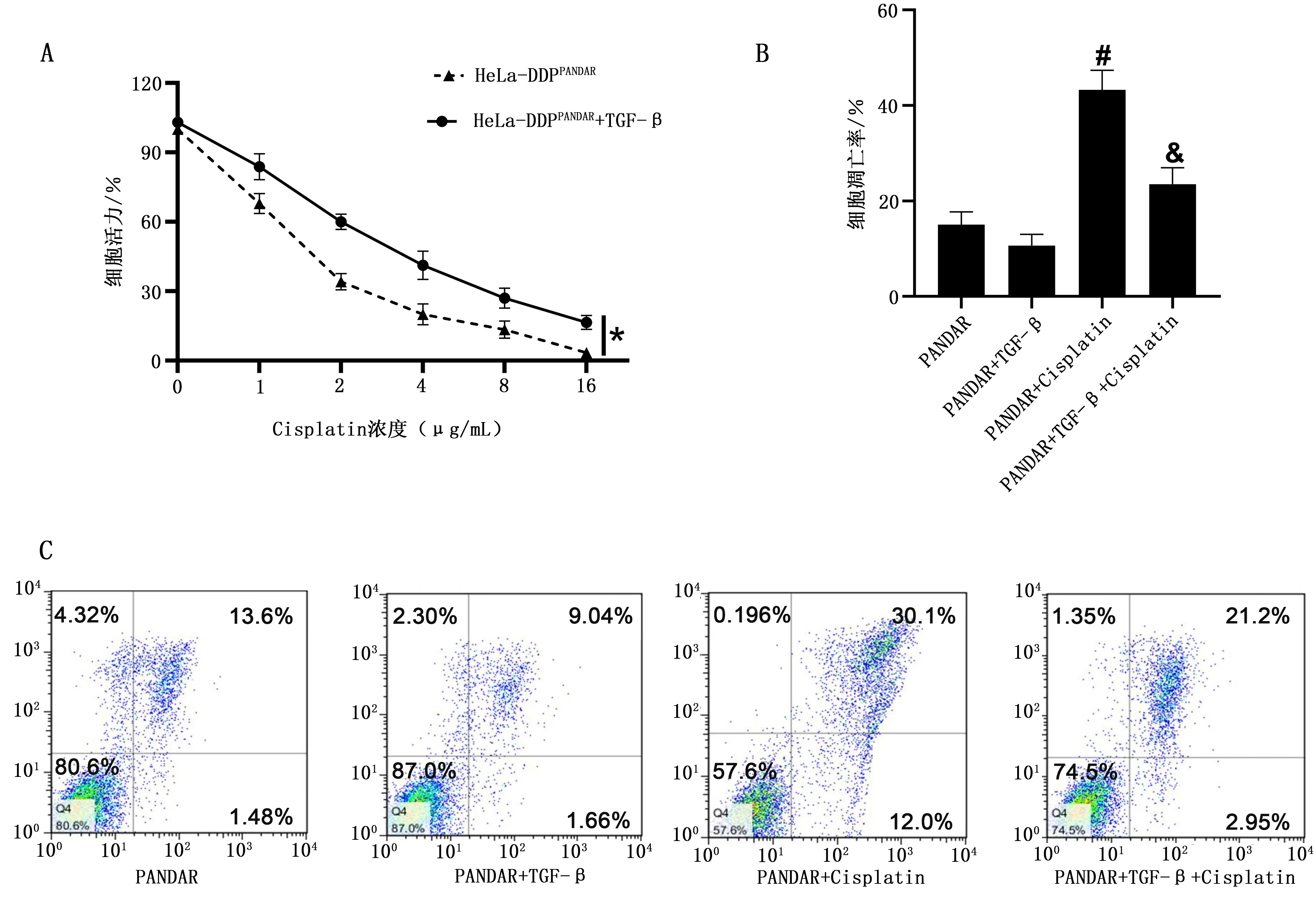
注:A为CCK-8实验检测细胞活力;B为细胞凋亡定量结果;C为流式细胞术检测细胞凋亡。
3 讨论
本文研究发现,PANDAR抑制HeLa-DDP细胞的EMT进程。PANDAR过表达后TGF-β和Smad4蛋白表达水平显著降低。TGF-β逆转了PANDAR介导的HeLa-DDP细胞EMT进程和Cisplatin耐药。
在不同肿瘤中,PANDAR起着抑癌或促癌的作用[8]。据报道,PANDAR可与精氨酸/丝氨酸丰富剪接因子2(SRSF2)结合,调控p53蛋白丝氨酸15磷酸化,从而降低顺铂敏感性[9]。我们的前期研究发现,PANDAR过表达可以降低HeLa-DDP细胞对Cisplatin耐受性[5]。EMT过程可通过将静止的上皮细胞转化为可移动的间充质细胞并改变细胞-细胞粘附以及细胞外基质,从而显着促进癌细胞侵袭和化学耐药性[10-11]。在乳腺癌,黑色素瘤及结直肠癌细胞中,PANDAR敲除导致间充质标志分子(如N-钙粘蛋白,波形蛋白,β-连环蛋白)表达降低,E-钙粘蛋白表达升高,抑制EMT过程[12,13]。在本研究中,我们发现HeLa-DDP细胞呈现出明显的间质特性,PANDAR过表达抑制了耐药细胞的EMT进程,而PANDAR敲除促进耐药细胞的EMT进程。PANDAR在不同肿瘤中对EMT的作用可能与肿瘤的异质性和PANDAR复杂的调节机制有关。
通过lncATLAS网站(https://lncatlas.crg.eu/)得知,lncRNA PANDAR主要定位于细胞核中。Zhang[14]等在肺癌细胞中也发现PANDAR主要定位于细胞核中,并通过上调苄氯素1(BECN1)激活自噬和凋亡途径,进而抑制肺癌发展进程。PANDAR的细胞核定位决定了其可通过直接与靶基因结合来激活或抑制靶基因的表达。通过ChIP-seq分析结果发现,PANDAR能与Smad4结合[6-7]。Smad4在TGF-β作用下,可转移到细胞核内并于转录因子一起介导靶基因的抑制或激活。研究表明,肿瘤微环境中接近肿瘤血管的癌症干细胞接受并响应TGF-β信号,使癌症干细胞细胞分裂变缓,从而避开一些靶向快速分裂细胞的抗癌疗法(如顺铂治疗)[15]。此外,TGF-β/Smad4信号通路通过诱导Snail1/2,ZEB1/2等转录因子的表达,促进诱导细胞发生EMT变化,使细胞对化疗药物表现出更强的耐受性[16-17]。本文研究发现,PANDAR的过表达显著下调了TGF-β和Smad4蛋白的表达水平;TGF-β处理PANDAR过表达的HeLa-DDP细胞,研究PANDAR过表达对HeLa-DDP细胞EMT进程和耐药性影响的机制,结果证明TGF-β可逆转PANDAR 过表达对HeLa-DDP细胞EMT的抑制作用。此外,TGF-β过表达逆转了PANDAR过表达诱导的HeLa-DDP细胞凋亡。考虑到TGF-β介导凋亡和EMT是一个相互排斥和相互关联、受到某些因素调控并因此处于动态平衡的过程[18],提示PANDAR可能通过TGF-β/Smad4调控宫颈癌EMT和凋亡的动态平衡过程。
综上所述,联合前期的研究成果,我们发现了PANDAR调节HeLa-DDP细胞耐药性较完整的分子机制,即PANDAR通过抑制TGF-β/Smad4通路影响HeLa细胞的EMT进程,进而影响其耐药性。这一研究发现为减轻宫颈癌的耐药性和探索更有效的治疗方法提供了理论依据。
