孕早期血清IL-33和sST2及其比值与妊娠期糖尿病的相关性
2022-09-16李秀娟张林林于志娟
李秀娟,张林林,于志娟
(1.赤峰市医院产科,内蒙古 赤峰 024000;2.阿鲁科尔沁旗妇幼保健计划生育服务中心产科,内蒙古 赤峰 025550)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期常见的合并症之一,相关流行病学调查显示我国GDM的发病率约为17.5%[1]。GDM不仅影响母胎安全,增加早产、难产、巨大儿、新生儿低血糖等不良妊娠结局的发生风险,也显著增加了孕妇远期罹患2型糖尿病、心血管疾病的风险[2]。目前,GDM的诊断主要依赖于孕24~28周时口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)检查,缺乏早期评估GDM发病的有效手段。近年,多项国内外队列研究对孕早期孕妇进行了随访观察,发现孕早期血常规指标及生化指标对GDM的发病具有预测价值,但不足之处是预测效能较差、灵敏度和特异度均较差[3-5]。因此,寻找孕早期预测GDM的标志物不仅有助于GDM的早期筛查及干预,也有助于深入认识GDM的发病机制。
微炎症反应的持续激活在GDM及2型糖尿病的发病中均起到重要作用,多种炎症细胞因子的分泌紊乱介导了胰岛素抵抗,进而参与了GDM及2型糖尿病的发生发展。白介素(interleukin,IL)-33属于IL-1家族,其生物学功能是通过识别膜受体肿瘤抑制素2(suppression of tumorigenicity 2,ST2)抑制炎症反应;可溶性ST2(soluble suppression of tumorigenicity 2,sST2)通过与膜受体ST2竞争性结合IL-33的方式起到促炎作用[6]。有基础研究报道,外源性给予IL-33可显著改善糖尿病小鼠及糖尿病前期小鼠的糖代谢,提示IL-33在糖尿病发病中起保护作用[7];但IL-33和糖尿病相关的临床研究结果与基础研究报道并不一致,GDM患者血清中IL-33水平均显著升高[8],异常升高的IL-33在糖尿病发病中起促进作用还是代偿性保护作用并不清楚。因此,为了系统地认识IL-33/ST2轴在GDM发病中的作用及评估价值,本研究以血清IL-33、sST2作为标志物,分析孕早期母体血清IL-33、sST2水平及其比值与GDM的相关性。
1 研究对象与方法
1.1 研究对象
选择2017年4月至2020年12月期间在赤峰市医院定期产检的孕妇为研究对象。纳入标准:①孕8~12周时在本院早孕门诊建档,完成血常规及生化检验;②单胎妊娠;③定期产检,孕24~28周时完成75g OGTT;④临床资料及样本完整。排除标准:①既往有糖尿病、高血压、贫血、甲状腺疾病等病史;②妊娠期合并妊娠期高血压、肝内胆汁淤积症等并发症。本次共纳入244例孕妇,根据OGTT结果、参照《妊娠合并糖尿病诊治指南(2014)》[9]中GDM的诊断标准进行分组,其中GDM组40例、正常葡萄糖耐量(normal glucose tolerance,NGT)组204例。本研究获得医院伦理委员会批准(伦理[2017]第46号)。
1.2 方法
1.2.1 血清IL-33和sST2水平的检测
孕早期建档时,采集空腹外周静脉血5~6mL于生化采血管内,静置30min后凝血,以3 000r/min离心10min后分离上层血清,采用酶联免疫吸附法试剂盒(上海西唐生物公司)检测IL-33和sST2水平。
1.2.2 临床资料的收集
孕早期建档时,收集临床资料:孕妇的年龄、孕次、产次、孕前体质量指数(body mass index,BMI)、孕早期增重、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、血红蛋白(hemoglobin,Hb)、红细胞计数(red blood cell,RBC)、白细胞计数(white blood cell,WBC)、血小板计数(platelet,PLT)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰基转移酶(γ-glutamyl transferase,GGT)、甘油三酯(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)。
孕中期时,收集OGTT资料:空腹血糖(fasting plasma glucose,FPG)、空腹血胰岛素(fasting insulin,F-Ins),参照稳态模型计算胰岛素抵抗指数(homeostatic model assessment for insulin resistance,HOMA-IR),HOMA-IR=FPG×F-Ins/22.5。
1.3 统计学方法

2 结果
2.1 GDM组与NGT组的一般资料
本研究共纳入244例孕妇,有40例发生了GDM,发生率为16.39%。
GDM组的年龄、孕前BMI、孕早期增重均显著高于NGT组(P<0.05),而孕次、产次≥1次的分布与NGT组比较差异均无统计学意义(P>0.05),见表1。
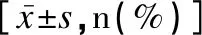
表1 GDM组与NGT组一般资料的比较Table 1 Comparison of general data between the GDM group and the NGT
2.2 GDM组与NGT组孕早期的实验室指标
GDM组孕早期的IL-33/sST2比值低于NGT组,Hb、RBC、WBC、TG、TC、GGT、ALP、IL-33、sST2水平均显著高于NGT组(P<0.05),而PLT、ALT、AST与NGT组比较差异均无统计学意义(P>0.05),见表2。
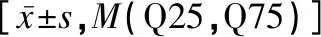
表2 GDM组与NGT组孕早期实验室指标的比较Table 2 Comparison of laboratory indexes in the first trimester of pregnancy between the GDM group and the NGT
2.3 GDM组孕早期血清IL-33和sST2水平及其比值与孕中期OGTT结果的相关性
在GDM组,孕早期血清IL-33水平与孕中期OGTT时的FPG、HOMA-IR均呈负相关(r=-0.434,P=0.005;r=-0.391,P=0.013),孕早期血清sST2水平与孕中期OGTT时的FPG、HOMA-IR均呈正相关(r=0.373,P=0.018;r=0.343,P=0.030),孕早期IL-33/sST2比值与孕中期OGTT时的FPG、HOMA-IR均呈负相关(r=-0.546,P<0.001;r=-0.534,P<0.001),见图1。
2.4 GDM相关因素的Logistic回归分析
以是否发生GDM为因变量,以两组间比较差异有统计学意义的因素为自变量,在Logistic回归模型中进行分析,采用逐步回归法筛选变量,最终IL-33、sST2、IL-33/sST2、孕前BMI、孕早期增重、Hb、TC、GGT纳入模型,分析结果显示:IL-33、IL-33/sST2、Hb、TC均是发生GDM的影响因素(P<0.05),见表3。
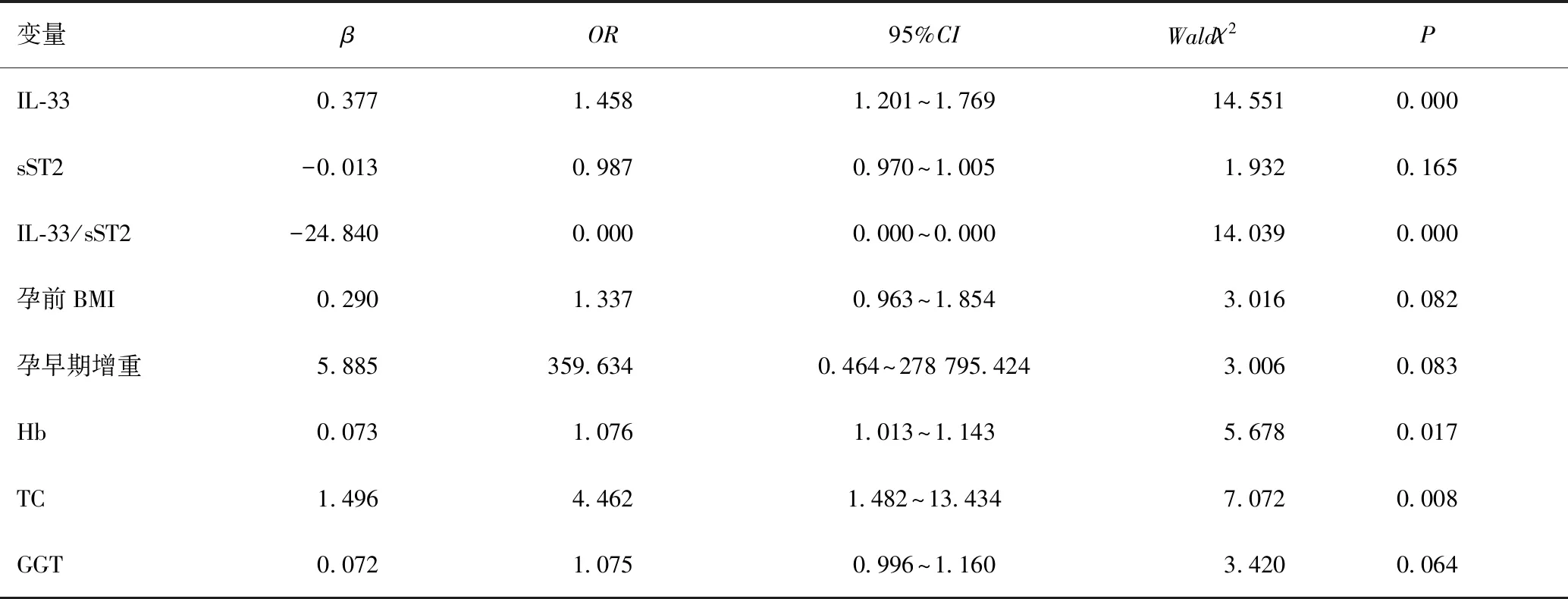
表3 GDM相关因素的Logistic回归分析Table 3 Logistic regression analysis of GDM related factors
2.5 血清IL-33水平及IL-33/sST2比值预测GDM的ROC曲线分析
血清IL-33水平及IL-33/sST2比值两项指标对GDM具有预测价值(P<0.05),ROC曲线见图2A、图2B、表4。根据Logistic回归分析得到回归方程:-31.119+0.377×IL-33-24.840×IL-33/sST2+0.073×Hb-1.496×TC,以该方程为联合指标预测GDM的ROC曲线见图2C,联合指标对GDM具有预测价值(P<0.05),见表4。
3 讨论
GDM的发病机制未明,也缺乏孕早期评估GDM发病风险的标志物[10]。本研究以IL-33/ST2轴为切入点,以孕中期(24~28周)时75g OGTT作为诊断GDM的金标准,分析GDM孕早期的筛查标志物,旨在为临床上孕早期评估GDM发病风险并进行干预提供参考依据,也为今后深入认识GDM的发病机制提供思路。本研究共纳入244例孕妇,有40例发生了GDM,发生率占16.39%,接近相关流行病学调查报道17.5%的GDM发病率[1]。
3.1 IL-33/ST2轴的研究现状
IL-33/ST2轴具有抗炎活性,IL-33与细胞膜受体ST2结合后,通过调控下游叉头状转录因子p3(forkhead box protein 3,Foxp3)、肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6)、髓样分化因子88(myeloid differentiation factor 88,MyD88)、核因子-κB(nuclear factor-κB,NF-κB)等表达的方式,减少促炎因子释放、增加抗炎因子释放,进而在炎症反应的激活中起抑制作用[11]。Hasan等[12]研究显示,糖尿病前期及2型糖尿病患者脂肪组织中IL-33和ST2表达降低与炎症基因TRAF6、MyD88、NF-κB等,以及促炎因子CCL2、IL-1β表达增加有关,提示IL-33/ST2轴在糖尿病的发病过程中起抗炎作用。sST2是膜受体ST2裂解后释放进入血液循环的产物,能够与ST2竞争性结合IL-33,拮抗IL-33/ST2轴的抗炎作用,进而介导促炎效应,并参与胰岛素抵抗的发生[13]。多项临床研究证实,血清中sST2的增多与2型糖尿病及相应的大血管并发症、微血管并发症发病有关[14-16]。
3.2 GDM发病过程中IL-33/ST2轴的变化
GDM的发病与2型糖尿病及肥胖存在共同的病理、生理特征,即胰岛素抵抗,炎症反应的激活是影响胰岛素敏感性、加重胰岛素抵抗的关键生物学环节。已有研究证实,2型糖尿病及肥胖患者血清IL-33和sST2均有增加,但在相关性分析中显示,具有抗炎作用的IL-33与胰岛素抵抗程度呈负相关,具有促炎活性的sST2与胰岛素抵抗程度呈正相关[13,17]。另有妊娠相关研究证实,孕早期sST2的检测可作为评价子痫前期的标志物[18-19]。本研究将IL-33、sST2作为孕早期筛查GDM的标志物,与NGT孕妇比较,GDM患者孕早期的血清IL-33和sST2水平均明显升高,且孕早期血清IL-33水平与孕中期OGTT时血糖水平及胰岛素抵抗程度均呈负相关,孕早期血清sST2水平与与孕中期OGTT时血糖水平及胰岛素抵抗程度均呈正相关,提示孕早期血清IL-33和sST2水平的增高与GDM的发病及胰岛素抵抗的程度有关。
3.3 IL-33/ST2轴与GDM病情的关系
Pavlovic等[7]研究显示,IL-33具有改善炎症反应及胰岛素抵抗的生物学活性。本研究中血清IL-33水平与血糖水平及胰岛素抵抗程度均呈负相关的结果符合IL-33的生物学活性,基于此推测GDM患者孕早期血清IL-33水平升高可能是机体自身代偿的调控机制,通过代偿性增加IL-33水平的释放来减轻炎症反应及胰岛素抵抗。已有研究证实了sST2的促炎活性,妊娠过程中sST2生成增加可能与肥胖因素、饮食因素等有关,孕早期增多的sST2水平通过其促炎作用影响胰岛素敏感性,并在孕期逐步加重胰岛素抵抗,最终导致GDM的发生[13]。因为IL-33的抗炎作用和sST2的促炎作用相互影响、相互调控,所以本研究通过IL-33/sST2比值来反映IL-33抗炎作用与sST2促炎作用的平衡关系。GDM患者孕早期IL-33/sST2比值低于NGT孕妇,且与血糖水平及胰岛素抵抗程度均呈负相关,表明虽然GDM孕早期血清IL-33、sST2水平均有增加,但通过比值的分析可以推测sST2的增加程度较IL-33更为显著,IL-33/sST2的平衡向sST2所介导的促炎作用偏移;随着IL-33/sST2平衡向sST2偏移的加重,IL-33/sST2比值降低且胰岛素抵抗程度加重。
3.4 IL-33/ST2轴预测GDM的价值
有研究显示,孕早期血常规指标Hb、RBC、WBC,以及生化指标TG、TC、GGT、ALP的异常均与GDM的发病有关[3-5,20]。本研究比较了GDM患者与NGT孕妇孕早期的临床资料,结果显示GDM患者的年龄、孕前BMI、孕早期增重及Hb、RBC、WBC、TG、TC、GGT、ALP均与NGT孕妇存在显著性差异,与已有研究结果一致。本研究进一步在Logistic回归模型中分析GDM的影响因素可知,IL-33、IL-33/sST2、Hb、TC均是发生GDM的影响因素;经ROC曲线验证,单一使用IL-33和IL-33/sST2检测均对GDM的发病具有预测价值,但预测效能较低,曲线下面积均不足0.70;根据Logistic回归分析得到回归方程,将该方程作为检测IL-33、IL-33/sST2、Hb、TC的联合指标,其对GDM的发病具有预测价值,且预测效能理想,曲线下面积接近0.85,灵敏度和特异度均超过80%。
综上所述,孕早期母体血清IL-33、sST2水平及其比值的变化与GDM的发病有关。GDM患者孕早期血清IL-33和sST2水平增加、IL-33/sST2比值降低,结合IL-33与胰岛素抵抗程度呈负相关,sST2与胰岛素抵抗程度呈正相关的相关性结果分析,GDM孕早期血清IL-33水平增高是自我保护的代偿机制,代偿性分泌不足会使其代偿妊娠过程中胰岛素抵抗的功能减弱,进而造成GDM的发生。同时,本研究还初步探索了GDM的预测模型,联合使用IL-33、IL-33/sST2、Hb、TC指标,根据回归方程对GDM进行预测,具有较好的预测效能和价值。
