组织选择性雌激素复合物对子宫平滑肌瘤细胞增值及凋亡的影响
2022-09-16王晓林王新颖吕淑兰
薛 雪,王晓林,王新颖,吕淑兰
(西安交通大学第一附属医院妇产科,陕西 西安 710061)
绝经的机制在于卵巢内分泌功能衰竭、性激素分泌缺乏、排卵停止,进而子宫内膜停止增殖、分泌及周期性月经来潮,性激素水平的下降可引发绝经相关症状甚至疾病,其严重影响了患者的生活与工作[1]。目前,绝经激素治疗(menopausal hormone therapy,MHT)是“窗口期”预防心血管疾病、缓解绝经相关症状、防治骨质疏松及阿尔兹海默病等最有效的方法[2]。但目前广泛应用的MHT方案尚不完善,在药物安全性方面仍存争议,使得受益人群局限。研究发现MHT中的孕激素可能是诸多副反应的主要刺激因素。将孕激素成份替换为选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs)是MHT的最新策略,雌激素与SERMs所共同组成的组织选择性雌激素复合物(tissue selective estrogen complex,TSEC)使药物在有效的前提下进一步提高了安全性[3]。值得注意的是,子宫平滑肌瘤是女性最为常见的生殖系统良性肿瘤,有高达70%的发病率[4],其中48.6%的女性在子宫平滑肌瘤伴随下进入绝经期[5]。在子宫平滑肌瘤如此高发病率的情况下,对其顾虑将影响较多人群的MHT决策。迄今为止,TSEC对子宫平滑肌瘤的影响尚未见研究报道。本实验通过研究TSEC对子宫平滑肌瘤细胞增殖及凋亡能力的影响,探讨TSEC作为MHT的新方案,对围绝经期子宫平滑肌瘤患者的安全性和有效性,为TSEC在MHT中的应用提供新的依据。
1 材料与方法
选取2021年6月至8月在西安交通大学第一附属医院因子宫平滑肌瘤行核除术患者,对手术切除的子宫平滑肌瘤组织通过酶消化法进行子宫平滑肌瘤细胞的原代培养。本研究通过西安交通大学第一附属医院伦理委员会批准(2021-14)。
1.1 材料和试剂
细胞培养所用的F12培养基、胎牛血清均采用Gibco相应产品,二甲基亚砜(dimethylsulfoxide,DMSO)和四甲基偶氮唑盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]试剂使用Sigma相应产品,抗雌激素受体-α(antiestrogen receptor-α,ER-α)兔抗人、抗雌激素受体-β(antiestrogen receptor-β,ER-β)兔抗人抗体、抗α-肌动蛋白(α-Actin)兔抗人、辣根过氧化物酶(horseradish peroxidase,HRP)标记二抗及荧光标记二抗购自Abcam。
1.2 分组情况
实验共设立4个组:雌孕激素连续联合组(10-7M 17-β雌二醇+3.3×10-8M安宫黄体酮,E+P组)、TSEC组(10-7M 17-β雌二醇+10-9M雷洛昔芬)、单独雌激素组(10-7M 17-β雌二醇,E组)及对照组(Control组,无药物刺激干预),观察不同组药物对子宫平滑肌瘤细胞增殖及凋亡的影响,每项实验均独立重复完成3次。
1.3 苏木素-伊红染色、免疫组织化学及免疫荧光染色
取经手术切除的新鲜子宫平滑肌瘤组织,经4%多聚甲醛固定,脱水后制蜡块,连续切片,制成厚度为5μm的组织玻片,依次经过脱蜡、水化处理后进行后续染色:对于苏木素-伊红(hematoxylin-eosin,HE)染色,依次加入伊红、苏木素进行染色;对于免疫组织化学染色及免疫荧光染色,组织玻片经3%H2O2处理、血清封闭孵育,相应一抗孵育(抗体稀释比例为1:100)、洗片、依据实验目的使用HRP标记/荧光标记的二抗孵育,洗片后以二氨基联苯胺(diaminobenzidine,DAB)显色及苏木素细胞核染色,或经4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)细胞核染色,封片后放置于正置显微镜或荧光显微镜下进行拍照存储、分析。
1.4 原代培养方法
子宫平滑肌瘤细胞原代培养所使用的组织与免疫组化来源相同,将获取的标本组织块放置于含100IU/mL双抗的磷酸盐缓冲液(phosphate buffered saline,PBS)中浸泡、清洗,使用眼科手术器械对组织进行预处理,剔除标本中的脂肪组织、血凝块及坏死组织。配置含20μL/mL脱氧核糖核酸酶Ⅰ(deoxyribonuclease I,DNase I)的Ⅱ型胶原酶溶液(1mg/mL),将预处理后的组织块放置入该溶液内,同时将组织块剪碎至1mm3左右,将溶液及组织块一并置入37℃恒温箱中消化4h,以稀释方法终止消化,将溶液倒入70μm筛网过滤,以800r/min离心所获溶液5min,此时取离心后沉淀物,加入培养液重新混悬细胞,并将其接种于5cm培养皿中,置入含5%CO2、37℃的细胞培养箱内常规培养,接种6~8h后观察细胞,在观察到有较多细胞贴壁现象出现后,随即进行首次细胞换液,以弃去未贴壁细胞,随后按常规方法进行细胞的培养、传代。
1.5 MTT实验
收集对数期生长的细胞,按(5×10)/孔接种至96孔板内,根据分组情况加入相应药物处理,培养24h、48h,于检测孔内加入50μL MTT溶液(5mg/mL)后,将孔板继续培养4h,弃去孔板内上清液后,于相应检测孔中加入DMSO溶液(150μL),将孔板充分摇匀,转运至酶联免疫检测仪,用490nm波长检测相应研究孔内液体的吸光度值(optical density,OD)。
1.6 细胞周期分布实验
收集细胞并使用70%乙醇固定,PBS洗涤,随后用染色缓冲液洗涤,将1×106个细胞重新悬浮在0.5mL的碘化丙啶(含核糖核酸酶,PI/RNase)染色缓冲液中,并将细胞在室温下避光孵育15min。使用FACSCantoⅡ流式细胞仪(BD biosciences)分析细胞周期的分布。
1.7 细胞凋亡实验
使用PE Annexin V Apoptosis Detection Kit Ⅰ检测试剂盒(BD biosciences)进行细胞凋亡检测,收集细胞并用预冷的PBS缓冲液洗涤2次,向每个样品中加入5μL PE-Annexin V溶液和5μL 7-氨基放线菌素D(7-AAD)溶液,将细胞在室温下孵育15min,使用FACSCantoⅡ流式细胞仪进行检测。
1.8 免疫印迹法实验
收集不同分组的细胞,使用放射免疫沉淀法裂解缓冲液(radioimmunoprecipitation assay,RIPA)离心提取蛋白,经制胶、相应细胞提取蛋白上样、电泳、湿式转膜,加入需检测蛋白的相应一抗,4℃孵育12h,清洗后加入相应二抗孵育,清洗后发光拍照、储存结果,测量PCNA/β-Actin、Bcl-2/β-Actin相对蛋白表达量。α-Actin为平滑肌细胞的标志物之一;β-Actin为人体细胞内恒定表达的一种蛋白,其表达量在细胞中稳定,因此免疫印迹法实验是检测目标蛋白与β-Actin的比值来确定目标蛋白的变化趋势。
1.9 统计学方法

2 结果
2.1 子宫平滑肌瘤细胞的原代培养及鉴定
获取手术切除的子宫平滑肌瘤组织,进行HE染色及α-Actin染色、ER染色,确定该组织可用于原代培养,见图1a~图1c;其中HE染色中苏木素将细胞核染色为紫色,伊红将胞浆染色为红色,进而可以通过观察细胞胞浆及细胞核的形态来确定细胞类型,此处HE染色的目的是明确原代培养的组织来源确定为子宫肌瘤组织,而非结缔组织、脂肪或其他组织,见图1a;免疫组化实验原理为通过一抗、二抗及DAB染色将目标蛋白标记,如出现棕色染色,则提示该区域有目标蛋白的表达;α-Actin、ER均为子宫平滑肌瘤的标记蛋白,免疫组化染色结果证实提示培养所得细胞表达这两种标记蛋白,结合细胞形态可以证实原代培养所得细胞即为子宫平滑肌瘤细胞,见图1b。使用酶消化法提取子宫平滑肌瘤原代细胞,经首次换液3d后,可见所提取细胞已完全伸展,细胞形态上呈长梭形,继续培养7~8d时,原代细胞生长活跃,呈平行排列,大小一致,细胞胞浆丰富;于光镜下观察,可见细胞轮廓清楚,细胞核清晰,多呈杆状或类圆形,见图1d。行细胞免疫组化染色,α-Actin、ER均为阳性,见图1e、图1f。行细胞免疫荧光检测,免疫荧光根据使用的二抗类型不同,阳性结果可呈现出绿色荧光或红色荧光,DAPI染色细胞核呈蓝色,因此如细胞内可见红色/绿色荧光,则提示目标蛋白在该细胞中表达,此处免疫荧光检测目的为进一步证实原代培养所得细胞表达子宫平滑肌瘤细胞的标记蛋白,可见α-Actin(+)、ER-α(+)及ER-β(+),与组织染色结果一致,原代培养成功,见图1g~图1i。
2.2 TSEC对子宫平滑肌瘤细胞增殖的影响
应用MTT实验检测TSEC组、E+P组、E组和对照组的细胞分别于24h、48h的OD值。在24h时间点,TSEC组与对照组OD值比较差异无统计学意义(t=-1.984,P=0.071),而E+P组(t=-30.113,P<0.001)、E组(t=-16.148,P<0.001)分别与对照组比较差异均有统计学意义;在48h时间点,TSEC组与对照组OD值比较差异无统计学意义(t=-1.997,P=0.069),而E+P组(t=-23.553,P<0.001)、E组(t=-16.432,P<0.001)分别与对照组比较差异均有统计学意义,见表1、图2a。
常规培养子宫平滑肌瘤原代细胞,应用免疫印迹法技术检测各组细胞中PCNA蛋白表达情况,结果显示,对照组细胞中PCNA蛋白表达水平低于E+P组(1.04±0.03 vs.1.23±0.04,t=-23.267,P<0.001),对照组同样低于E组(1.04±0.03 vs.1.15±0.01,t=-13.472,P<0.001),差异均有统计学意义;对照组细胞中PCNA蛋白表达水平与TSEC组比较(1.04±0.03 vs.1.02±0.05,t=-2.449,P=0.627),差异无统计学意义,见图2b。
应用流式细胞仪检测TSEC组、E+P组、E组及对照组的细胞周期变化,结果显示,与对照组相比,E+P组、E组细胞G1/S时相转换减弱,而TSEC组与对照组差异无统计学意义(E+P组 vs.对照组,t=-17.642,P<0.001;E组 vs.对照组,t=-21.367,P<0.001;TSEC组 vs.对照组,t=-2.039,P=0.097,见图2c。
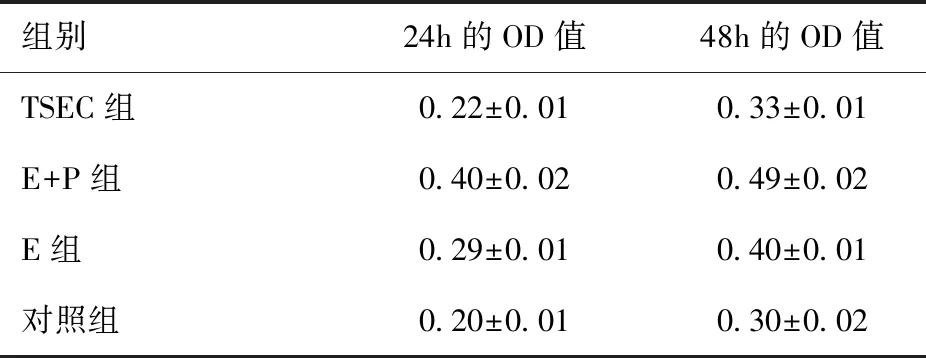
表1 MTT实验结果Table 1 MTT experiment results
2.3 TSEC对子宫平滑肌瘤细胞凋亡能力的影响
常规培养子宫平滑肌瘤原代细胞,使用免疫印迹法技术检测各组干预后细胞中Bcl-2蛋白表达情况,结果显示,对照组细胞中Bcl-2蛋白表达水平低于E+P组(0.63±0.04 vs.1.17±0.01,t=-66.136,P<0.001),对照组同样低于E组(0.63±0.04 vs.1.04±0.02,t=-50.215,P<0.001),差异均有统计学意义;而对照组细胞中Bcl-2蛋白表达水平与TSEC组比较(0.63±0.04 vs.0.62±0.01,t=1.225,P=0.289),差异无统计学意义,见图3a、图3b。
应用流式细胞仪检测TSEC组、E+P组、E组及对照组的细胞凋亡情况,结果显示,与对照组相比,E+P组、E组细胞凋亡减少,而TSEC组与对照组差异无统计学意义(E+P组 vs.对照组,t=23.097,P<0.001;E组 vs.对照组,t=20.972,P<0.001;TSEC组 vs.对照组,t=0.202,P=0.850),见图3c。
3 讨论
3.1 TSEC对子宫平滑肌瘤影响的研究现状
将SERMs与雌激素配伍,可能对MHT的有效性和安全性都更加有益[6]。妇女健康研究组织(Women′s Health Initiative,WHI)于2011年在MHT指南中提出了TSEC方案,与传统的由雌孕激素形成的MHT方案相比较,TSEC将孕激素成份替换为SERMs,避免了孕激素可能带来乳腺癌发病增高的风险,减轻了治疗过程中患者对MHT副作用的恐慌,还保持了雌激素的有益作用,弥补了SERMs类药物因雌激素撤退而导致的潮热等副反应,提高了机体耐受性。子宫平滑肌瘤为性激素依赖性肿瘤,长期的雌激素暴露将导致子宫平滑肌瘤体积增加。MHT为外源性添加雌孕激素,因此对患有子宫平滑肌瘤的围绝经期妇女可能存在导致肌瘤体积增长的风险。研究表明,SERMs可通过调节子宫平滑肌瘤细胞的增殖及凋亡,抑制肌瘤的生长,甚至减小肌瘤的体积[7]。而SERMs与雌激素配伍组成TSEC作为MHT的策略,对围绝经期女性子宫平滑肌瘤的影响尚未见相关报道。
3.2 TSEC对子宫平滑肌瘤细胞增殖影响的分析
本研究显示,TSEC组对子宫平滑肌瘤细胞增殖能力无明显影响,而E+P组、E组则促进了子宫平滑肌瘤细胞的增殖。TSEC对子宫平滑肌瘤细胞增殖能力无明显影响的机制可能与该用药方案中SERMs的抗雌激素活性相关。SERMs存在组织特异性,在骨骼血管系统中表现为雌激素受体激动剂,而在子宫、乳房中表现为雌激素受体拮抗剂[8]。作为二代SERMs的雷洛昔芬在体内实验中均显示出对子宫平滑肌瘤细胞的一致抑制作用[9],Chung等[10]的体外研究提示,雷洛昔芬显示出比米非司酮更显著的肌瘤细胞活性和增殖抑制能力。而新一代的SERMs,如巴多昔芬[11]、欧派米芬[12]同样可能对肌瘤细胞具有拮抗性活动,但仍然需要大规模的随机临床试验来确定其安全性。TSEC方案是在SERMs的基础上同时添加雌激素,人类雌激素受体包含α和β两种不同亚型,分别由两组独立的基因编码,其中雌激素受体α为高亲和力受体,但容量低;相反,雌激素受体β为低亲和力、高容量,二者的转录、激活与抑制分别由不同的信号通路介导。子宫平滑肌瘤的雌激素受体比例失调是其发病机制之一。在子宫平滑肌瘤组织中,ER-α和ER-β的信使RNA(messenger RNA,mRNA)均呈高表达状态,但ER-α的蛋白表达并未升高,这可能是由于转录后修饰作用使得ER-α的雌二醇结合位点缺失,或者ER-α的mRNA错误翻译,肌瘤组织中ER-β的表达升高2~3倍,因此α和β受体基因的差异表达可能在肌瘤组织的生长中起到了关键作用。有文献报道,SERMs对ER-α的抑制作用较强,而对ER-β只有较弱的抑制作用[13]。TSEC方案中的雌激素可能通过与ER-β相互作用,诱导肌瘤细胞的生长,从而拮抗了SERMs的抗增殖效应。本研究中TSEC组表现出对子宫平滑肌瘤细胞无明显促增殖的作用。
本研究中可见E+P组细胞增殖活跃,其原因除了雌激素促进细胞的生长作用外,孕激素的作用也占有重要地位。子宫平滑肌瘤的生长与孕激素水平密切相关,其机制为孕激素具有促进肌瘤细胞的有丝分裂及生长的功能。Moro等[14]的临床研究表明,应用雌激素+孕激素存在导致子宫平滑肌瘤体积增大的风险;本研究结果与其结论一致,雌孕激素连续联合对子宫平滑肌瘤有促进作用,而据本研究中TSEC组与对照组的MTT及细胞周期测定等实验结果显示,TSEC对肌瘤细胞的增殖无明显影响,提示TSEC对肌瘤患者可能具有更好的安全性。
3.3 TSEC对子宫平滑肌瘤细胞凋亡影响的分析
Bcl-2蛋白属于凋亡抑制基因,相应蛋白的表达增高提示细胞凋亡能力的减弱[15]。本研究显示,TSEC组Bcl-2蛋白表达水平与对照组相比无明显变化,且TSEC组Bcl-2蛋白表达明显低于E+P组及E组;提示TSEC组对子宫平滑肌瘤细胞凋亡能力无明显抑制作用,这可能同样与TSEC中SERMs的作用相关。Jin等[16]的体外实验表明,SERMs对子宫平滑肌瘤细胞促凋亡的调节作用为浓度依赖性,低浓度的SERMs可抑制Bcl-2蛋白的表达。本研究中免疫印迹法及凋亡实验结果均提示,E+P组、E组对肌瘤细胞具有抑制凋亡作用,对子宫平滑肌瘤具有潜在的促进风险。
综上,本研究结果显示,TSEC对子宫平滑肌瘤细胞的增殖及凋亡无明显影响,TSEC较E+P等MHT方案在对子宫平滑肌瘤细胞的影响中可能具有更好的安全性。在未来的研究中将通过改变TSEC中两种药物的浓度及比例,在安全有效治疗绝经综合征的同时,争取达到治疗子宫平滑肌瘤的目的。
