水酶法提取花生油过程中乳状液性质研究进展
2022-09-15赵宇辉陈复生高玉航
赵宇辉 陈复生,2 刘 晨,3 高玉航,4
(河南工业大学粮油食品学院,河南 郑州 450001)
花生又名“落花生”“长生果”,含油量高达50%左右,是中国重要的油料作物之一。中国花生用于榨油的比例要高于其他国家[1]。花生油风味清香、色泽明亮,同时易于消化,是深受消费者喜爱的优质油脂。
花生油的传统提取方法有压榨法和浸出法。压榨法是利用机械压力将油脂从油料中分离出来,具有工艺简单,提取出的油风味纯正等特点,但机械强度大,提油率不高,且会使蛋白变性。浸出法是使用有机溶剂萃取提油,提油率可高达95%以上,但工艺中正己烷等有机溶剂易燃易爆,加工过程中会存在一定的危险,且花生蛋白在湿粕高温脱溶中变性严重[2]。水酶法是一种新型的提油方法,其条件安全温和,以水作为溶剂,且用酶作为辅助提高了油脂的提取率,在提取油脂的过程中也能高效回收油料中其他价值组分。研究拟对水酶法提取花生油过程中乳状液形成的相关机理和物理、化学、生物等环境因素对其稳定性的影响进行综述,并对水酶法工业化应用中的破乳方法进行展望,旨在为学者们在水酶法提取花生油过程中乳状液破乳阶段的研究提供总结与参考。
1 水酶法
1.1 水酶法原理
花生油脂以两种存在形式,一种是以脂滴和脂肪颗粒的形式存在于花生细胞中,一种是与其他大分子结合,如与碳水化合物结合形成脂多糖,与蛋白质结合形成脂蛋白。水酶法能同时提取花生油和蛋白质,该法以机械破碎和酶解为基础,通过使用能降解油料细胞中的脂蛋白、脂多糖、细胞壁等大分子复合物的酶来处理油料,达到破坏其组织结构、水解大分子复合体,从而使油脂和蛋白质充分释放,并利用各组分对油水的亲和力不同以及油水密度差不同将油和非油成分分离开,使油游离出来[3]。
1.2 水酶法工艺
20世纪50年代,Sugarman等[4-5]用水作溶剂提取和分离油籽中蛋白和油脂,引起了国内外众多学者的关注。但由于水剂法提油率不高,得到的油脂也有蛋白残留,限制了工业化生产。20世纪70年代,Lanzani等[6]利用酶提取植物蛋白和油脂,为水酶法工业化奠定了基础。
Zhang等[7]将花生种子在190 ℃、料水比1∶5 (g/mL)、酶浓度2%条件下烘烤20 min后,游离油得率为78.6%,水解蛋白得率为80.1%。用冻融法对残留乳状液进行破乳,总游离油得率提高至86%~90%。李鹏飞等[8]提出了传统和新型水酶法工艺的技术路线图(图1),传统水酶法的花生先经粉碎,碱提后加酶辅助提取再进行离心。而此新型水酶法在加酶后碱提,经离心得到含油(77.89±1.24)%乳状液,再使用酶法破乳离心。
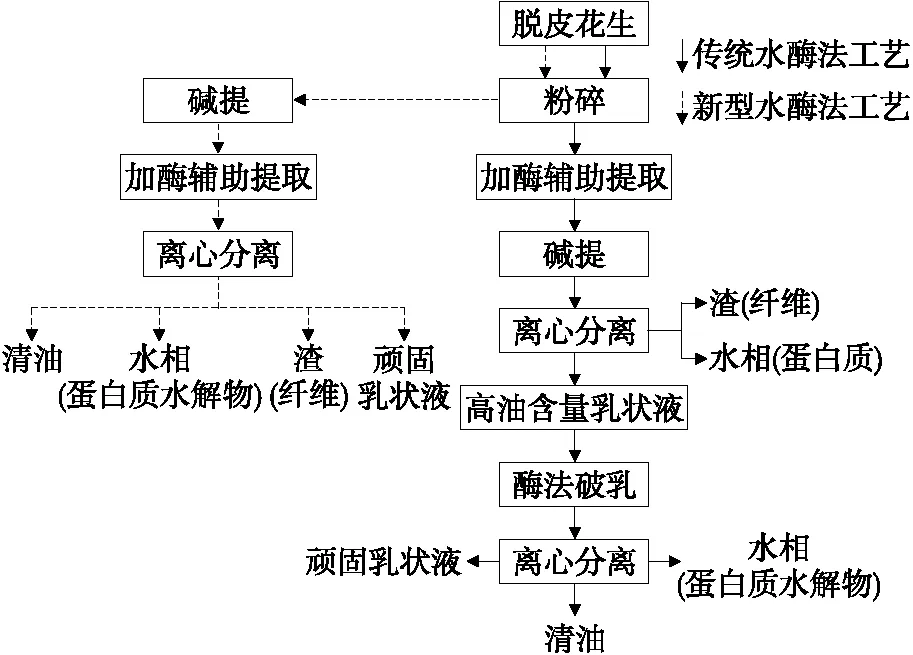
图1 传统水酶法和新型水酶法的工艺流程Figure 1 The technological process of traditional and new aqueous enzymatic methods
新型水酶法(投料500 kg)的油提取率可以达到89.4%以上。此法不但可以提高提油率,又降低了酶的用量,并保护了大部分花生蛋白不被破坏。
2 乳状液的组成与稳定机制
花生乳状液是混合体系,粒径为100 nm~10 μm[9]。王瑛瑶等[10]用冲淡法测定水酶法花生乳状液的类型,发现与油相比,水更容易与乳状液接触,所以得出该乳状液是O/W型乳状液。花生水酶法乳状液成分见表2,其大部分成分是水和油脂还有少部分的蛋白,其中蛋白质和淀粉、纤维等物质形成静电排斥和空间位阻,使得油滴之间聚集有了一定困难,保持了乳状液稳定性。
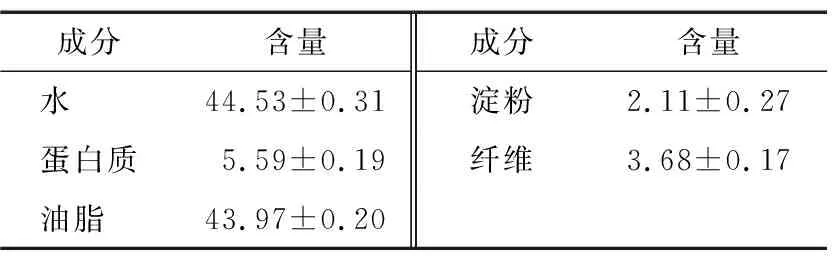
表2 花生乳状液的主要成分Table 2 The main components of peanut emulsion g/100 g
蛋白质是油水两亲性物质,在油水界面会自发形成一层界面蛋白膜。这种吸附过程有两种熵增驱动力:蛋白质分子去折叠过程和蛋白质疏水区脱水过程[11]。Freer等[12]认为蛋白质吸附到界面上有3个阶段:① 自然状态构象下的初始吸附;② 进一步吸附和界面稳定后,蛋白质部分展开,暴露出疏水基团;③ 蛋白质继续展开,形成多层结构的网状或玻璃状状态。蛋白质在油水界面产生的吸附是水酶法破乳提取清油过程中的一个难题。蛋白质的柔性和聚集性导致在油/水界面吸附时形成黏弹性多层膜。这种界面蛋白膜同时具有一定的静电排斥和空间位阻,维持了花生乳状液的稳定性。胡存书等[13]研究了花生乳状液界面吸附蛋白的提取工艺,并对其乳化性和溶解性进行研究,与大豆、菜籽蛋白相比,得到的花生吸附蛋白乳化性最好,溶解性最差。说明花生蛋白更容易与水和油形成稳定乳状液,对破乳工艺有更高的要求。
乳状液的界面膜组成与性质和液滴大小与分布是影响界面膜的主要因素。根据stockes定理,乳状液液滴越小、沉淀速度越慢且粒径分布范围越窄,乳状液越稳定[14]。张杏辉等[15]对花生蛋白脂肪乳状液中脂肪球油滴的大小分布进行了测定。花生脂肪球油滴如果未经过匀浆处理,油滴直径达到28 μm,经过匀浆后,油滴直径分布在1~10 μm,随着匀浆时间的增加,脂肪球油滴直径可分散至0.3~9.0 μm。所以花生乳状液经过匀浆后,粒径变小,乳状液稳定性增加。朱凯艳等[16]利用小型中药粉碎机在粉碎11次(8 s/次)后将花生体积平均粒径减小到28 μm,继续粉碎花生乳状液发生严重乳化现象导致乳状液稳定性增加。这可能是当粒径降低到极限后继续被粉碎,由于蛋白与油过度分散,接触面积增加,加入到水相再混合蛋白质分子,在油水界面的分子层越致密导致的结果。因此破乳阶段需要增大乳状液的粒径,使油滴聚集且蛋白质分子层减少从而降低乳状液的稳定性。界面蛋白膜具有一定的界面张力,Zhang等[17]研究发现,界面蛋白张力为花生分离蛋白>花生乳状液的界面蛋白>经过冻融处理后剩余乳状液蛋白,说明经过冻融处理能改变乳状液稳定机制,为破乳奠定了理论基础。刘向军等[18]发现花生乳状液界面蛋白在水相和花生油模拟体系中的乳化稳定性显著优于花生分离蛋白和非界面蛋白,可能是由于界面蛋白中含有分子量较大的组分和分子量较小的花生油体蛋白,其二硫键含量、表面疏水性均高于花生分离蛋白和非界面蛋白。内源荧光光谱分析表明:界面蛋白和非界面蛋白分子展开程度高于花生分离蛋白。这种稳定性使得花生乳状液难以破乳,限制了水酶法的工业化。Niu等[19]用核磁共振波谱检测了水酶法花生乳状液中5种磷脂。其中,在油体稳定性中起重要作用的磷脂酰胆碱最为丰富。因此除了蛋白,磷脂也会对乳状液起到稳定作用。
3 影响乳状液稳定性的因素
3.1 物理因素
3.1.1 温度 乳状液温度越高,油滴布朗运动加剧,粒子间相互作用减弱,分子流动阻力降低,黏度相应变低,液滴间聚集增大,从而一定程度上降低了乳状液稳定性。在冷冻过程中,乳状液中出现油相结晶,晶体刺入水相,相邻油滴之间脂肪晶体结晶,会刺穿界面蛋白膜,降低乳状液稳定性从而使得油滴聚集[20]。Brygida等[21]研究发现,未加热蛋白形成的乳状液稳定性较差仅有42.4%,而预热温度提高到90 ℃可使乳状液稳定性提高到50.4%;经过预热的油可以得到更稳定的乳状液;随着温度从60 ℃升至95 ℃,乳状液的稳定性由52.2%下降到48.2%。这可能是因为较高温度下,更多的蛋白质会散布在乳液滴界面上,因此乳液的粒径增大。刘晨等[22]研究发现,90 ℃烘烤得到的水酶法花生含油乳状层油脂的粒径显著大于60 ℃烘烤条件下的,且由许多小油滴汇聚成大的油滴,形状呈不规则状。90 ℃烘烤得到的水酶法花生含油乳状层较60 ℃烘烤预处理的更易于破乳。Lin等[23]证明了冻融作用诱导破乳的渐进过程,并认为水转冰的体积膨胀和油水界面张力被确定为破乳的主要驱动力,且最佳的冷冻方法为低温或干冰中冷冻。王瑛瑶等[10]用水酶法提取花生蛋白和油脂过程中产生的乳状液在90 ℃高温下加热10 min,以3 000 r/min离心20 min,破乳率仅为32.7%。同时对乳状液进行融冻破乳处理,破乳率高达 91.6%。由此推测温度对花生乳状液影响较大,其中冷冻比高温影响更大。因此在水酶法工艺上,采用烘烤升温预处理和冻融破乳是一个较好的选择。
3.1.2 微波和高压 微波辐射形成高频变化的电磁场,使分子旋转到高速,破坏油水界面膜等电层结构,扰乱其电荷分布。此外分子自由地上下运动,碰撞和聚结,使油和水分离[24]。Liu等[25]将微波破乳方法与加热、冻融等常规破乳方法进行比较,与加热破乳相比,盐助微波破乳获得了更高的游离油得率。微波破乳法得油率与冻融法相似,且时间较短。在最佳破乳条件下,CaCl2辅助微波破乳时间仅为2 min,油得率可达92.3%。Deng等[26]研究发现,短波红外辐射破坏了细胞微结构和油体膜,有利于油的提取。与不加短波红外的对照组相比,出油率显著提高了8.74%,说明通过微波等物理手段可以辅助水酶法提取花生油的工艺,增大水酶法的得油率。
二氧化碳对非极性物质有强亲和力,溶解在油相中使油/水乳状液的油滴膨胀,导致密度降低。油相和水相之间的密度差异增强了破乳。二氧化碳溶于水中形成碳酸。作为电解质,碳酸破坏了水包油乳状液的电荷平衡,油水界面的表面活性剂层变得不稳定[27]。李杨等[28]确定了水酶法蒸汽破乳的最优工艺条件为蒸汽压力18.2 MPa,温度115 ℃,蒸汽处理时间21 s,此时破乳率为93.49%,总油提取率为89.54%,且高压蒸汽破乳效果明显优于水浴加热破乳。高压蒸汽破乳虽然破乳率高,但所需温度过高,成本大,不利于水酶法破乳的工业化生产。
3.2 化学因素
3.2.1 离子强度 蛋白质形成的界面膜通常相对较薄且带电荷,因此防止蛋白质稳定乳液中液滴絮凝的主要机制是静电排斥而不是空间排斥。花生乳状液对离子强度的影响特别敏感[29]。水酶法乳状液液滴表面存在电位差和双电层,当油滴间互相靠近时,油滴表面上的双电层相互重叠,静电排斥力使油滴分开,从而乳状液保持稳定。当体系中pH接近蛋白质等电点时,电荷之间的排斥作用力迅速降低,油滴迅速聚集,乳状液稳定性降低[30]。Zhou等[31]将CaCl2和Alcalase 2.4 L联合用于花生水酶法工艺,作为一种破乳方法。粒径和ζ-电位测试表明,CaCl2使乳状液的稳定性急剧下降。Zhang等[32]在盐助微波破乳条件下,破乳时间仅为5 min,得油率为80%~90%,且CaCl2的破乳效率优于KCl和NaCl。无机盐作为一种强电解质,在乳状液中可以快速解离成自由移动的离子;其能吸收微波,在油体表面形成一个温度高于环境温度的“热点”加速反应。此外,无机盐降低了油水界面双电子层的厚度,增强了相分离能力。何秋实等[33]针对水酶法乳状液难以破除的问题,选取NaCl浓度、盐反应时间、盐反应温度3个因素为自变量,以乳状液得油率为响应值,通过SAS 9.2进行响应面试验设计,确定了最佳破乳率工艺条件为盐浓度5.6%,盐反应温度93.5 ℃,盐反应时间16 min,破乳后得油率为87.92%,说明盐离子不但可以单独破乳而且可以与其他破乳方法联用。
3.2.2 有机溶剂 乙醇对水相有强亲和作用,这改变了水相和水膜的原有结构,改变了支撑分散相界面膜两亲表面活性组分。乙醇对亲水端有吸附作用,这种拉力改变了界面膜的稳定性,有利于油滴聚集成大液滴,逐渐浮入上层形成油相,导致花生乳状液不稳定,从而得到较高的破乳率。迟延娜等[34]在冻融条件下利用乙醇辅助水酶法对花生乳状液进行破乳,使破乳率由81.50%提高到90.00%。因此,醇类可以对破乳起辅助作用,对提升出油率有重要意义。
3.3 生物因素
Niu等[35]使用木瓜蛋白酶在55 ℃,酶水解比1∶3 (g/mL),酶浓度1 400 U/g,水解时间3 h,与水解前的乳状液相比,酶水解后水相氨基酸含量较高,花生乳状液黏度较低,乳状液粒径明显变大,说明木瓜蛋白酶可以降解花生乳状液内的蛋白质,并将其溶解在水中。油体的外侧失去了由膜蛋白提供的静电排斥和空间位阻的保护,从而导致乳状液系统的黏度和分子空间位阻降低。Zhang等[36]发现花生乳状液的酶解失稳现象Mi-fong®2709破乳效果优于Protex 6L,可能是蛋白酶水解界面蛋白,从而破坏强黏弹性界面膜,并使得油滴聚结。Li等[37]研究了物理(加热、冻融)、盐(CaCl2和NaCl)和酶处理(Protex 6L、Protex 7L、Protex 50FP、Alcalase 2.4L、木瓜蛋白酶、磷脂酶和淀粉酶)对花生乳状液中游离提油率的影响,与盐和物理方法相比,蛋白酶的破乳效果更好。Chen等[38]研究发现花生中存在一种双链天冬氨酸蛋白酶,对花生蛋白有着较高亲和力,水解的最佳pH为4.0,温度为60 ℃,天冬氨酸蛋白酶不仅水解乳状液内源蛋白,而且水解乳状液外源蛋白,具有一定的破乳效果。因此探究不同酶对破乳效果的影响,对水酶法的工业化生产有重大意义。
4 展望
随着固定化酶技术的不断成熟,酶制剂的种类不断增多,水酶法具有更加广泛的开发和应用前景。通过对花生乳状液性质的研究,从影响乳状液稳定性机理出发,找到最合适的破乳方法,从而提高提油率。影响乳状液稳定性的物理、化学、生物等因素较多,但物理方法所需能源较多、化学方法需要引入有机溶剂,工艺上存在安全隐患;生物酶法所需酶制剂成本较高,亟需一种绿色环保高效且成本低的破乳方法。比如用花生自身的脂肪酸破乳对提高水酶法提取花生油工艺上的出油率以及降低成本有重大研究前景,对乳状液体系的理论研究和应用开发有着重要意义,学者们需要进一步研究乳状液的稳定机制,探讨其在工业中的应用前景。
