末端环化疏棉状嗜热丝孢菌脂肪酶的稳定性
2022-09-15武霞霞娄海伟方惠敏
宋 文 武霞霞 娄海伟 方惠敏
(1. 河南工业大学食品粮油学院,河南 郑州 450001;2. 郑州大学生命科学学院,河南 郑州 450001)
脂肪酶(Lipase,EC3.1.1.3)广泛存在于各种动植物与微生物中[1],能够催化甘油酯水解为甘油和脂肪酸。作为重要的工业用酶,脂肪酶已被广泛应用于食品、油酯化工等传统工业领域[2-3]。在乳制品加工过程中添加脂肪酶,可使奶酪中的酸、酯类(十四酸乙酯除外)挥发性风味物质,如辛酸、己酸、癸酸等含量明显增加[4];脂肪酶和双乙酰酒石酸单双甘油酯可改善面团持气稳定性,显著增大面包比容和挺立度[5]。
疏棉状嗜热丝孢菌脂肪酶(Thermomyceslanuginosuslipase,TLL)因催化活性高、热稳定性好、pH值范围宽,是一种良好的食品和工业催化用酶。但是,由于工业加工过程中条件不稳和或加工时间过长,仍需降低生产成本、提高催化活性、延长半衰期及抵抗蛋白酶解等[6]。
脂肪酶属于α/β水解酶家族。不同起源的脂肪酶序列相似度不高,但其折叠方式和活性中心却非常相似,均具有典型的α/β水解酶折叠结构,包含8条平行排列的β折叠片,其中β2折叠片与其余7条折叠片反向平行,β3~β8折叠片通过分布在折叠片中心两侧的α螺旋相连[7]。脂肪酶活性部位被一个称为“盖子”螺旋片段遮挡,当有底物存在时,酶的构象发生变化,“盖子”打开,具有活性的疏水部分被暴露出来[8]。脂肪酶的两个末端并不直接参与催化作用,尤其是C-末端是一段无规则卷曲结构,且两个末端空间距离较近,如果通过Linker将脂肪酶的N-末端与C-末端连接,理论上应该不会影响其催化活性,但却有可能增加其稳定性和蛋白酶耐受性。
将线性蛋白(或肽)的C-端和N-端通过酰胺键进行首尾环合形成环状分子称为蛋白质环化。自然界中存在天然环化结构的环肽类物质,与线性蛋白相比,末端环化能够降低蛋白折叠域与非折叠域的构象熵,因此可能具有较高的热稳定性和较稳的结构,但其功能和活性往往不受影响[9]。
Butelase 1发现于常见药用植物Clitoriaternatea(也称为蝴蝶豌豆)的豆荚中,它特异识别目标蛋白C末端三肽氨基酸序列Asn / Asp(Asx)-His-Val,以KALVINHV作为模型肽评估其与XIGGIR和LXGGIR的连接效率,发现Butelase 1能够有效环化来自各种生物的非天然肽,包括植物CyclotidekalataB1(kB1)、SFTI、芋螺毒素,昆虫抗菌肽Thanatin和人唾液抗菌肽Histatin[10]。Butelase1催化动力学非常高,催化效率高达542 000 L/(mol·s),是目前已知效率最高的蛋白连接(水解)酶[11];Butelase 1也可以环化大于200个氨基酸残基的重组蛋白,已报道的有白介素-1受体拮抗剂(IL1-Ra)、绿色荧光蛋白(GFP)、人生长激素(hGH)等[12]。
研究拟在梳棉状嗜热丝孢菌脂肪酶(TLL)的C-端和N-端分别添加Butelase 1连接酶识别序列和柔性接头,利用Butelase 1连接酶对TLL进行末端环化,分析线性和环化酶蛋白的基本酶学性质、环化提升酶蛋白热稳定性,旨在为提升工业酶的加工及应用范围提供依据。
1 材料与方法
1.1 材料
表达载体pCold I、大肠杆菌TG1、BL21(DE3):实验室保存;
限制性内切酶:宝生物工程(大连)有限公司;
DNA marker、2×Taq Mix Master:苏州近岸蛋白质科技股份有限公司;
DNA同源重组连接酶:南京诺唯赞生物科技股份有限公司;
HRP标记的Anti-His Tag 抗体:苏州近岸蛋白质科技股份有限公司;
无内毒素质粒大提试剂盒:上海生工生物工程有限公司;
DNA胶回收试剂盒、去内毒素DNA质粒大提试剂盒:北京康为世纪生物科技有限公司;
对硝基苯基月桂酸酯(pNPL):美国Sigma-Aldrich公司;
HisTrap FF crude:美国GE Healthcare 公司;
引物:北京金唯智生物科技有限公司。
1.2 方法
1.2.1 重组质粒构建 从GeneBank数据库中获得链霉菌来源的Butelase 1的cDNA序列(GenBank登录号KF918345),在N末端加上荧光素酶信号肽,氨基酸序列为MGVKVLFALICIAVAEA,并在C末端加上Flag标签,根据哺乳动物密码子偏爱性进行密码子优化;在优化后DNA的5’端和3’端分别添加EcoR I和NotI酶切位点,并委托上海生工生物工程有限公司进行全基因合成,获得重组质粒pUC57-butelase1,经双酶切后连接到真核表达载体pcDNA3.1(+),重组质粒命名为pcDNA-butelase。从GeneBank数据库中获取TLL的氨基酸序列(GenBank登录号ABV69591.1),在N-末端添加Butelase 1连接酶柔性接头和识别序列(GGGGS)3,并在C-末端加上His标签和识别序列NHV,按上述方法,优化和合成TLL基因,并连接到大肠杆菌表达载体pColdI中,命名为pCold-TLL。
1.2.2 重组rButelase 1和rTLL的表达与纯化 利用无内毒素质粒大提试剂盒提取重组质粒pcDNA-butelase,同时培养HEK 293T细胞,当细胞密度为70%~80% 时进行转染。转染体系为:1 μg的pcDNA-butelase质粒和1 μL的Lipofectamine 2000分别用25 μL Opti-MEM稀释后混匀,静置10 min,加入孔板中轻轻混匀,37 ℃培养48 h,收集细胞利用冻融法裂解细胞,收集上清。
构建好的重组pCold-TLL转化大肠杆菌BL21(DE3)菌株,阳性菌接种到5 mL含氨苄抗生素的LB培养基中,37 ℃、180 r/min培养约6 h,加入终浓度为0.5 mmol/L IPTG,15 ℃、180 r/min振荡诱导表达24 h,收集菌体,利用超声破碎仪进行菌体破碎,收集上清。
将上述获得的重组Butelase 1(rButelase)和重组脂肪酶TLL(rTLL)表达上清,分别利用Flag亲和层析柱和His Trap层析柱,通过AKTA蛋白纯化系统进行纯化,纯化蛋白进行电泳、Western Blot检测和活性研究。
1.2.3 重组rTLL的环化 根据文献[12]的方法进行rTLL的环化。环化反应结束后,通过AKTA蛋白纯化系统进行纯化并透析脱盐。取少量纯化后的样品加入5倍非还原上样缓冲液处理后进行SDS-PAGE和Western Blot检测。
1.2.4 重组rTLL和cTLL的酶学活性分析 按GB/T 23535—2009执行,并根据文献[13]的方法计算酶活力。
纯化rTLL和cTLL分取500 μL,分别置于40,45,50,55,60,65,70,75 ℃水浴1 min,然后测定酶活。
1.2.5 DLS测量蛋白粒径 按GB/T 19007—2016执行。
1.2.6 重组rTLL和cTLL蛋白酶抵抗 分别取3 mg rTLL和cTLL,各分成3等份,分别加入羧肽酶Y、亮氨酸氨基肽酶、羧肽酶Y+亮氨酸氨基肽酶进行蛋白质游离末端水解,25 ℃反应30 min,随后快速置于100 ℃水浴30 min,使羧肽酶Y和亮氨酸氨基肽酶失活;冷却,采用SDS-PAGE鉴定rTLL和cTLL的蛋白酶解情况。
1.2.7 重组rTLL和cTLL热稳定性 将溶于1×PBS缓冲液的纯化酶蛋白(约2.5 μg) 分别于70 ℃孵育0,30,60,90,120,150,180 min;4 ℃、12 000 r/min离心10 min,收集上清,取少量上清用于SDS-PAGE分析降解和沉淀情况,其余样品以对硝基苯基月桂酸酯(pNPL)为底物进行酶活测定。
2 结果与分析
2.1 Butelase1在哺乳动物表达系统中的表达与纯化
由图1可知,细胞破碎上清中检测到重组Butelase 1目的蛋白,可获得单一条带的目的蛋白,Western Blot检测证实,此条带为重组Butelase 1酶。

M. 蛋白质分子质量标准 1. 293T/pcDNA-butelase细胞破碎上清 2. 亲和层析空出液 3. 亲和层析洗脱液 4. Western Blot图1 Butelase 1的表达与纯化Figure 1 Expression and purification of Butelase 1
2.2 重组TLL酶在大肠杆菌表达系统中的表达与纯化
由图2可知,诱导表达的菌体破碎后的上清液中,在40 kD左右处有大量蛋白表达,与重组TLL理论大小相同,说明目的蛋白TLL在BL21(DE3)中得到了高效的可溶性表达。由于表达的重组蛋白上含有His-Tag,因此可以通过Ni柱亲和层析进行纯化,并透析除盐,经密度扫描分析显示纯化的目的蛋白纯度可达95%左右。

M. 蛋白质分子质量标准 1. 空白菌体破碎上清 2、3. 蛋白洗脱液 4. BL21(DE3)/pCold-TLL菌体破碎上清 5~7. 纯化rTLLWestern Blot图2 rTLL酶的纯化Figure 2 Purified rTLL was detected by SDS-PAGE and Western blotting
2.3 cTLL环化结果与酶学活性分析
由图3可知,cTLL表观分子量略小于rTLL,与40 kD 的Marker基本平齐,与Hemu等[14]的研究结论相一致。
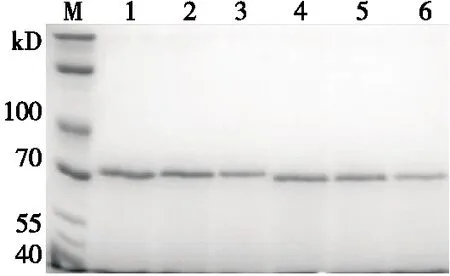
M. 蛋白质分子质量标准 1~3. rTLL 4~6. cTLL图3 SDS-PAGE分析TLL环化结果Figure 3 SDS-PAGE analysis of TLL cyclization results
由图4可知,当温度为55 ℃时,rTLL和cTLL的酶活达到最大值;当温度偏离55 ℃最适温度越多,酶活降低越多,当温度为75 ℃时,酶活仅为最大值的68.6%。

图4 脂肪酶在不同温度下的活性Figure 4 Lipase activity at different temperatures
2.4 重组TLL和cTLL蛋白酶解分析
由图5可知,蛋白酶解30 min后,rTLL蛋白的3种处理均出现不同程度的降解情况,因为羧肽酶Y酶活较弱,因此rTLL降解比例较小,羧肽酶Y和亮氨酸氨基肽酶共同作用时,rTLL蛋白几乎完全降解;而cTLL的3种处理蛋白降解均不明显。
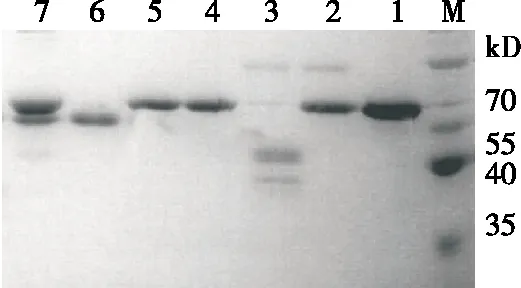
M. 蛋白质分子质量标准 1. cTLL对照 2. cTLL/羧肽酶+亮氨酸氨基肽酶 3. rTLL/羧肽酶+亮氨酸氨基肽酶 4. cTLL/亮氨酸氨基肽酶 5. rTLL/亮氨酸氨基肽酶 6. cTLL/羧肽酶 7. rTLL/羧肽酶图5 SDS-PAGE分析羧肽酶Y、亮氨酸氨基肽酶降解rTLL和cTLLFigure 5 SDS-PAGE analysis of carboxypeptidase Y and leucineaminopeptidase degradation of rTLL and cTLL
2.5 TLL和cTLL的蛋白粒径分析
由图6可知,rTLL蛋白粒径不均一、分散性较差、蛋白团聚明显,PDI为0.313;环化后cTLL蛋白粒径均一、分子量分布均匀,平均粒径约为160 nm,PDI为0.173。PDI是聚合物分散性指数,描述聚合物分子量分布;PDI 越大,分子量分布越宽;PDI 越小,分子量分布越均匀。环化后的cTLL分子量分布越均匀。

图6 DLS分析蛋白粒径Figure 6 Protein particle size measured by DLS
2.6 稳定性分析
由图7可知,线性化的rTLL在加热30 min后,其稳定性便迅速下降,处理180 min后已形成大量沉淀,SDS-PAGE电泳结果显示可溶部分比例非常少;而对cTLL进行70 ℃加热处理后,蛋白沉淀和降解较弱,直至加热120 min后,蛋白条带才有肉眼可见的减少,表明末端连接的分子环化明显提升了TLL的热稳定性。
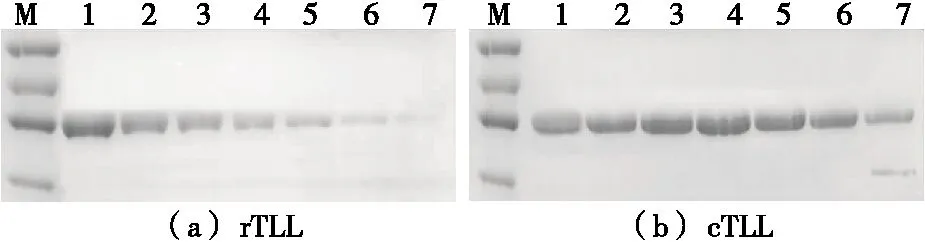
M. 蛋白质分子质量标准 1~7. 70 ℃加热0,30,60,90,120,150,180 min图7 rTLL和 cTLL热稳定性分析Figure 7 Thermal stability analysis of rTLL and cTLL
3 结论
蛋白质是由线形的氨基酸折叠而形成的具有一定的生物学功能和三维结构,由于蛋白质肽链的末端容易受到蛋白水解酶类的攻击,通过人工方法使肽链的氨基端和羧基端形成一个肽键,从而形成环形的骨架有利于抵御蛋白水解酶类的攻击[15],事实也证实大部分蛋白环化后稳定得到了很大提高。Butelase 1具有高催化活性并在反应中使用的酶量较少,简化了所需连接酶的纯化步骤;具有广泛的底物特异性,识别序列短至3个氨基酸,拓宽了酶的应用范围;在连接位点引入极少的残基,应用范围广。
研究利用哺乳动物表达系统HEK 293T细胞得到Butelase 1连接酶。哺乳动物细胞表达系统优势在于能够指导蛋白质的正确折叠,在提供复杂的N型糖基化和准确的O型糖基化等多种翻译后加工功能,因而表达产物在分子结构、理化特性和生物学功能方面最接近于天然的高等生物蛋白质分子。同时,在大肠杆菌中高效可溶表达和纯化得到了有活性的重组的疏棉状嗜热丝孢菌脂肪酶,通过Butelase 1催化获得了环化的环状疏棉状嗜热丝孢菌脂肪酶蛋白,纯化后环状疏棉状嗜热丝孢菌脂肪酶与重组疏棉状嗜热丝孢菌脂肪酶的比活基本相当,但有着更好的稳定性。但研究仅是对环化后的脂肪酶进行了耐热性试验,后续还应对其耐离子强度、pH值敏感性等特性进行研究,以更好的评估其应用前景。
