以阿魏酸为底物产香兰素微生物的筛选及发酵条件优化
2022-09-15李力群乔月梅郭春生
李力群 刘 强 乔月梅 郭春生 柴 颖 郝 捷
(内蒙古昆明卷烟有限责任公司,内蒙古 呼和浩特 010020)
香兰素是具有浓郁奶香味的香味剂[1-2],也是人类合成并使用最早的食品赋香剂之一,其产量大、用途广[3]。香兰素按照生产方式可分为植物提取法、化学合成法、微生物转化法[4-6]。相比于植物提取法和化学合成法,微生物转化法不受季节影响、污染少,香气和纯度与天然提取的香兰素几乎相同。能够通过微生物转化法生产香兰素的底物较多,如丁香酚、异丁香酚和阿魏酸等[7]。其中,阿魏酸广泛存在于麸皮和谷壳等农副产物中[8],价格低廉,原料充足,通过一步或两步转化就可生成香兰素[9],而且与其他底物相比,阿魏酸的毒性较小且产率高[10],是微生物法生产香兰素的理想底物。
微生物转化生产香兰素过程中菌种的选育是关键,优质、高产、稳定的菌种是生产效率的决定性因素。阿魏酸可被微生物转化生成异丁香酚或香草酸从而再生成香兰素[11-13]。研究发现,转化阿魏酸产香兰素的菌株有朱砂绿脓杆菌(Pycnoporuscinnabarinus)[14]、黑曲霉(Aspergillusniger)[15]、食酸假单胞菌(Pseudomonasacidovorans)[16]、大肠杆菌(Escherichiacoli)[17]、枯草芽孢杆菌(Bacillussubtilis)[18]等。研究拟从白酒大曲中筛选转化阿魏酸产香兰素的微生物菌株,进一步通过单因素和正交试验对菌株利用阿魏酸产香兰素工艺进行优化,以期为开发具有产浓郁奶香风味强化大曲提供参考。
1 材料与方法
1.1 试验样品
高温大曲:内蒙古自治区某浓香型白酒厂。
1.2 试验试剂
磷酸氢二铵:分析级,天津市智远化学试剂有限公司;
胰蛋白胨、酵母提取粉、琼脂、三羟甲基氨基甲烷(Tris-base):广东桓凯微生物科技有限公司;
Na2EDTA·2H2O、结晶紫:分析纯,广东桓凯微生物科技有限公司;
甲醇、三氟乙酸:色谱纯,天津市广大化学试剂有限公司;
香兰素、香草酸、阿魏酸:色谱纯,上海麦克林生化科技有限公司;
细菌基因组DNA提取试剂盒(DP302-02):天根生化科技(北京)有限公司。
1.3 仪器与设备
洁净工作台:HCB-1300V型,上海一恒科学仪器有限公司;
恒温振荡器:THZ-98C型,上海一恒科学仪器有限公司;
全自动高压灭菌锅:SX-500型,上海新普仪器设备有限公司;
电热恒温鼓风干燥箱:DHG-9053A型,上海一恒科学仪器有限公司;
真空抽滤装置:GM-0.5A,天津津腾实验设备有限公司;
高速离心机:2-16KHL型,德国希格玛实验室离心机公司;
液相色谱仪:U3000型,上海赛默飞世尔科技(中国)有限公司;
气相色谱质谱联用仪:7890型,安捷伦科技有限公司;
PCR仪:Veriti96型,上海赛默飞世尔科技(中国)有限公司。
1.4 培养基
富集培养基:胰蛋白胨10 g/L,氯化钠5 g/L,酵母提取物3 g/L,琼脂17 g/L;
平板分离培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L,琼脂17 g/L;
种子培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L;
阿魏酸发酵培养基:胰蛋白胨10 g/L,氯化钠5 g/L,酵母提取物3 g/L,阿魏酸1 g/L;
培养基均调节pH至7.0,121 ℃灭菌20 min。
1.5 试验方法
1.5.1 香兰素、阿魏酸、香草酸混合标准溶液 利用40%甲醇溶液(超纯水、色谱级甲醇)配制质量浓度为100,80,60,40,20,2 mg/L的香兰素、阿魏酸和香草酸混合标准溶液。
1.5.2 转化香兰素微生物的筛选及纯化 根据KEGG数据库确定香兰素合成代谢中的关键酶进而追溯到可以合成11种关键酶的潜在微生物大多为芽孢杆菌属微生物。因此,确定芽孢杆菌属为目标微生物类群。四分法取样称取大曲20 g,研磨后,用180 mL生理盐水洗涤,在振荡培养箱150 r/min混匀30 min,混匀后在80 ℃水浴锅中恒温30 min。水浴后吸取5 mL曲液接种于50 mL富集培养基中,于37 ℃、150 r/min摇床中富集培养24 h。富集培养结束后,用移液枪吸取1 mL菌悬液至盛有9 mL生理盐水的试管中稀释,然后依次稀释成10-2,10-3,10-4,10-5,10-6倍菌悬液。吸取稀释后的菌悬液涂布于平板分离培养基平板中,于37 ℃培养箱中培养24 h。观察菌落形态,挑取单一菌落接种于平板培养基中,37 ℃再培养24 h,将纯化后的单一菌落保藏于试管斜面培养基中,于4 ℃冰箱保存备用。
1.5.3 产香兰素微生物的鉴定及系统发育树构建 取纯化后的单菌落置于盛有5 mL种子培养基的试管中,于37 ℃,180 r/min培养16 h。采用天根DP302-02试剂盒方法提取菌株的基因组DNA。选择25 μL聚合酶链反应体系,利用通用引物进行PCR扩增。PCR程序为:在94 ℃ 10 min后,循环30个95 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,最后72 ℃ 10 min,4 ℃保藏备用。聚合酶链反应结束后,取1 μL进行1%琼脂糖凝胶电泳,根据电泳结果,送生工生物工程(上海)股份有限公司进行测序。根据测序得到的16S rDNA序列,利用NCBI在线数据库进行同源序列检索。作最大同源性比较分析,使用软件MEGA-X中的邻接法(Neighbor-Joining Method)构建系统发育树,同时进行重复次数为1 000次的Bootstrap测试,确定目标菌株的分类地位。
1.5.4 香兰素及其他转化产物检测方法 参照郑璇等[19]的方法。
1.5.5 菌体生长量的测定 以发酵液在600 nm处的吸光值来反映菌体生长量。
1.5.6 产香兰素条件优化
(1) 菌株的培养和发酵:将菌种接种于装液量为40%的摇瓶(250 mL)中,于恒温震荡培养箱中(180 r/min,37 ℃)培养24 h。将10%的种子液接种于盛有阿魏酸发酵培养的摇瓶(装液量为20%)中,在恒温震荡培养箱中(180 r/min,37 ℃)发酵培养4 d后测定发酵液中香兰素、阿魏酸和香草酸的含量。
(2) 发酵时间对菌株产香兰素的影响:将培养24 h的种子液按10%的接种量接种于装液量为20%、pH为7.0的阿魏酸发酵培养基中,在恒温震荡培养箱中(180 r/min,37 ℃)发酵培养,每隔1 d取样测定发酵液中香兰素、阿魏酸和香草酸的含量。
(3) 温度对菌株产香兰素的影响:将培养24 h的种子液按10%的接种量接种于装液量为20%、pH为7.0的阿魏酸发酵培养基中,在恒温震荡培养箱中(180 r/min;温度分别为30,35,37,40,45,50 ℃)发酵培养4 d。
(4) pH对菌株产香兰素的影响:将培养24 h的种子液按10%的接种量接种于pH分别为5,6,7,8,9,10,11,12的阿魏酸发酵培养基的锥形瓶中,在恒温震荡培养箱中(180 r/min,37 ℃)发酵培养4 d。
(5) 装液量对菌株产香兰素的影响:将培养24 h的种子液按10%的接种量接种于装液量分别为10%,20%,30%,40%,50%的阿魏酸发酵培养基中,在恒温震荡培养箱中(180 r/min,37 ℃)发酵培养4 d。
(6) 转速对菌株产香兰素的影响:将培养24 h的种子液按10%的接种量接种于装液量为20%阿魏酸发酵培养基中,在恒温震荡培养箱中(转速分别为120,140,160,180,200,220 r/min,37 ℃)发酵培养4 d。
(7) 正交试验优化:通过分析发酵时间、温度、pH、装液量和转速等对所筛菌株产香兰素的影响,筛选具有显著影响的因素,利用正交试验进一步优化菌株的转化香兰素的发酵条件。
2 结果与分析
2.1 产香兰素微生物的筛选及鉴定
从大曲中初筛芽孢杆菌属微生物后,通过添加底物阿魏酸,进行复筛,获得24株能够转化阿魏酸为香兰素的菌株。其中菌株B2-12产香兰素的能力最高,达22.15 mg/L。基于测序结果,构建菌株B2-12的16S rDNA基因系统进化树,确定其亲缘关系。由图1可知,菌株B2-12与BacillussubtilisAKKVG-2-18(MK346328.1)处在同一分支上,在GenBank数据库比对过程中发现,菌株B2-12与Bacillussubtilis(MK346328.1)的16S rDNA基因序列相似度为98%,由此推断菌株B2-12为芽孢杆菌属中的枯草芽孢杆菌(Bacillussubtilis)。

图1 菌株B2-12系统发育树Figure 1 Phylogenetic tree of strains B2-12
2.2 发酵液中香兰素定量分析
在香兰素的转化过程中,会产生和积累一些中间代谢物,且香兰素还会进一步降解,如阿魏酸、香草酸、愈创木酚、香草醇和原儿茶酸等。阿魏酸是香兰素合成的重要前体物,香草酸是香兰素进一步转化的主要产物(图2)。因此,通过HPLC法测定发酵液中阿魏酸、香兰素和香草酸含量的变化,来进一步探究各因素对菌株生长、细胞转化产香兰素的影响。
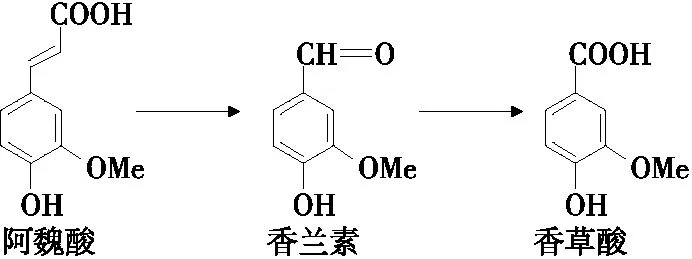
图2 阿魏酸、香兰素和香草酸转化关系Figure 2 The relationship of ferulic acid, vanillin and vanillic acid
采用高效液相色谱法(HPLC)测定发酵液中的香草酸、香兰素、阿魏酸含量,发现在280 nm,0.5 mL/min流速下混合标准品分离效果良好,香草酸的保留时间为11.357 min,香兰素的保留时间为13.443 min,阿魏酸的保留时间为17.592 min[见图3(a)]。发酵液中香草酸、香兰素、阿魏酸与其他杂峰分离效果良好,且保留时间与混标相差15 s以内[见图3(b)],表明该方法良好,可以用来定性分析发酵液中的香兰素等物质。
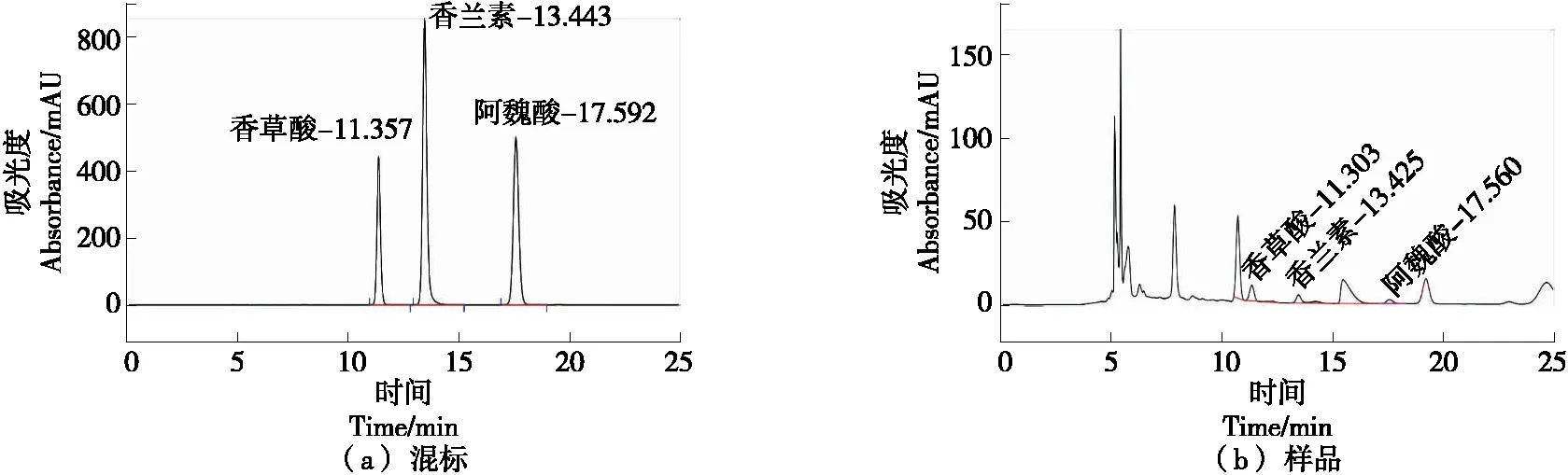
图3 香草酸、香兰素、阿魏酸色谱图Figure 3 Chromatogram of vanillic acid, vanillin and ferulic acid
用40%甲醇溶液配制的香草酸、香兰素和阿魏酸的混合标准溶液在2~100 mg/L线性范围内,阿魏酸、香兰素和香草酸的线性回归方程和相关系数见表1,其线性关系均良好,可以用来定量分析发酵液中香兰素等物质(图4)。

表1 混标中各物质线性回归方程和相关系数Table 1 Linear regression equation and correlation coefficient of each substance in mixed standard
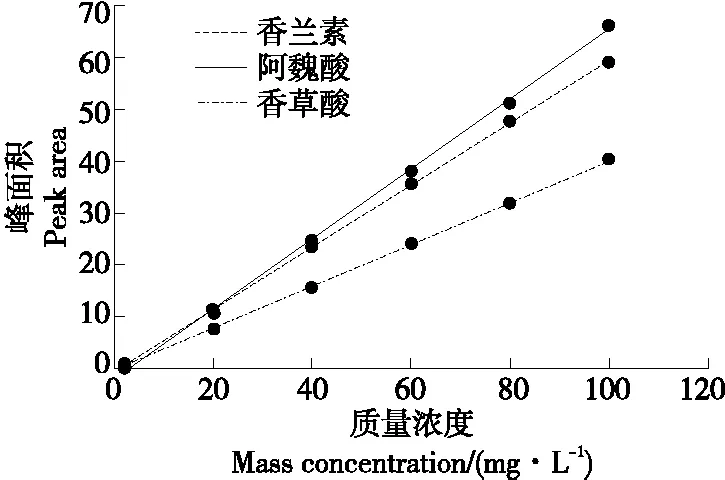
图4 香草酸、香兰素、阿魏酸混标标准曲线Figure 4 Standard curve of mixed standard of vanillic acid, vanillin and ferulic acid
2.3 发酵条件的影响
2.3.1 发酵时间的影响 由图5可以看出,发酵液中香草酸浓度随发酵时间的增加不断升高,发酵第7天香草酸发生跳跃式增加,质量浓度达到了28.3 mg/L,随后浓度基本保持稳定不变,一方面有可能是在第7天时发酵液各酚类物质积累量起到了一定的诱导作用,促进了香草酸的产生。另一方面菌体生长量在第7天时也急剧升高,说明菌株B2-12具有较强的产香草酸的能力。发酵液中残留的阿魏酸随发酵时间的推移呈现M型变化趋势,有可能是产生的其他酚类物质(如4-乙烯基愈创木酚)又转化生成了阿魏酸。随发酵时间的不断推移,发酵液中香兰素的含量逐渐增加,发酵第4天,发酵液中的香兰素质量浓度达到最大(25.4 mg/L)。当发酵时间超过4 d时,香兰素浓度逐渐降低。因此,选择发酵4 d为菌株B2-12转化阿魏酸产香兰素的最适发酵时间。
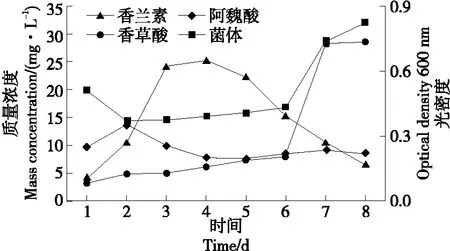
图5 发酵时间对B2-12菌株转化阿魏酸产香兰素的影响Figure 5 The effects of fermentation time on the fermentation of B2-12 strain to produce vanillin by ferulic acid
2.3.2 温度的影响 根据图6可知,在30,35 ℃时,大部分阿魏酸转化成了香草酸,香兰素浓度较低。当温度为37~45 ℃时,发酵液中产生了大量的香兰素,香草酸含量降低。在40 ℃时香兰素的质量浓度达到最大(23.8 mg/L),其菌体生长量也迅速升高。在45 ℃时菌体生长量达到最大(OD600 nm=0.744)。当温度超过45 ℃时,发酵液中香兰素和香草酸含量减少,发酵液中剩余的阿魏酸基本不变。由此可以看出,菌株B2-12最适转化温度范围为37~45 ℃,产香兰素的最佳转化温度为40 ℃。此结果与王洁[20]34所研究的食甲醇芽孢杆菌转化阿魏酸产香兰素的最适发酵温度一致,说明在40 ℃左右芽孢杆菌更容易转化阿魏酸产香兰素。
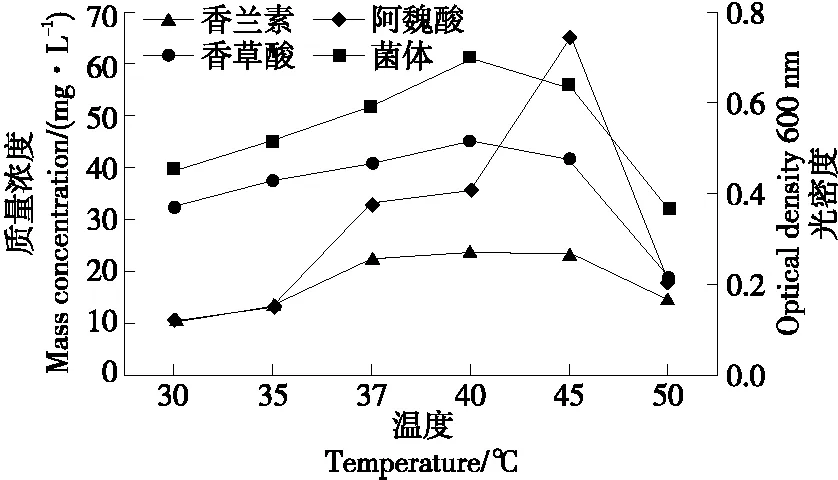
图6 温度对B2-12菌株转化阿魏酸产香兰素的影响Figure 6 The effects of temperature on the transformation of ferulic acid by strain B2-12 to produce vanillin
2.3.3 pH的影响 由图7可知,初始pH为5,6,7,8时,发酵液中剩余的阿魏酸较多,并随pH的增大而增大。当pH>8时,发酵液中残留的阿魏酸减少并趋于稳定在5.2 mg/L,主要是因为随pH的不断增大,发酵液中的阿魏酸大部分以阿魏酸钠的形式存在。香草酸在酸性条件下的含量大于碱性条件下,主要是因为在碱性条件下,香草酸被中和成香草酸钠溶液。菌体生长量随pH的增高而不断升高,当底物pH升高至9时,菌体生长量达到最大,OD600 nm为0.472。当pH为10时,菌体生长量迅速降低,随后并保持恒定,同时香兰素质量浓度达到最大33.07 mg/L,与王洁[20]30-33研究的食甲醇芽孢杆菌产香兰素的最适pH相吻合。由此推断,在碱性环境下更有利于阿魏酸转化产香兰素,但是对菌体生产具有负面影响。选择pH 10作为最适初始pH值。
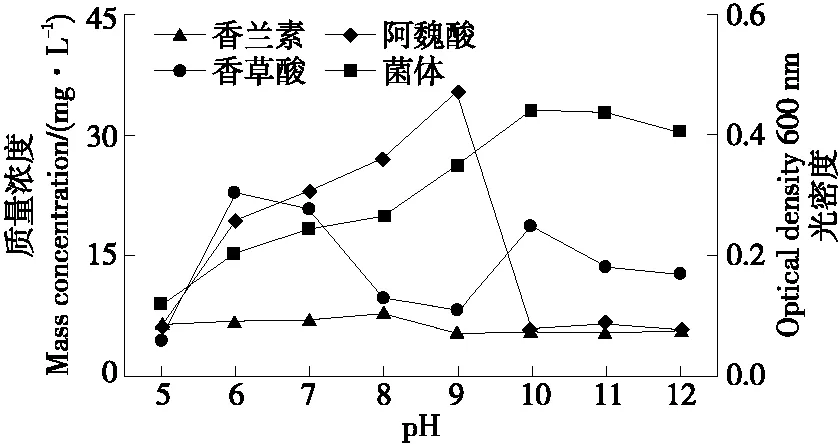
图7 初始pH对B2-12菌株转化阿魏酸产香兰素的影响Figure 7 The effects of substrate pH on the production of vanillin by B2-12 strain transformed with ferulic acid
2.3.4 装液量的影响 由图8可以看出,随装液量的增加发酵液中剩余的阿魏酸含量逐渐增大,香草酸的浓度逐渐减小,菌体生长量也逐渐减小,说明香草酸转化过程中需要较多的氧气,菌株B2-12是好氧微生物。随装液量的不断增大,香兰素的浓度随之增加,当装液量为40%时,发酵液中的香兰素质量浓度达到最大22.5 mg/L,随后缓慢降低。由此可以推断,B2-12菌株在高氧浓度下转化阿魏酸生成香兰素的速度小于转化香兰素生成阿魏酸的速度,在低氧浓度下更有利于生成香兰素。为了防止香兰素转化为香草酸,应该控制发酵液中的溶氧量。因此,选择最适装液量为40%。
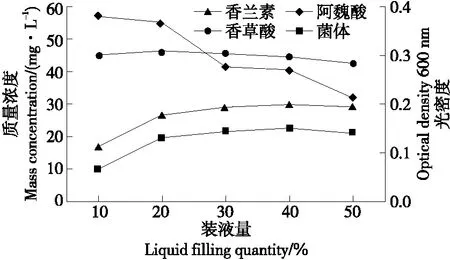
图8 装液量对B2-12菌株转化阿魏酸产香兰素的影响Figure 8 The effects of liquid volume on the production of vanillin by B2-12 strain transforming ferulic acid
2.3.5 转速的影响 摇瓶装液量和转速是影响发酵液溶氧量的两个重要因素,同时也影响发酵液中氧化还原反应和各酚类化合物的转化。由图9可知,随转速的不断增加,发酵液中剩余的阿魏酸和生成的香草酸呈负相关,说明随溶氧量的增加,发酵液中的阿魏酸更有利于转化成香草酸。发酵液中的香兰素和菌体生长量随转速的增加先增加后减小,香兰素和菌体生长量均在160 r/min时最大,香兰素质量浓度达到了23.0 mg/L。这表明在160 r/min时,菌株B2-12具有较强的转化阿魏酸产香兰素能力。
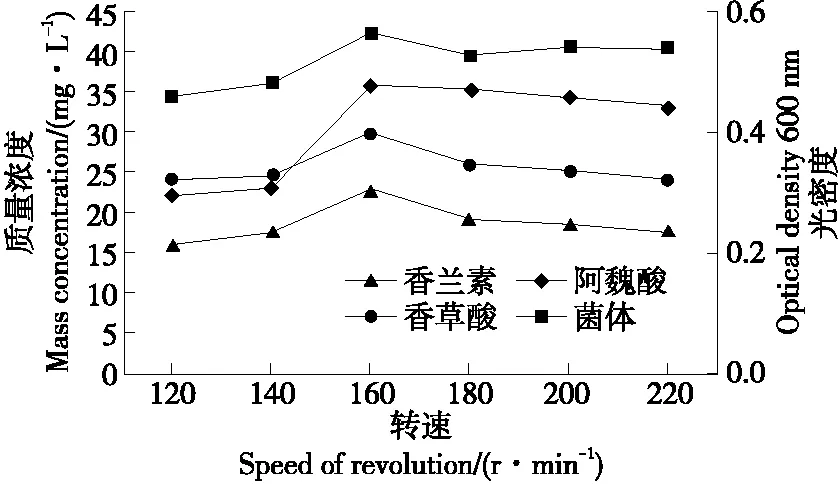
图9 转速对B2-12菌株转化阿魏酸产香兰素的影响Figure 9 The effects of rotation speed on the production of vanillin by B2-12 strain transforming ferulic acid
2.4 菌株B2-12转化阿魏酸产香兰素正交试验工艺优化
在单因素的基础上对影响菌株生长细胞产香兰素的主要因素:发酵温度、pH、装液量和转速进行L9(34)正交试验设计(如表2所示),确定产香兰素的最优工艺。
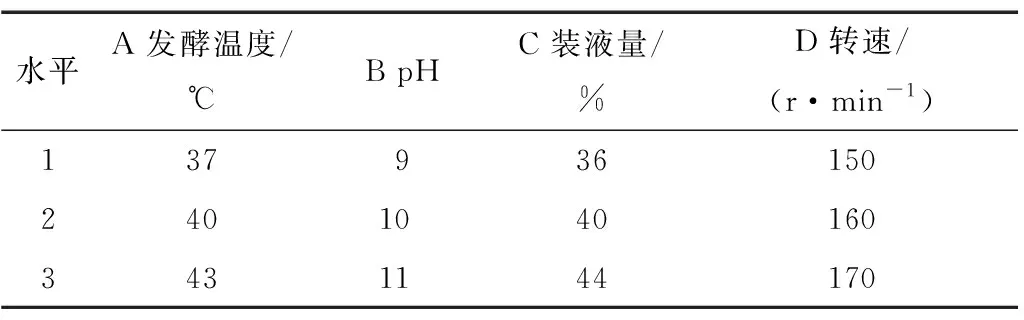
表2 菌株B2-12产香兰素工艺试验因素水平设计Table 2 Factors of orthogonal experiment for vanillin production process of B2-12
由表3可知,各因素对菌株B4-9产香兰素的影响大小为A>B>D>C,菌株B2-12转化阿魏酸产香兰素的最优工艺为A3B2C3D2,即温度43 ℃、pH 10、装液量44%、转速160 r/min。
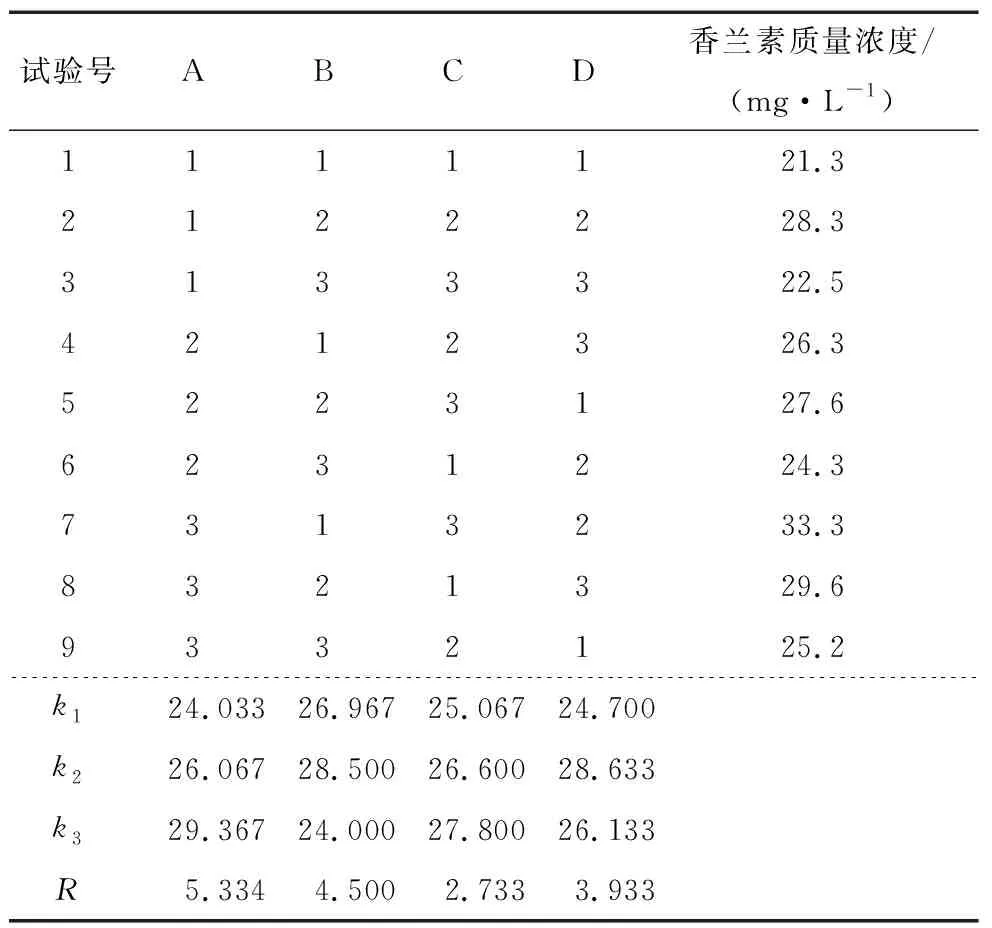
表3 菌株B2-12产香兰素工艺正交试验结果Table 3 Orthogonal test results of vanillin production by strain B2-12
在温度43 ℃、pH 10、装液量44%、转速160 r/min、接种量10%的最优工艺条件下发酵4 d,菌株B2-12发酵液中的香兰素质量浓度为(34.5±0.16) mg/L,表明正交试验得到的工艺条件可靠。
3 结论
研究通过数据库检索确定能够转化阿魏酸产香兰素的微生物范围,以阿魏酸为底物,从大曲中筛选得到转化阿魏酸产香兰素能力最强菌株B2-12。经16S rDNA鉴定其为枯草芽孢杆菌(Bacillussubtilis)。在单因素试验的基础上,对发酵温度、pH、装液量和转速进行正交试验优化了菌株B2-12以阿魏酸为底物产香兰素的工艺,结果发现菌株B2-12在装液量44%、pH 10、43 ℃、摇床转速160 r/min条件下发酵4 d后,发酵液中的香兰素质量浓度达到34.5 mg/L。
