多肽荧光探针HWEHH对水中铜离子的高通量检测
2022-09-15许迪雅张海曼张雅丹
许迪雅 张海曼 张 新 张雅丹 王 芳 张 琳
(1. 特医食品加工湖南省重点实验室,湖南 长沙 410000;2. 中南林业科技大学食品科学与工程学院,湖南 长沙 410000;3. 食品安全监测与预警湖南省重点实验室,湖南 长沙 410117;4. 湖南省产商品质量检验研究院,湖南 长沙 410117)
铜是人体内必不可少的微量金属元素,其需求量仅次于铁和锌[1]。但体内铜离子(Cu2+)含量过多又会对脏器造成负担,还会导致许多神经系统疾病,如阿尔茨海默症[2]、威尔逊氏病[3]、唐氏综合征[4]等。金属铜被广泛应用于工业生产中,而生产中的废铜若未经过处理直接排放会污染环境。动植物能够从环境中吸收Cu2+,又通过食物链富集到人体[5]。此外,人体对于Cu2+的摄入还来源于饮用水。世界卫生组织(WHO)规定,Cu2+在饮用水中的含量不能超过2 mg/L[6],成年人铜的摄取量不应超过10~12 mg/d。目前,Cu2+的检测方法主要分为直接检测法和间接检测法。直接检测法是利用Cu2+本身的物理、化学特性进行检测,主要包括原子吸收法[7]、电感耦合等离子体质谱法和生物传感器法[8]等。在利用原子吸收光谱法进行测定时,不同光源灯对应着不同的元素,对样品进行测量时需要及时更换光源灯。并且原子吸收光谱法的标准工作曲线线性范围比较窄,灵敏度低和抗干扰性弱等[9]。电感耦合等离子体质谱法检测离子的方法简单、速度快,但仪器价格昂贵[10]。间接检测法主要是利用Cu2+与荧光探针的特定化学反应进行检测。例如:荧光光谱法、比色法、免疫分析法、酶分析法等。其中,荧光光谱法因为其高灵敏度、强选择性、操作简单和响应速度快的优点[11],可以快速、大批量地检测样品中Cu2+的含量,近年来被广泛关注。
荧光探针分析法是一种建立在荧光分析光谱和探针荧光强度变化上的识别方法[12]。荧光分子探针技术对目标物进行检测的工作机制主要包括分子内电荷转移[13]、光致电子转移[14]、荧光共振能量转移[15]、聚集诱导发光[16]及激发态分子内质子转移[17]。近年来,大量有机分子荧光探针被用于Cu2+的检测,但有机分子荧光探针的合成过程中会使用到大量有毒有害的试剂,污染环境,且水溶性差。基于水溶性较好的多肽荧光探针因具有结构简单、生物相容性好等特点[18]受到关注。而荧光基团标记探针合成较为复杂,且副产物多。因此采用内源性荧光的多肽荧光探针能简化合成步骤,提高探针的水溶性,降低成本。
高通量检测技术是指可以一次检测多个样品或者对同一种样品进行多种检测的技术[19],被广泛应用于食品安全、药物/菌种筛选等领域[20]。高通量检测多基于酶联免疫测定技术、多重PCR技术、基因芯片检测技术等实现单次多个样品的同时检测。其中多功能酶标仪因为拥有多种检测模式(吸光度、荧光强度、时间分辨荧光等)、操作简单、样品消耗量少、成本低等优点被广泛应用于高通量检测中。
研究拟开发组氨酸—色氨酸—谷氨酸—组氨酸—组氨酸(HWEHH)荧光探针,其中色氨酸(W)具有强荧光,组氨酸(H)可以与Cu2+络合,谷氨酸(E)可以增加多肽的水溶性和稳定性。根据Cu2+与多肽荧光探针络合后探针荧光强度的变化,实现对Cu2+的检测,并结合酶标仪实现多肽荧光探针对水中Cu2+的高通量检测,为实现水溶液中的Cu2+快速检测提供一种新方法。
1 材料与方法
1.1 材料与试剂
HWEHH(图1)多肽荧光探针:分析纯,探针序列由实验室设计,由上海强耀生物集团有限公司合成并纯化;
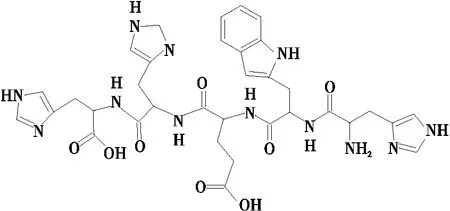
图1 HWEHH结构Figure 1 The structure of HWEHH
各金属阳离子:分析纯,国药集团化学试剂有限公司;
浓硫酸、浓盐酸:分析纯,成都市科隆化学品有限公司;
4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES):分析纯,美国Sigma公司;
试验用水为去离子水;
自来水:中南林业科技大学神农楼;
饮用水:中南林业科技大学神农楼直饮水系统。
1.2 仪器与设备
荧光分光光度计:F-4600型,日本高新技术公司;
紫外分光光度计:UV-2600型,日本岛津公司;
多功能酶标仪:Spectra Max i3x型,上海美谷分子仪器有限公司。
1.3 方法
1.3.1 溶液的配制 将冻干多肽探针(HWEHH)粉末直接溶于10 mmol/L NaOH溶液中,制成浓度约为1 mmol/L 的探针储备液,并将其稀释至2 μmol/L的标准工作液。用紫外分光光度计检测多肽溶液的浓度。各金属离子溶液采用其阴离子所对应的酸配制成浓度为1 mmol/L 的离子溶液。
1.3.2 紫外可见分光光度法 扫描范围200~800 nm,以10 mmol/L HEPES缓冲溶液为空白背景调零,紫外分光光度计对储备液稀释液进行检测。根据朗伯比尔定律[21]按式(1)测定可溶性多肽的浓度。
A=Σbc,
(1)
式中:
A——吸光度;
Σ——色氨酸的摩尔吸光系数,5 400 L/(mol·cm);
b——吸收池的厚度,cm;
c——溶液的摩尔浓度,mol/L。
1.3.3 荧光分光光度法
(1) 测定多肽荧光探针光谱:以280 nm为激发波长,发射波长为290~450 nm,室温下对HWEHH多肽探针溶液进行荧光测量。狭缝设置10.0 nm,电压500 V。对HEPES溶液、探针溶液、含有Cu2+的多肽探针溶液进行3次荧光测量。
(2) 温度对探针稳定性的影响:选取不同的温度(25,30,35,40,45,50,55,60 ℃)孵育2 μmol/L的标准工作液10 min后进行荧光测量,记录不同温度下多肽探针的荧光强度。
(3) pH对多肽荧光探针的影响:使用HCl和NaOH溶液调节HEPES缓冲溶液的pH分别为2.0,4.0,6.0,7.4,8.0,10.0。采用不同pH缓冲溶液稀释储备液得2 μmol/L 的标准工作液,进行荧光测量记录溶液的荧光强度,再向其中滴加Cu2+,使溶液中Cu2+最终浓度为1.5 μmol/L,计算不同pH下多肽探针的荧光变化率。
(4) 标准曲线:
① 单个样品检测的标准曲线:向多肽探针溶液中滴加Cu2+进行荧光测量,直至荧光强度不再变化,记录每次滴加Cu2+的体积、浓度及荧光强度,绘制Cu2+标准曲线,并按式(2)计算解离常数[22]。
ΔF=F0-FL=[(F0-Fα)/2M0]{(L+M0+Kd)-[(L+M0+Kd)2-4M0L]1/2},
(2)
式中:
F0——无Cu2+存在下的荧光强度,AU;
FL——Cu2+存在下的荧光强度,AU;
Fα——Cu2+饱和的荧光强度,AU;
M0——多肽与Cu2+结合的实际浓度,μmol/L;
L——游离的Cu2+浓度,μmol/L;
Kd——解离常数,mol/L。
② 高通量样品检测的标准曲线:配置含有不同浓度Cu2+的多肽荧光探针溶液(0.1,0.2,0.3,0.4,0.5,0.8,1.0,1.2,1.5 μmol/L),加入384孔板中,于酶标仪中进行荧光测量,激发波长280 nm;发射波长310~450 nm;记录荧光强度并绘制标准曲线。
(5) 选择性试验:标准工作液中滴加不同的金属阳离子,使其最终浓度均为1.5 μmol/L,对其进行荧光测量,再向含有不同金属阳离子的工作液中滴加Cu2+,使Cu2+浓度为1.5 μmol/L。记录荧光变化强度,并与只含Cu2+工作液的荧光变化强度进行对比。
1.4 HWEHH荧光探针检测限的确定
重复扫描标准工作液20次,按式(3)计算该荧光探针在该浓度下的检测限[23]。
LOD= 3σ/S,
(3)
式中:
LOD——检测限,μmol/L;
σ——空白条件下扫描溶液20次的标准偏差;
S——标准线性方程的斜率。
1.5 实际样品的测定
对样品的荧光强度进行测量以排除样品自有的荧光强度对试验准确性的影响。测量含有样品的工作液的荧光强度,根据对应标准曲线计算样品中Cu2+浓度,并进行样品加标回收试验检测该方法的准确性。
2 结果与分析
2.1 HWEHH的激发特征及Cu2+对其荧光的淬灭作用
由图2(a)可知,HWEHH荧光探针在280 nm处有最大吸收峰,吸光度为0.033,此时储备液浓度为1.22 mmol/L。由图2(b)可知,HEPES缓冲溶液在354 nm处无荧光峰,HWEHH探针溶液在354 nm处有较强的荧光峰。色氨酸的特征荧光峰约在360 nm[23],但是多肽中色氨酸的峰会由于周围原子和电子的影响而发生偏移,因此HWEHH荧光探针的荧光峰的峰值位于354 nm。当向探针溶液中加入Cu2+后,溶液在354 nm处荧光值大幅度降低,从2 136降低至900.5,表明HWEHH荧光的淬灭是由Cu2+引起的。
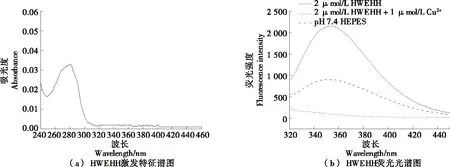
图2 HWEHH特征谱图Figure 2 HWEHH characteristic spectrum
2.2 温度对HWEHH荧光探针稳定性的影响
由图3可知,在试验范围内,30 ℃的荧光强度最大,随着温度的升高,探针溶液的荧光强度峰值将会降低(由2 485降至1 877)。这是因为溶液温度(30 ℃以上)越高,介质黏度越低,分子之间的热运动越剧烈[24],从而增加荧光分子同溶剂分子之间的碰撞几率。由此得出荧光探针的最佳工作温度为30 ℃。而25,30 ℃的荧光强度差异率为6%,考虑工作时的检测成本,后续所有试验均在25 ℃ 下进行。
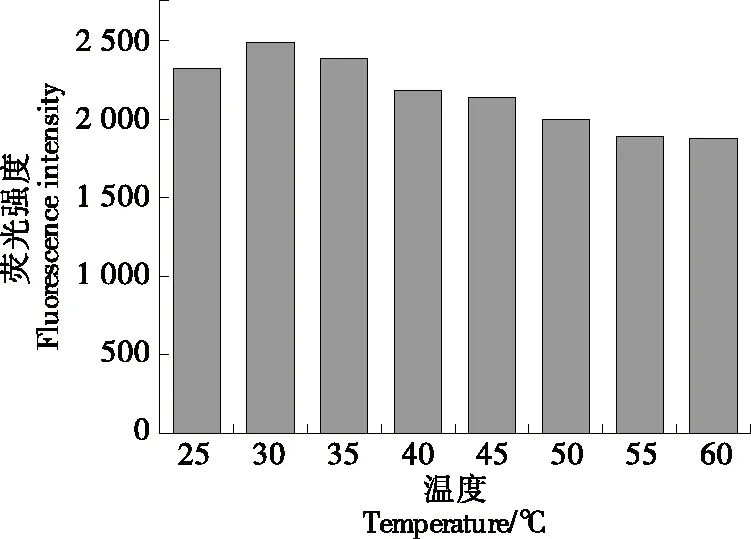
图3 HWEHH溶液在不同温度下的荧光强度Figure 3 Fluorescence intensity of HWEHH solution at different temperatures
2.3 pH对HWEHH荧光探针的影响
由图4(a)可知,当pH为2.0~8.0时,随着pH的升高,荧光探针溶液在354 nm处的荧光强度也随之升高。这是因为溶液pH值的变化影响荧光物质的电离状态,从而影响荧光物质的荧光强度。由图4(b)可知,Cu2+加入引起的多肽探针荧光变化率也会受到pH的影响,多肽荧光探针在酸性条件下与Cu2+结合较弱,荧光淬灭效果不明显,变化率为0~0.2。增大pH,淬灭效果越来越明显,变化率达到0.6以上,说明其灵敏度也升高。当pH增大到7.4,8.0时变化率达到最佳,8.0之后pH越大,灵敏度随之降低。这是因为酸性条件下,谷氨酸带正电,与Cu2+产生静电斥力,难以络合,中性环境下,谷氨酸带负电,与Cu2+有静电吸引作用,使络合更加稳定[25]。组成多肽的氨基酸等电点均≤7.6,在pH 10时,4个多肽分子均带较多负电荷有斥力作用,与Cu2+的结合能力比pH 7.4,8.0的稳定性差。通常情况下液体酸碱值大部分为中性,因此后续所有试验均在pH 7.4下进行。
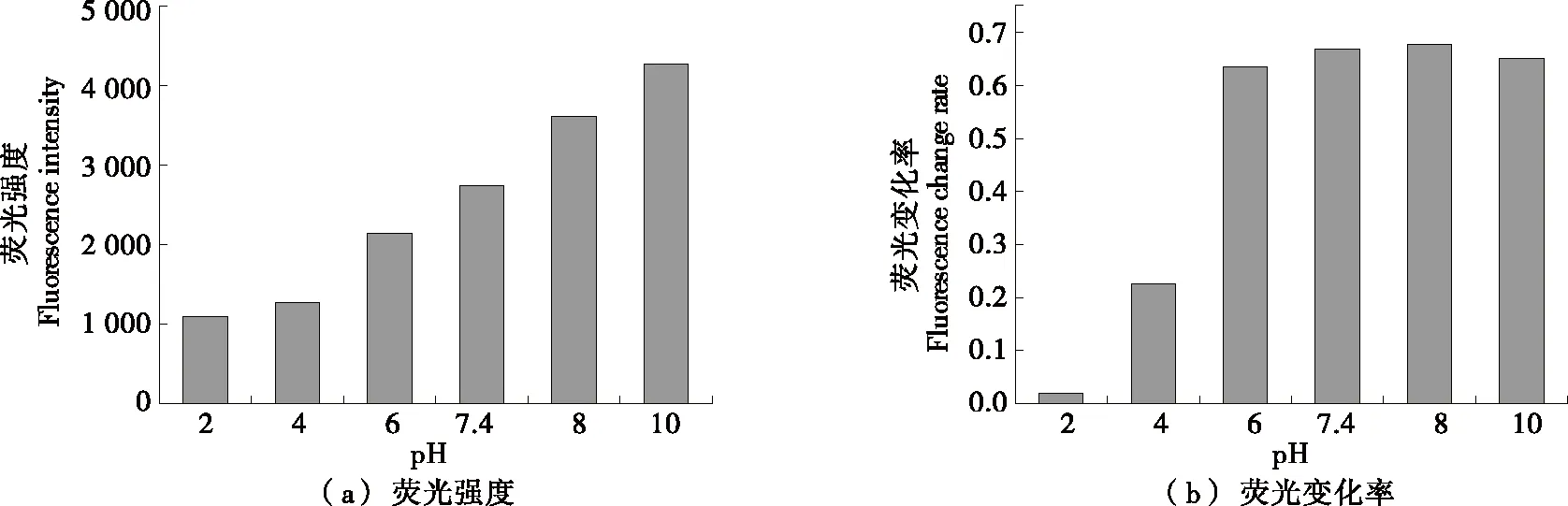
图4 不同pH下HWEHH荧光探针的荧光强度及荧光变化率Figure 4 Fluorescence intensity and change rate of HWEHH fluorescent probe at different pH value
2.4 HWEHH荧光探针检测Cu2+的标准曲线、解离常数和检测限
由图5(a)可知,Cu2+对该探针的淬灭效果具有浓度依赖性。由图5(b)可知,当Cu2+浓度为0~1.5 μmol/L时,随着Cu2+浓度的增加,多肽探针的荧光强度降低,且其荧光强度与Cu2+呈负相关,此时解离常数为7.5×10-7mol/L,络合常数是解离常数的倒数,为1.3×106L/mol,证明其络合能力较强。其线性方程为Y= -1 135.085 7X+2 048.187 6(R2=0.999),检测限为0.036 μmol/L。
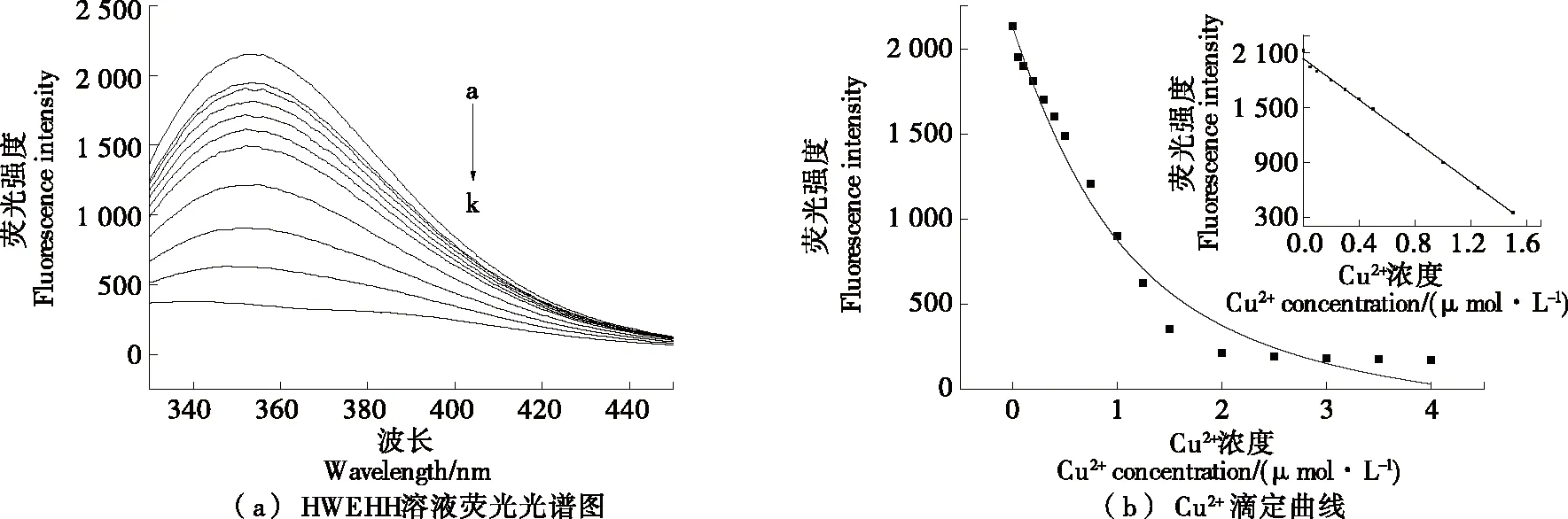
a~k中Cu2+浓度依次为:1.5,0.25,1,0.75,0.5,0.4,0.3,0.2,0.1,0.05,0 μmol/L图5 不同浓度Cu2+的HWEHH溶液荧光光谱图及标准曲线Figure 5 Flourescence spectra standard curve of HWEHH containing different concentrations of Cu2+
2.5 HWEHH荧光探针对Cu2+的选择性
由图6(a)可知,只有Cu2+能引起探针荧光的显著变化(0.81),其他金属阳离子对该探针无明显的淬灭效果(0.03~0.05)。由图6(b)可知,当溶液中存在其他金属阳离子时,不会对HWEHH荧光探针识别Cu2+产生影响。
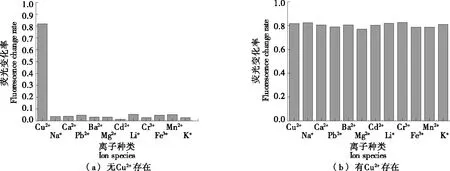
图6 含有不同金属阳离子的多肽溶液的荧光变化率Figure 6 Fluorescence change rate of HWEHH peptide solution containing different metal cations
2.6 HWEHH高通量检测Cu2+的标准曲线
由图7可知,关于Cu2+浓度的线性方程为Y=-283 958.437X+680 750.954(R2=0.981),说明可以利用多肽荧光探针法同高通量检测技术结合来检测食品中的Cu2+浓度。
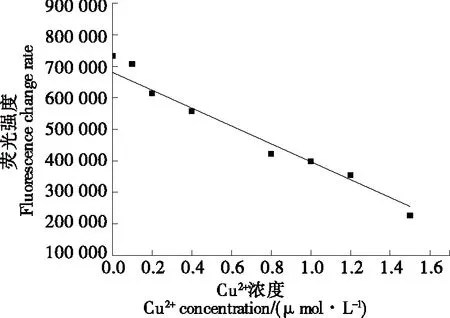
图7 高通量检测Cu2+浓度的标准曲线Figure 7 Standard curve of Cu2+ concentration in high-throughput detection
2.7 实际样品中Cu2+的测定
自来水、饮用水在310 nm左右有水的拉曼峰,在其他位置无峰出现,说明样品自身在354 nm处无荧光值,不会影响HWEHH荧光探针对样品中Cu2+浓度的检测。由表1可知,自来水和饮用水中的加标回收率为93.6%~101.9%,表明该荧光探针可以用于实际样品中Cu2+含量的检测。
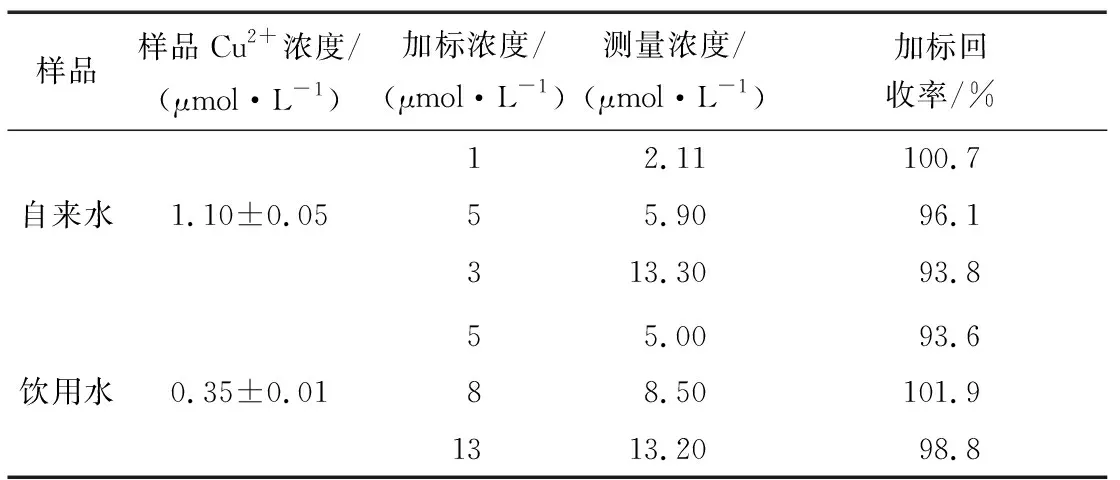
表1 加标回收率Table 1 Standard recovery rate
3 结论
利用组氨酸—色氨酸—谷氨酸—组氨酸—组氨酸(HWEHH)多肽作为荧光探针,检测了样品中Cu2+的含量。结果表明,当样品中存在Cu2+时,Cu2+与HWEHH络合,阻断多肽分子内电子转移,导致HWEHH荧光的淬灭,使探针荧光值降低。当荧光探针浓度为2 μmol/L时,其对Cu2+有较高的选择性,且检测的线性范围为0~1.5 μmol/L,线性方程为Y= -1 135.085 7X+2 048.187 6,检出限为0.036 μmol/L。利用384孔板结合HWEHH荧光探针可实现对Cu2+的高通量检测。通过对实际水样品(自来水、饮用水)中Cu2+进行加标试验发现其回收率较高,可有效实现水溶液中Cu2+的检测。此外,该探针与Cu2+的络合机制没有进行深入研究,后续可以采取核磁共振、计算机模拟等方法对其作用机理进行进一步探究。
