益生菌发酵对中药总黄酮与总多糖含量的影响
2022-09-15赵玉洁周金羽甄明哲潘润蕾单琢睿崔一喆
赵玉洁,邹 悦,周金羽,甄明哲,潘润蕾,单琢睿,崔一喆
(黑龙江八一农垦大学,黑龙江大庆 163319)
中草药不仅有着良好的药效,且相比于人工合成化学药物有着更小的毒副作用,少残留,环保等优点。中药发酵是将天然药物(中药材)经处理后以优选的肠道益生菌菌群中一种或几种、一株或几株益生菌作为菌种,利用微生态学、仿生学的方法,通过生物嫁接的方式,对提取的中药有效成分进行生物学转化,将中药的大分子物质,经过微生物转化成小分子成分,使药材的性能、治疗作用大为改变[1]。常用的益生菌主要有酵母菌、益生芽孢菌、丁酸梭菌、乳杆菌、双歧杆菌等。其中枯草芽孢杆菌菌体自身可以合成α-淀粉酶、蛋白酶、脂肪酶、纤维素酶等酶类,发挥消化酶的作用,对植物性碳水化合物有较强的分解能力[2]。乳酸杆菌可以发酵碳水化合物并产生大量乳酸,在自然界分布广泛,且该类群细菌绝大多数对动物和人无毒、无害,不仅可以加快蛋白质、乳糖和钙等营养物质的消化吸收,产生多种维生素为机体消化吸收所利用,还可以抑制肠道内腐败菌、致病菌的繁殖,降低血氨和血中胆固醇的含量[3],这两种益生菌均有可能促进中药使用效率的功能。在之前的实验中[4],使用了藿香、半枝莲、陈皮、甘草这四味中药对奶牛酮病进行过治疗,实验在此基础上,采用了枯草芽孢杆菌及乳酸杆菌对这四味药材发酵提取,并进行有效成分含量测定,以各提取液中总黄酮含量及多糖含量为指标设计实验,通过对比,分析各提取方式的可行性。
1 材料与方法
1.1 药材与试剂 实验所用的半边莲、陈皮、藿香、甘草均选购于成都市荷花池中药材批发市场;植物乳酸杆菌(海博生物技术有限公司,批号20210414);枯草芽孢杆菌(海博生物技术有限公司,批号20210414);芦丁(上海源叶生物科技有限公司,T20 N11Z131674)。
1.2 主要仪器与设备 震荡培养箱(浙江华源仪器有限公司);SW-CJ-1F型单人双面净化工作台(上海沪净医疗器械有限公司);DK-8D型电热恒温水槽(上海森信实验仪器有限公司);DRP-9272型电热恒温培养箱(上海森信实验仪器有限公司);V-5000可见分光光度计(上海元析仪器有限公司)。
1.3 菌种接种 本实验细菌选用LB肉汤液体培养基接种。取LB培养基2.5 g倒入锥形瓶中,加入100 mL纯水溶解,再经高压灭菌锅121 ℃,灭菌30 min。灭菌后将培养基倒入两个试管中,并用试管塞塞好,分别编号1号和2号。待冷却后接入菌种。
本实验选用枯草芽孢杆菌和乳酸杆菌,乳酸杆菌为液体菌种,枯草芽孢杆菌为磁珠吸附式菌种。在无菌操作台,培养基及各实验操作仪器经紫外灭菌30 min,操作者经酒精消毒。点燃酒精灯,取1号试管,管口与试管塞经酒精灯外焰灭菌消毒,再取镊子同样经过酒精火焰,镊子冷却后夹取枯草芽孢杆菌冷冻管中占有菌液的磁珠,放入1号培养基中浸润,完成接种。再取2号培养基,同样方式经酒精灯火焰消毒,取一次性接种环蘸取乳酸杆菌菌液,浸入2号培养基中,完成接种。将接菌完毕的1号与2号培养基37 ℃恒温培养24 h 获得菌液。
1.4 中药发酵 将藿香、半枝莲、陈皮、甘草四味中药分别使用中药粉碎机(巴菱200型,编号32594356444)粉碎,过60目筛得到中药粉剂。将每一种中药分为枯草芽孢杆菌发酵组,乳酸杆菌发酵组,对照组(不加菌)三组,每组设有三个重复。
1.4.1 接菌发酵 称取三份藿香均为4 g,分别加入三个锥形瓶中,并标号(藿+枯草,藿+乳酸,藿对照)。三组中均加入40 mL纯水,对照组只加水和中药。在叶思勇等人的研究中[5],选择出最佳的发酵条件。枯草组和乳酸组分别准确加入1.6 mL的枯草芽孢杆菌菌液或乳酸杆菌菌液(4%浓度),混合均匀呈糊状,接着进行37 ℃、转速180 r/min摇床培养72 h(3 d)。半枝莲,陈皮,甘草操作方式同上。中药发酵液制备完毕后,放入摇床培养3 d。
1.4.2 样品液制备 中药粉发酵培养完毕后,将发酵液用纱布过滤,取滤渣,精密称取3 g,放入圆底烧瓶中,加入250 mL的70%乙醇溶液,80 ℃下冷凝回流1 h 40 min,冷却后,纱布过滤,取滤液,70%乙醇溶液定容至250 mL,作为样品液。分装,4 ℃下冷藏。
1.5 总黄酮含量的测定
1.5.1 标准曲线的绘制 精密称取芦丁对照品13.2 mg,加入60%乙醇溶解并定容至15 mL量瓶中,制得0.528 mg/ml芦丁对照品溶液。
精密吸取芦丁对照品溶液0 mL、0.5 mL、1 mL、1.5 mL、2 mL于15 mL离心管中,每管分别加入3 mL、2.5 mL、2 mL、1.5 mL、1 mL的60%乙醇(即:分别定容至3 mL)。每管加1 mL 5%亚硝酸钠溶液摇匀,静置6 min;再各加1 mL 5%硝酸铝溶液摇匀,静置6 min;再加4%氢氧化钠溶液10 mL摇匀,最后将各管用60%乙醇定容到15 mL。静置15 min得到对照品提取液。
1.5.2 对照品的测定 根据查阅文献可知[6],510 nm波长总黄酮吸光值最大,故将上述各提取液用分光光度计测量吸光度,并计算对应的芦丁质量浓度,结果见表1。

表1 对照品总黄酮含量测定相关数据Tab 1 Determination related data of total flavonoids content of reference substance
以芦丁质量浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,得到标准方程。根据标准曲线换算样品液中总黄酮浓度,再进一步计算黄酮提取率。得到总黄酮浓度标准曲线:y=21.534x-0.063,R2=0.9923。结果见图1。

图1 总黄酮含量标准曲线Fig 1 Standard curve of total flavonoids content
1.5.3 样品总黄酮含量测定 取1.4.2中制好的样品液5 mL至10 mL离心管中,再加入5 mL的60%乙醇溶液(稀释2倍)。另取4个10 mL离心管加入稀释液1 mL,其中一份加入60%乙醇4.6 mL,作为参比溶液,另外三份为均为测量溶液。
1.5.3.1 样品液总黄酮提取 三份测量溶液中各加入0.3 mL的5%亚硝酸钠溶液摇匀,静置6 min;再各加0.3 mL的10%硝酸铝溶液摇匀,静置6 min;再各加4 mL的10%氢氧化钠溶液摇匀,静置15 min。
1.5.3.2 样品液总黄酮测定 510 nm处,由分光光度计测量三份测量溶液的吸光度,并取其平均值,带入回归方程得浓度数据,再根据公式计算其总黄酮含量。
1.5.3.3 样品总黄酮浓度计算 已知方程:样品总黄酮含量(mg/g)=X*n*V1/(V*W)
式中:X—测出的浓度(mg/mL)
n—稀释倍数
V1—样液总体积(mL)
V—测定时取样体积(mL)
W—样品质量(g)
由上述标准方程求得提取液中总黄酮浓度,再由总黄酮含量(mg/g)计算公式求得提取液总黄酮含量。
1.6 总多糖的测定
1.6.1 标准曲线的绘制 称取4 mg干燥恒重的无水葡萄糖,溶解于40 mL蒸馏水中得到0.1 mg/ml葡萄糖溶液。
精密量取葡萄糖对照品溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,分别放置于5支10 mL离心管中,分别精密加入纯水(1.8 mL、1.6 mL、1.4 mL、1.2 mL、1.0 mL),定容至2 mL。各加入4%苯酚溶液1 mL摇匀,再加入7 mL浓硫酸摇匀,40 ℃恒温水浴30 min,再至冷水浴5 min。取提液2 mL至离心管,再加入70%乙醇溶液2 mL稀释两倍摇匀,倒入5 mL比色皿中。
1.6.2 对照品的测定 根据查阅文献可知[7],490 nm处多糖吸光值最大,故在490 nm处测定对照品各提取液的吸光度并记录。结果如表2。
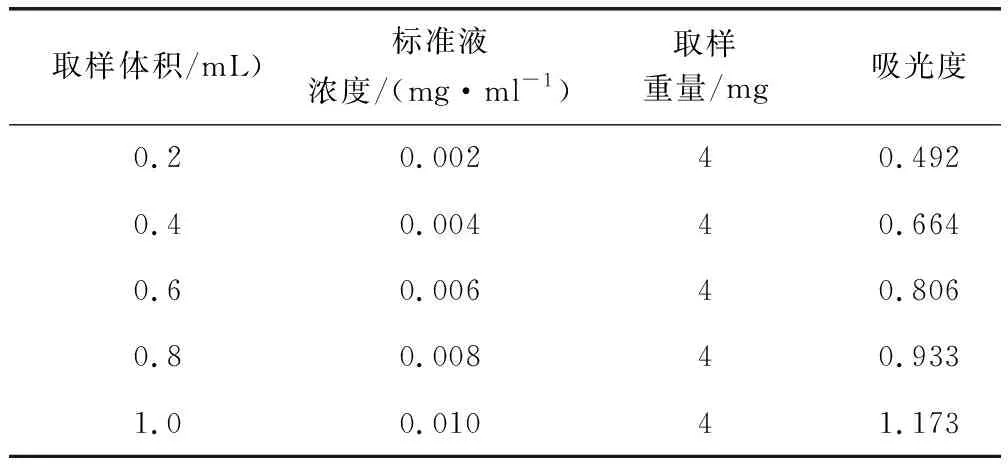
表2 葡萄糖对照品总多糖含量的测定Tab 2 Determination of total polysaccharide content of glucose reference substance
以490 nm处多糖含量为横坐标,吸光度为纵坐标绘制标准曲线,计算标准方程。根据标准曲线换算样品液中总多糖浓度,再进一步计算多糖提取率。得到总多糖浓度标准曲线:y=81.55x+0.3243,R2=0.9878。结果如图2。
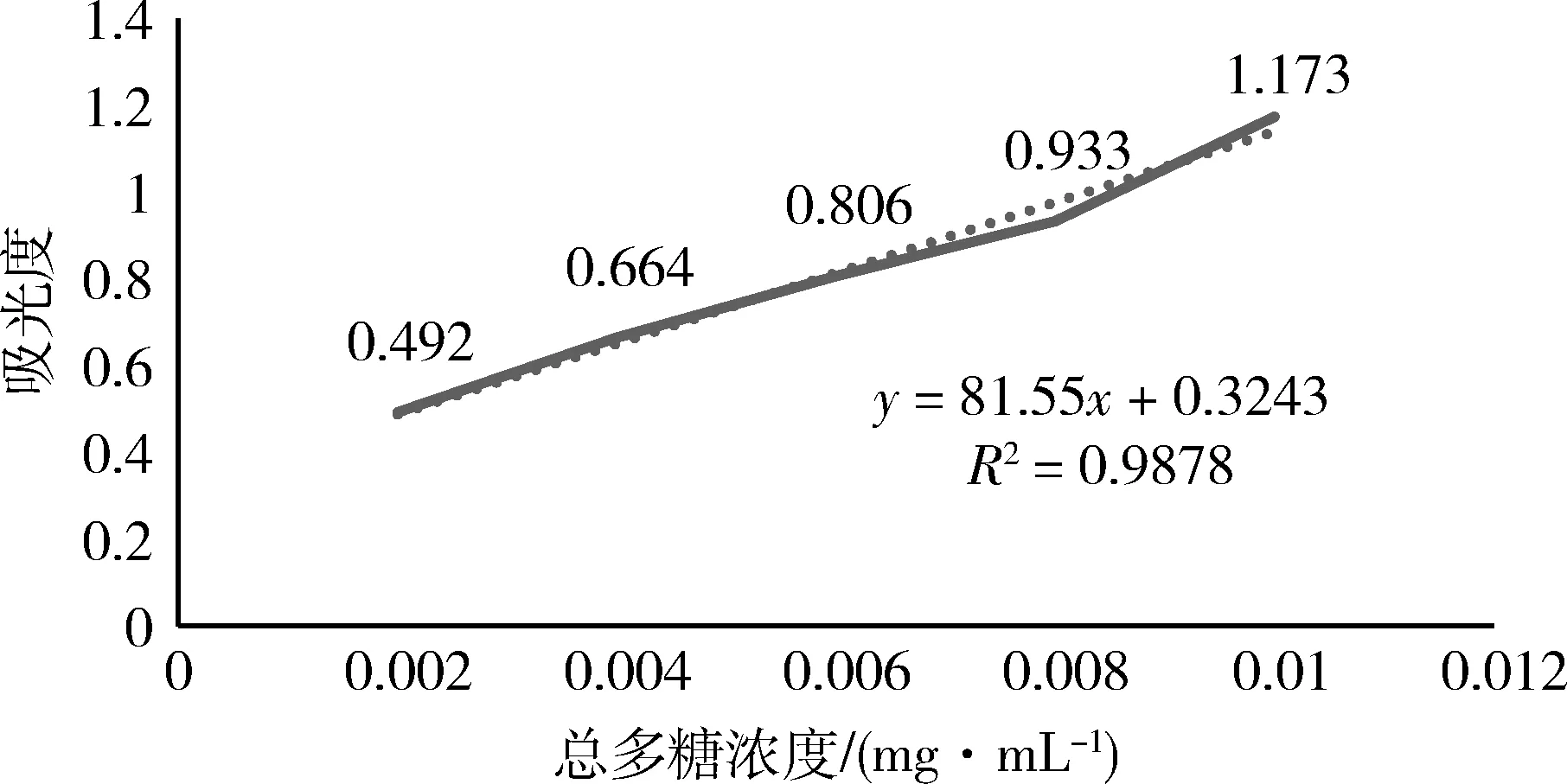
图2 总多糖浓度标准曲线Fig 2 Standard curve of total polysaccharide concentration
1.6.3 样品总多糖含量测定 取1.4.2中制备好的样品液3份各2 mL,分别加入4%苯酚1 mL摇匀,再加入浓硫酸7 mL摇匀,40 ℃恒温水浴30 min,后冷水浴5 min。取提液2 mL,再加入2 mL的70%乙醇溶液稀释2倍摇匀,加入5 mL比色皿。在490 nm处测定其吸光度,带入标准曲线得其浓度数据,三次结果取平均值,根据公式换算成总多糖含量。
已知方程:W=(C*V1*n)/M*V2
式中:W—可溶性总多糖含量(mg/g)
C—标准方程求得的糖量
V1—提取液量
n—稀释倍数
V2—吸取样品液体积
M—样品重量
由上述标准方程求得样品多糖浓度,并带入多糖含量计算公式求得样品液可溶性总多糖含量。
2 结 果
在510 nm处测得样品总黄酮吸光度范围:0.037~0.91,而上述黄酮标准曲线线性范围:-0.12~1.11,故实验测得各提取液吸光度均在该范围内,则可由总黄酮含量公式计算出样品总黄酮含量,最终测量结果如表3。
在490 nm处测得样品总多糖吸光度范围:0.12~1.217,其中藿香水提液、半枝莲乳酸杆菌提取液、半枝莲水提液、陈皮三种提取液、甘草乳酸杆菌提取液测得的吸光度符合标准曲线要求,其余提液因数值过小无法记录,推测由于实验稀释倍数过高导致吸光度过小无法计算。每组实验重复三次,测得SD值,精密度良好。最终测量结果如表3。

表3 样品有效成分测量情况Tab 3 Measurement of active ingredients of samples
发酵液低于水提液提取量:半枝莲、陈皮、甘草三味药材经枯草芽孢杆菌及乳酸杆菌发酵后提取和藿香枯草芽孢杆菌发酵提取出的总黄酮含量低于它们的水提液提取量,其中陈皮的两组菌发酵液减幅最大,藿香枯草芽孢杆菌发酵液减幅微弱,半枝莲、甘草的两组菌发酵液都有明显减幅;陈皮乳酸杆菌和枯草芽孢杆菌发酵提取液的总多糖含量也低于其水提液含量,其中陈皮枯草芽孢杆菌发酵液的总多糖含量减幅最大。
发酵液高于水提液提取量:藿香乳酸杆菌发酵液的总黄酮含量微高于其水提液中总黄酮量;半枝莲、甘草的乳酸杆菌发酵液中总多糖含量明显高于其水提液中总多糖量。
枯草芽孢杆菌和乳酸杆菌发酵情况对比:枯草芽孢杆菌对藿香、半枝莲、陈皮、甘草四味药材的有效成分提取均有抑制作用,即:枯草芽孢杆菌更容易抑制上述药材有效成分的释放;乳酸杆菌仅对半枝莲、陈皮、甘草三味药材的总黄酮提取及陈皮总多糖提取产生明显的抑制作用,而对半枝莲、甘草的多糖提取都产生明显促进作用,故乳酸杆菌可能更利于部分药材的多糖释放。
有效成分提取量的对比:以上四味中药提取液中陈皮水提液中总黄酮含量最高(95.06 mg/g),陈皮水提液中总多糖含量最高(309.33 mg/g)
3 分析与讨论
经分光光度计测量后,部分药材总多糖提取液得到的吸光度值极小,超出了多糖标准曲线的线性范围,故未进行计算,因而得出这部分药材中总多糖含量不高或提取方法未达到最优从而导致药材不能释放更多有效成分。
在实验过程中出现了发酵后有效成分产量低于未发酵产量,多糖含量过低等异常现象,就本实验而言,作出以下几点分析:
3.1 药物本身的原因 对药材本身而言不是所有中药都适合微生物发酵,曾有学者对五十多种药材进行枯草芽孢杆菌发酵实验[8],大部分药材的药效无显著变化,苦参等药材的药效大大降低,不能否认药效的降低与发酵中有效成分的减少无关,这也证实了本实验中经枯草芽孢杆菌发酵后几味中药的总黄酮和总多糖含量显著降低的现象。
中药本身的有效成分种类丰富,例如陈皮,富含黄酮类成分数十种,陈皮苷含量可占总含量的50%以上[9],本实验中陈皮的黄酮,多糖含量均呈现最高,陈皮苷也许由于微生物酶系水解释放出大量糖类物质,造成多糖含量高的现象[10];藿香中挥发油、萜类、酮类等作为主要有效成分[11],而多糖不作为主要成分[12],所以检测中液很有可能出现含量极低的现象。因此,检测不出成分或者含量多也有部分原因是因为该药物本身含量的问题。
3.2 菌种的种类及浓度的原因 微生物发酵中药需要注意的条件有很多,包括菌种的筛选,发酵工艺优化等等。微生物酶系种类繁多,因此发酵过程中对中药材的细胞影响程度不同,不同的酶系可引发的化学反应不同[13],有的可以有效破坏植物药细胞壁,利于胞质内有效成分释放;也有的可以催化形成新的物质,使某些成分发生生物转化或者破坏其结构,若有效成分因微生物酶系发生结构变化,也可能产生发酵后含量降低的情况。但对具体的微生物发酵机理尚未完全明确,有待进一步研究。
3.3 提取方法和试剂的原因 发酵条件的筛选对发酵工艺的成功与否也起到了至关重要的作用,本次实验采取乙醇冷凝回流法提取,测量提取液中黄酮及多糖含量,复盘实验操作有几点可以优化:
首先是料液比和菌的筛选,由于药物浓度和种类与菌群生长情况并非呈线性相关,而是存在峰值的,不同浓度中药对菌的生长和抑制情况不同,因此发酵达到的效果也会不同。王振华,潘康成[14]探究了不同浓度中药对枯草芽孢杆菌体外生长情况的影响,结果表明其中含药浓度为1%、0.5%、0.25%和 0.125%的黄芪和0.5%、0.25%、0.125%的红花对枯草芽孢杆菌表现出明显的促生长作用,但1%、0.5%、0.25%的木通和1%的川芎对枯草芽孢杆菌有抑制作用,此外,李平兰[15],魏林[16],丁轲[17]等学者也做出相关实验得出相关结论。
再者选择合适的提取试剂,例如本实验用乙醇回流提取,提取后过滤,取滤液测定多糖含量[5],而多糖溶于水不溶于乙醇,通常采用乙醇沉淀法提取多糖,本实验乙醇回流过程中很有可能将中药细胞内含有的多糖沉淀混入滤渣中造成多糖含量极少而难以测量的现象,即乙醇回流法不适用于提取多糖。刘雅雯[18]等学者用不同浓度乙醇,分级沉淀黄芪多糖,得到70%乙醇沉淀的粗多糖含量最高,几乎是其他梯度的总和,这也不难解释为何本实验多味中药出现多糖含量过低的现象。
4 结 论
枯草芽孢杆菌、乳酸杆菌发酵后会显著降低半枝莲、陈皮、甘草的总黄酮提取量,对藿香的影响不明显;经乳酸杆菌发酵后,显著提高半枝莲,甘草的总多糖提取量;枯草芽孢杆菌几乎不能促进以上中药的多糖释放。
就总黄酮含量而言,藿香、半枝莲、陈皮、甘草均不适合发酵,乳酸杆菌使藿香总黄酮提取量稍有增加,但效果不明显,枯草芽孢杆菌会造成上述中药总黄酮含量下降;就总多糖含量而言,甘草适合用乳酸杆菌发酵,藿香、半枝莲、陈皮不适合发酵,会造成总多糖含量下降。
综上所述,甘草适合进行乳酸杆菌的发酵,可以提高总多糖的含量;藿香、半枝莲、陈皮不适合发酵,会造成有效成分含量下降或无影响。
