一测多评法同时测定不同产地淫羊藿提取物中的4种黄酮类成份
2022-09-15吴蕾
吴 蕾
(安徽省兽药饲料监察所,合肥 230091)
淫羊藿是小檗科淫羊藿属EpimediumLinn.植物,始载于《神农本草经》,在我国有悠久的药用历史[1],具有补肾阳、强筋骨、祛风湿的功效,在养殖方面主要以提取物的形式应用以提高动物的生产、繁殖性能,其在混合型饲料添加剂市场有着广泛的应用。但目前淫羊藿提取物还缺乏统一的质量标准,亟需建立一个统一、全面、客观的淫羊藿提取物质量标准[2]。淫羊藿含多种药理活性成分如朝藿定A、朝藿定B、朝藿定C、淫羊藿苷等,这些成份进入体内后协同发挥作用,故其质量控制应综合考虑多种药理活性成分含量的测定,才能更加全面地反映提取物的内在质量。“一测多评法”(Quantitative Analysis of Multi-components with a Single-marker, QAMS)是近年来得到良好应用的中药类复杂成分评价方法,已在《中国药典》中成功应用于多个品种[3]。QAMS法通过测定一个易得有效成分而实现中药多成分定性定量,是适合中药特点的多指标质量控制和评价模式[4-6]。本研究以淫羊藿苷为内标物,建立朝藿定A、朝藿定B、朝藿定C与淫羊藿苷的相对校正因子(relative correlation factor, RCF),并对QAMS法与外标法所得结果进行比较,以验证QAMS法的可行性和准确性,旨在为淫羊藿提取物多指标成分质量控制提供参考。
1 仪器与试药
Agilent 1260高效液相色谱仪(美国安捷伦公司);D3000高效液相色谱仪(美国Thermofisher公司);Milli-Q超纯水机(美国Millipore公司);SQP十万分之一电子天平(德国Sartorius公司);KS500超声波清洗器(宁波科生仪器厂);VD23减压干燥箱(德国BINDER);恒温水浴锅(江苏金坛市金城国胜实验仪器厂)。
三批淫羊藿药材购自安徽省亳州康美中药大市场,产地分别为甘肃、吉林、陕西,样品经合肥市食品药品检验中心王玮主任药师鉴定,购自吉林的药材为朝鲜淫羊藿EpimediumkoreanumNakai,购自陕西、甘肃的药材为柔毛淫羊藿EpimediumpubescensMaxim,药材打粉经乙醇回流浓缩减压干燥后分别制备成提取物备用。另三批淫羊藿提取物由四川恒瑞通达生物科技有限公司提供,批号分别为200303、200302、200401。朝藿定A(批号110623-72-8)、朝藿定B(批号110623-73-9)、朝藿定C(批号110642-44-9)对照品均购自上海安谱有限公司,HPLC(峰面积归一化法)纯度98%;淫羊藿苷(批号110737-201516),购自中国兽医药品监察所,纯度94.2%。乙腈、甲醇(色谱纯,赛默飞世尔科技有限公司),其余试剂均为分析纯。
2 方法与结果
2.1 方法原理 QAMS法是指在多指标质量评价时,以药材中某一典型组分(有对照品供应者)为内标,建立该组分与其他组分之间的RCF,通过RCF计算其他组分的含量[7]。计算公式为:fkm=fk/fm=Wk×Am/Wm×Ak,Ak为内标物(k)峰面积,Wk为内标物(k)浓度,Am为其他组分(m)峰面积,Wm为其他组分(m)浓度。
2.2 方法学考察
2.2.1 色谱条件 eclipse Plus C18柱(150 mm×4.6 mm, 5 μm),流动相乙腈-水(25∶75),柱温25 ℃;流速1.0 mL/min,检测波长为270 nm,理论板数按淫羊藿苷计应≥5000,色谱图见图1、图2。
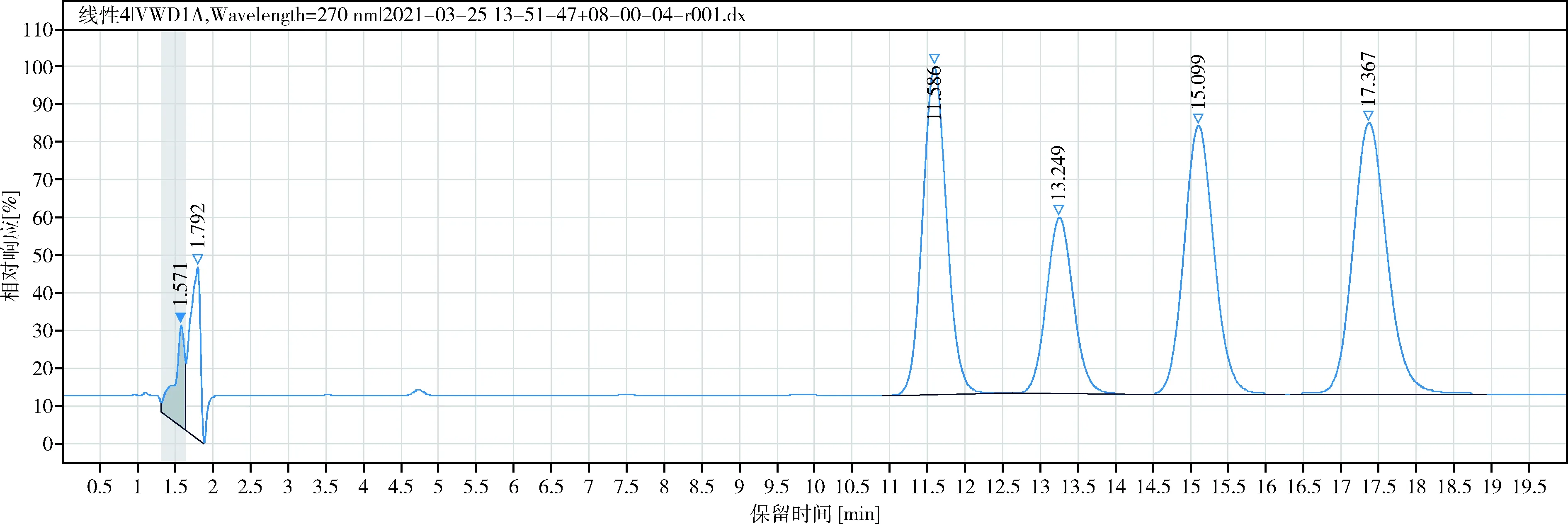
图1 朝藿定A、朝藿定B、朝藿定C、淫羊藿苷对照品色谱图Fig 1 HPLC chromatograms of Epimedin A, Epimedin B, Epimedin C and Icariin
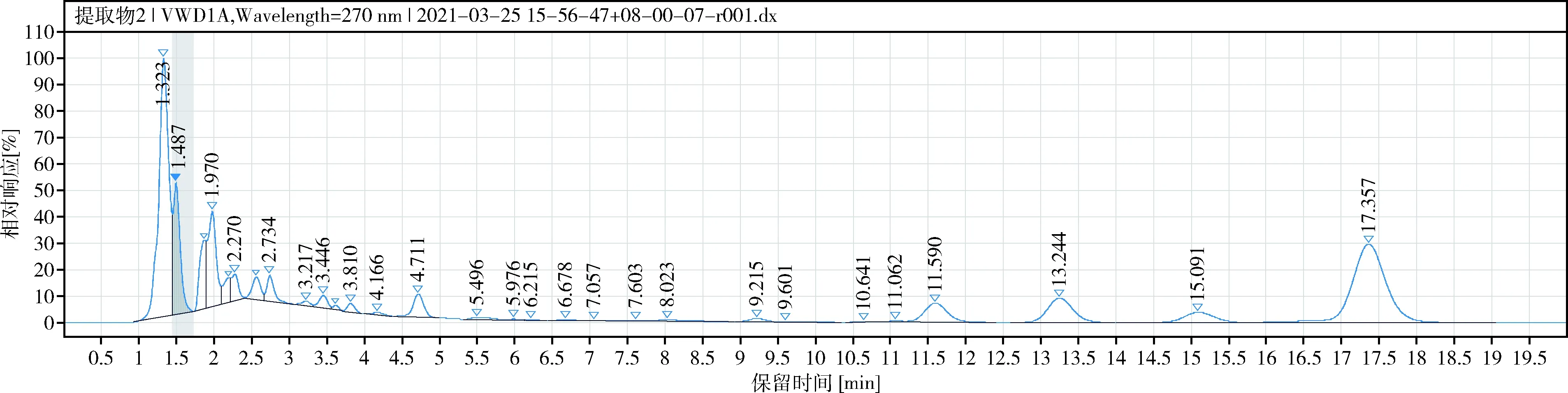
图2 淫羊藿提取物样品色谱图Fig 2 HPLC chromatograms of Epimedium extract
2.2.2 对照品溶液的制备 取朝藿定A、朝藿定B、朝藿定C、淫羊藿苷对照品适量,精密称定,加甲醇分别配置成浓度为1 mg/mL的储备液。精密吸取以上储备液各25 μL、50 μL、100 μL、200 μL、400 μL至10 mL量瓶中,甲醇定容,分别配置成2.5、5.0、10.0、20.0、40.0 μg/mL的混和线性标准溶液,保存于4 ℃冰箱中,备用,有效期1个月。
2.2.3 供试品溶液的制备 取淫羊藿提取物(过80目筛)0.1 g,精密称定,至具塞锥形瓶中,加入50 mL 50%乙醇溶液,称定重量,超声30 min(140 W,频率40 kHz),放冷后再称重,以50%乙醇补足重量,经0.45 μm微孔滤膜过滤,即得。
2.2.4 线性关系考察 分别精密吸取上述混合线性标准溶液10 μL,注入高效液相色谱仪,按上述色谱条件测定,记录峰面积。以进样量对峰面积积分值进行回归处理,分别得朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的标准曲线,见表1,各标准曲线在线性范围内线性良好。
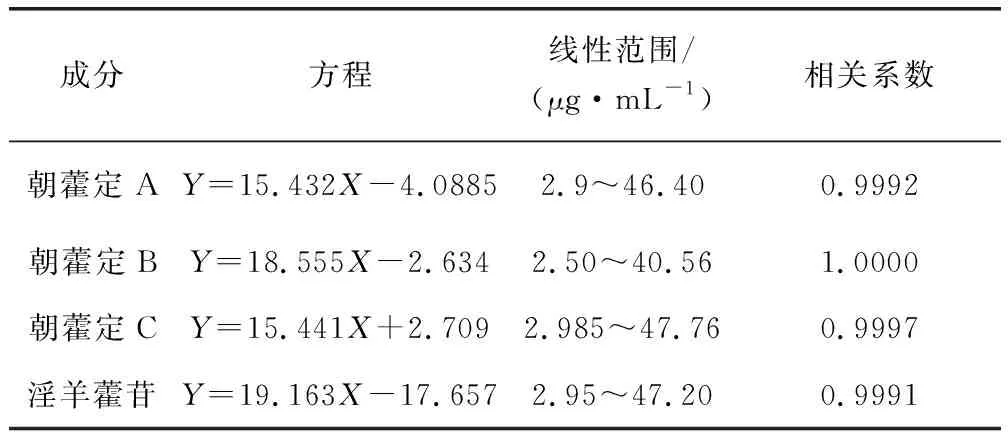
表1 淫羊藿提取物中4种黄酮类成分的标准曲线Tab 1 The regression equations and linear ranges of 4 chemical reference substances in Epimedium extract
2.2.5 精密度试验 精密吸取同一供试品溶液(四川恒通,批号200302)10 μL连续进样6次,记录朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的峰面积,得出日内精密度分别为2.3%、2.0%、2.4%和1.5%,连续进样3 d,每天6次,记录峰面积,以上4种指标成分日间精密度分别为2.3%、2.2%、2.0%、1.6%。
2.2.6 供试品溶液稳定性试验 取同一供试品溶液(四川恒通,批号200302),分别于配置后0、2、4、8、12、24 h注入高效液相色谱仪,依法测定,记录峰面积,得朝藿定A、朝藿定B、朝藿定C、淫羊藿苷稳定性的RSD分别为2.0%、1.9%、2.5%、1.5%,表明处理后的样品在24 h内稳定。
2.2.7 重复性试验 按上述供试品溶液制备方法,分别称取同一批淫羊藿提取物(四川恒通,批号200302)约0.1 g,共6份,分别进行测定, 测得朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的平均含量分别为3.88、8.05、6.18、14.01 mg/g,RSD分别为2.1%、2.1%、2.2%、1.1%。
2.2.8 回收率试验 采取加样回收率法(按1∶1加入),取同一批已知含量的淫羊藿提取物(四川恒通,批号200302)约0.1 g共6份,精密称定,分别精密加入一定量的2.2.2项下混合对照品溶液,按2.2.3项下方法制备供试品溶液,精密吸取上述供试品溶液10 μL,依法测定,计算回收率,朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的加样回收率分别为93.6%、95.5%、100.1%、92.4%,RSD分别为2.2%、1.8%、2.2%、2.1%。
2.3 校正因子的测定及考察
2.3.1 校正因子的测定 取2.2.2项下浓度为20 μg/mL对照品混合溶液,分别进样10 μL,测定朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的峰面积,按照2.1项下方法分别计算朝藿定A、朝藿定B、朝藿定C与内参物淫羊藿苷间的RCF,结果见表2。
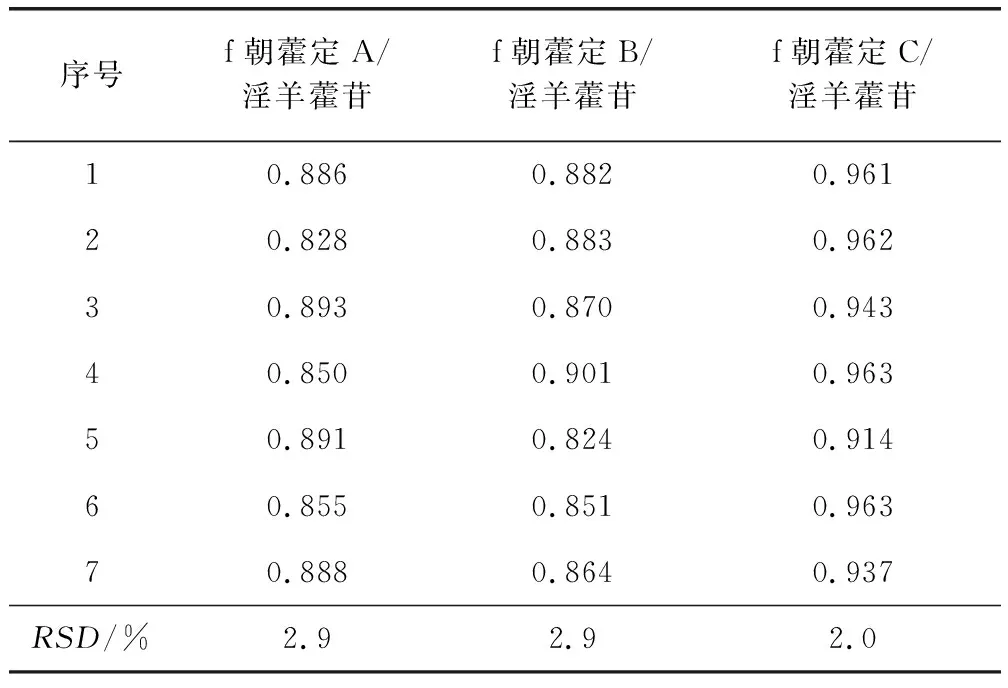
表2 相对校正因子的测定Tab 2 Results of the RCFs tests
2.3.2 校正因子的重复性试验 按照2.2.2项下方法,配制混合对照品溶液,平行4份,分别进样10 μL,分别计算朝藿定A、朝藿定B、朝藿定C与内参物淫羊藿苷间的RCF。表3结果显示,RSD≤3.0%,表明RCF重复性良好。
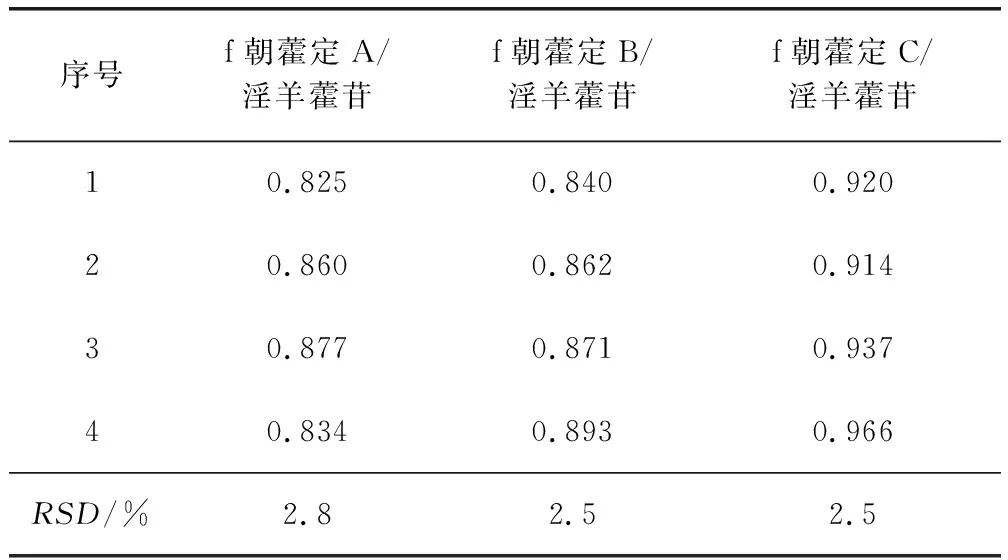
表3 相对校正因子重复性试验Tab 3 Results of RCFs repeatability tests
2.3.3 校正因子的耐用性考察
2.3.3.1 不同仪器对校正因子的影响 试验中采用eclipse plus C18(4.6 mm×150 mm,5 μm)分别在Agilent 1260和Thermofisher D3000进样测定,对淫羊藿类黄酮间的RCF进行了测定。表4结果显示,在不同品牌色谱仪上RCF无显著性差异,RSD≤3.0%。
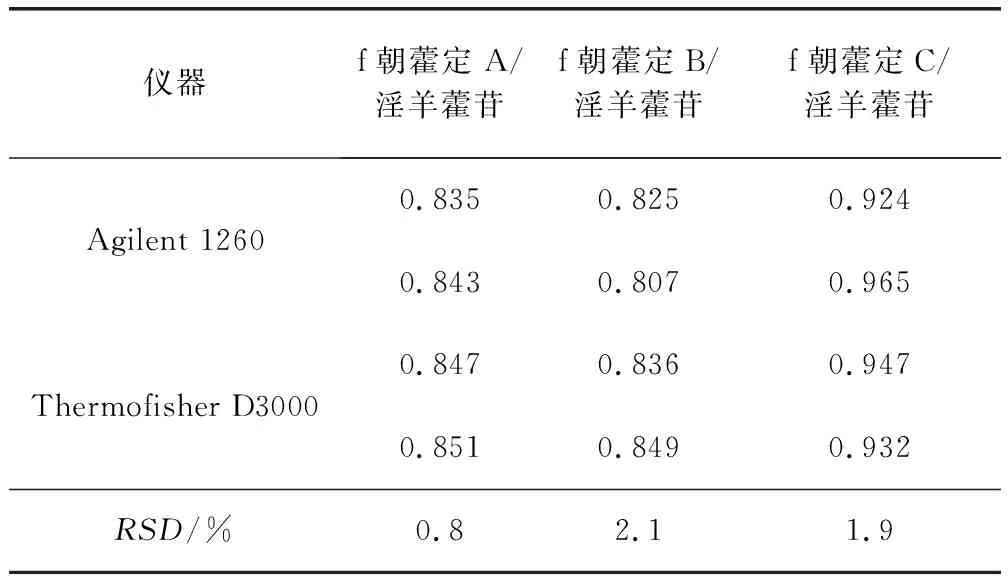
表4 采用不同仪器测得的相对校正因子Tab 4 RCFs measured in different instruments
2.3.3.2 不同色谱柱对校正因子的影响 试验中在不同高效液相色谱仪(Agilent 1260、Thermofisher D3000)上,分别试验2种不同品牌的色谱柱eclipse plus C18(4.6 mm×150 mm, 5 μm)和Symmetry C18(4.6 mm×250 mm, 5 μm),对4种淫羊藿类黄酮间RCF进行了测定。结果显示,RCF无显著性差异,RSD≤3.0%(表5和表6)。
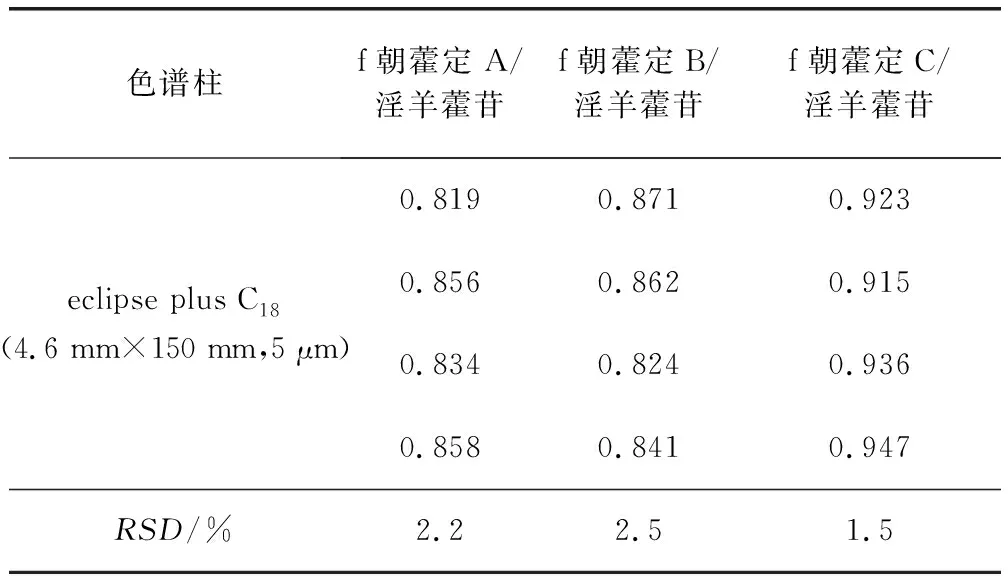
表5 采用不同色谱柱测得的相对校正因子-Agilent 1260Tab 5 RCFs measured in different chromatographic columns-Agilent 1260
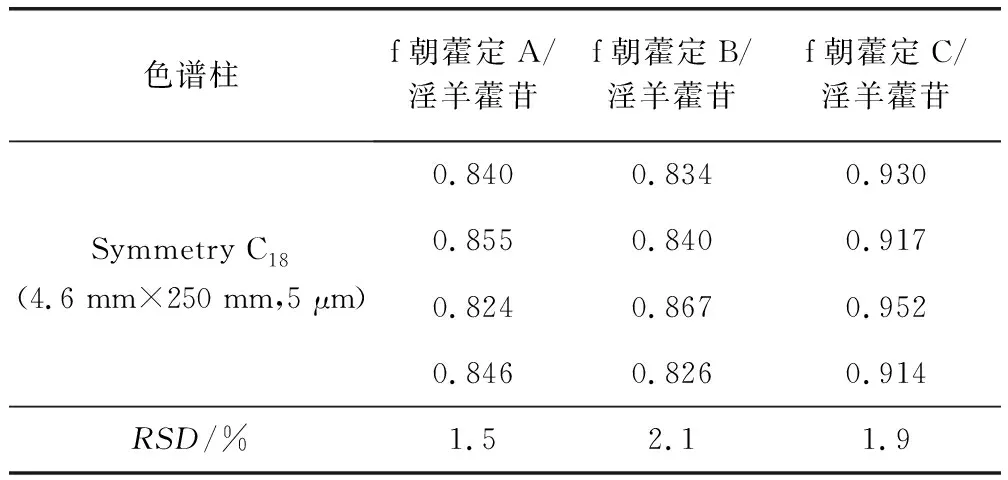
表6 采用不同色谱柱测得的相对校正因子-Thermofisher D3000Tab 6 RCFs measured in different chromatographic columns-Thermofisher D3000
2.3.3.3 不同柱温对校正因子的影响 采用Agilent 1260高效液相色谱系统和eclipse plus C18色谱柱,分别在不同柱温(25、30、35 ℃)条件下对4种淫羊藿黄酮间的RCF进行测定。表7结果显示,RCF无显著性差异,RSD≤3.0%。
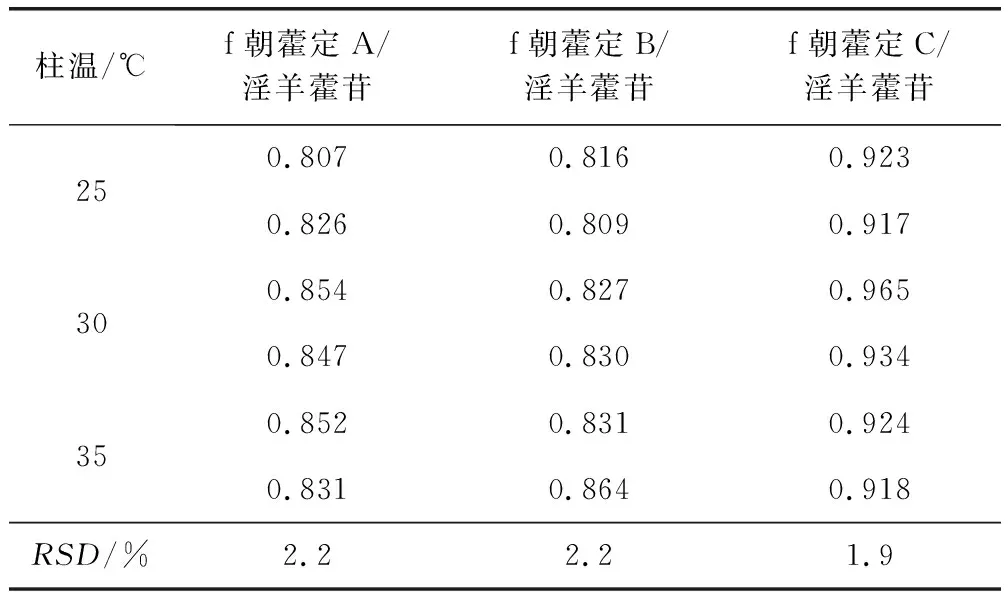
表7 采用不同柱温测得的相对校正因子Tab 7 RCFs measured at different temperatures
2.3.3.4 不同流速对校正因子的影响 采用Agilent 1260高效液相色谱系统和eclipse plus C18色谱柱,分别在不同流速(0.9、1.0、1.1 mL/min)条件下对4种淫羊藿黄酮间的RCF进行了测定。表8结果显示,RCF无显著性差异,RSD≤3.0%。

表8 采用不同流速测得的相对校正因子Tab 8 RCFs measured at different flow rates
2.3.3.5 校正因子的确定 在上述色谱条件下,分别测定不同进样体积时,按照2.1项下的方法,以淫羊藿苷(Icarrin,简称I)为内标, 计算朝藿定A(Epimedin A,简称A)、朝藿定B(Epimedin B,简称B)、朝藿定C(Epimedin C,简称C)的RCF分别为0.831、0.820、0.918。
2.4 待测组分色谱峰的定位 本文采用相对保留值(待测成分与内标调整保留时间之比)作为定位标准,并在不同品牌高效液相色谱系统和不同色谱柱下对此参数进行考察,见表9,各成分的相对保留值波动较小,RSD≤3.0%,表明利用相对保留值进行峰的定位是可行的。
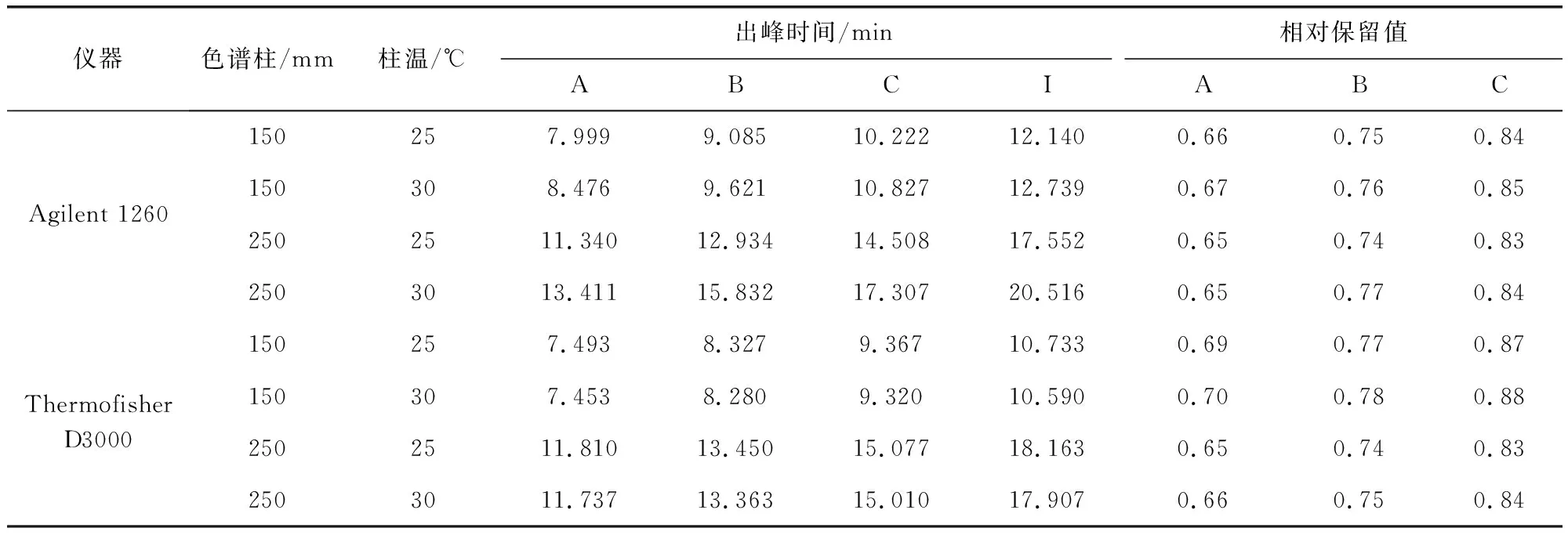
表9 不同仪器和色谱柱下测得的相对保留值Tab 9 Relative retention values measured in different instruments and columns
2.5 淫羊藿提取物含量测定QAMS法与外标法的结果比较 分别称取淫羊藿提取物(过80目筛)约0.1 g (n=4),精密称定,按2.2.3项下方法制备各供试品溶液,精密吸取各供试品溶液10 μL,注入高效液相色谱仪,依法测定。采用外标法和QAMS法计算自提及市售的淫羊藿提取物中朝藿定A、朝藿定B、朝藿定C、淫羊藿苷含量,见表10。外标法测定的含量值与QAMS法测定的含量值经t检验比较,P>0.05,表明这两种方法测得结果无显著性差异,由此说明QAMS法可用于淫羊藿提取物的多成分质量评价研究。

表10 不同方法所测得的黄酮类物质含量(n=2)Tab 10 Positioning results of the 4 analytes measured by QAMS and ESM methods mg/g
3 讨论与结论
本试验初期分别以50%甲醇、50%乙醇、70%甲醇、70%乙醇4种提取溶剂进行超声提取,发现以50%乙醇提取30 min具有相对较高的提取率。另外通过查阅文献,分别以乙腈-水、乙腈-0.02%磷酸溶液、乙腈-0.05%磷酸溶液等为流动相,比较其峰型、基线、分离度等,发现乙腈-水作为流动相既简便又可满足分离需求,故根据结果分析,确定了色谱条件。
本试验还分别考察了不同色谱柱、不同仪器下各待测组分色谱峰的保留时间及相对保留时间,结果显示各保留时间差异显著,但其与内标物的相对保留时间波动较小。因此采用相对保留时间法进行淫羊藿药材中各待测组分色谱峰的定位。
中药成分的多样性和整体作用机理,决定了单一成分不能全面反映中药材的质量。以《中国药典》为代表的中药质量标准已经确立了“从单指标向多指标、从指标性成分向药效成分控制”的发展方向[8-9]。QAMS法可以实现通过测定一种成分的含量达到多指标控制的目的,能够一定程度上解决中药对照品供应紧缺、价格昂贵等问题。在《中国药典》中,QAMS法已成功应用于丹参、生姜等药材,是目前中药质量控制和评价模式新的发展趋势之一[3]。淫羊藿含多种活性成分,仅依据淫羊藿苷对其进行质量评价,无法真实评价其内在质量,且淫羊藿经历提取过程转换成提取物后,不同厂家提取工艺、水平不同将极大的影响提取物的质量及药理活性,故其质量评价需要一个多指标综合性评价方式。本试验通过一系列方法学考察证明了QAMS法能够综合反映淫羊藿提取物的整体质量且不提高分析成本,验证了QAMS法在淫羊藿提取物质量控制中的可行性和适应性,为此类中药的质量控制及质量标准的制订提供了参考方法。
