督脉电针联合重复经颅磁刺激对脊髓损伤后大鼠脊髓BDNF及其受体TrkB和p75NTR表达的影响
2022-09-15李志刚时素华姚海江孙润权曹祖懋刘思远刘奕志
叶 青,李志刚△,时素华,姚海江,胡 煜,孙润权,曹祖懋,刘思远,刘奕志,王 帅
(1.北京中医药大学,北京 100029;2.北京中医药大学第三附属医院,北京 100029;3.中国康复研究中心 北京博爱医院,北京 100068)
脊髓损伤(Spinal Cord Injury,SCI)是一种具有高致残率和高死亡率的神经创伤性疾病。由此可以引发如缺血、氧化应激、炎性事件、凋亡途径和运动障碍等一系列的并发问题,导致严重的运动、感觉功能障碍、反射异常以及自主神经功能紊乱[1]。原因主要有交通事故、跌倒或暴力等。根据世界卫生组织的报道,全世界每年大约有25~50万人受到脊髓损伤的影响[1]。一项中国创伤性脊髓损伤住院患者流行病学调查数据显示[2]:2018年俄国三级医院脊髓损伤住院患者约为72 907例,平均年龄为51.6岁,男性是女性的3倍,高处坠落是最常见的原因,其次是跌倒。治疗脊髓损伤的平均费用在23 228~53 783元不等,单次住院费用最高可达30万元,给患者及其家庭乃至社会带来严重经济负担[3]。脊髓损伤机制主要分为原发性损伤和继发性损伤[3]。其潜在的治疗策略主要包括增强神经保护、减少继发性损伤以及通过激活神经元再生能力、改善微环境等来促进再生修复[4]。其中脊髓损伤后,神经营养因子(Neurotrophic factors,NTFs)的缺乏是导致再生失败的主要原因之一。神经营养因子通常是通过轴浆运输以受体介导的方式进入神经末梢,以此来促进胞体有关蛋白质的合成以及神经细胞的再生、发育和功能恢复[5]。脑源性神经营养因子(Brain-derived Neurotrophic Factor,BDNF)是目前实验性脊髓损伤中研究最多的神经营养因子。电针能有效抑制脊髓损伤后的炎症反应和细胞凋亡相关因子、促进神经元轴突再生和功能恢复和减少胶质瘢痕形成等[6]。重复经颅磁刺激(repetitive TMS, rTMS)是连续给予一定频率脉冲作用于脊髓损伤患者的运动皮层,使之产生的感应电流激活上运动神经元,进一步诱发神经冲动的过程。rTMS 在临床研究发现:rTMS对于脊髓损伤患者的运动呼吸功能与消化功能都有所改善,还具有镇痛作用、防止肌萎缩及痉挛等作用[7-10]。本研究从神经再生的角度,选择不同时间点观察 SCI大鼠神经功能、组织病理形态、脑源性神经营养因子(Brain-derived Neurotrophic Factor,BDNF)、原肌球蛋白受体激酶B((Tropomyosin receptor kinase B,TrkB)与p75神经营养素受体(p75neurotrophinreceptor ,p75NTR)的表达情况,探讨电针联合经颅磁刺激治疗SCI的可能作用机制。
1 材料与方法
1.1 实验动物与分组
清洁级6周龄SD雄性大鼠120只,体质量(220±20)g,由维通利华(北京)实验动物科技有限公司提供[生产许可证证号:SCXK(京)2016-0006],北京中医药大学良乡校区清洁级动物房饲养,温度为(25±3)℃,湿度(45±10)%,自由饮水进食,12 h昼夜规律调整,适应性喂养3 d后开始进行实验。根据随机数字表法将SD大鼠随机分为6组:空白组(12只)、假手术组(12只)、模型组(24只)、电针组(24只)、经颅磁刺激组(24只)和联合组(24只)。模型组、电针组经颅磁刺激组及联合组再按干预1 d、7 d分为两个亚组,每个亚组12只。实验过程中对动物处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准。
1.2 主要试剂与仪器
1.2.1 试剂 rabbit anti-BDNF(美国Abcam公司ab108319);rabbit anti-TrkB(美Abcam公司ab187041);rabbit anti-p75(美国Abcam公司ab52987);4%组织细胞固定液(北京酷来搏科技有限公司);苏木素伊红(HE)染色试剂盒(北京索莱宝科技有限公司);兔二步法检测试剂盒(北京中杉金桥生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司);Western Blotting检测试剂盒(中国江苏凯基生物技术股份有限公司)。
1.2.2 仪器 Allen’s打击装置(北京协和医学院微循环研究所);CP-8000科德士宠物用电推剪(深圳市科德士电器有限公司);韩氏电针仪(北京华卫产业开发公司);华佗牌针灸针(苏州医疗用品厂有限公司);经颅磁刺激仪(武汉依瑞德医疗设备新技术有限公司);电热鼓风干燥箱(天津市泰斯特仪器有限公司);RM2235 组织切片机(德国 LEICA公司);BX53自动化智能型正置研究级显微镜(日本OLYMPUS公司);移液器(德国 eppendorf);电泳仪(美国 Bio-rad Power Supplies Basic);台式恒温振荡器(中国上海精宏实验设备有限公司 THZ-312)多功能酶标仪(美国MD Spectramac M3);PH计(美国OHAUS STARTER 2C);分析天平(中国精密分析天平JA3003)。
1.3 模型制备
大鼠术前禁食禁水8 h,紫外灯消毒动物手术室30 min,手术器械消毒,手术室温度不低于20 ℃。模型组、电针组、经颅磁刺激组及联合组腹腔注射麻醉后,固定于自制的弓形手术台上,剔除背部T9~11及周围毛发。消毒后分离背部肌肉、深筋膜,依次暴露T9~11段棘突和椎板,暴露脊髓;采用改良式Allen’s打击装置[11]:将10 g打击锤套入钢管内高度为5 cm,致伤量为50 g/cm,造成T10~11节段脊髓损伤,此致伤量可造成大鼠的不完全性截瘫,属中等程度损伤。快速缝合伤口。大鼠清醒后,模型组造模后不进行任何治疗;假手术组只暴露脊髓,不损伤,随后缝合伤口。术后单笼饲养、定时膀胱挤压帮助排尿。模型评价成功标准为身体痉挛性颤动、尾巴痉挛性摆动、硬脊膜内充血或血肿和麻醉醒后双下肢表现为不完全瘫痪。
1.4 治疗方法
1.4.1 空白组、模型组和假手术组 相同饲养条件下不做任何处理,模型组及假手术组造模后也不做任何处理,但均要在重复经颅磁刺激组、联合组治疗时抓取1次,以保证处理条件相同。
1.4.2 电针组 参照《大鼠穴位图谱的研制》[12]选取相当于人体解剖部位的“大椎”(第7颈椎棘突下,向下斜刺)、“命门”(第2腰椎棘突下,向上斜刺)。用华佗牌规格Φ 0.25 mm×15 mm毫针进行针刺,进针约0.5~0.7 cm。针柄连接韩氏LH-202H型电疗仪,上接阴极,下接阳极,持续脉冲电流,频率2 Hz,强度2 mA,治疗时间20 min,输出强度在刚开始时以背部肌肉出现轻微抽动为度,待其适应后则以双下肢瘫痪肌肉出现有节律的收缩为度。1 d组于造模清醒后治疗1次,7 d组于造模后与1 d组同一时间每天重复治疗1次,持续到达预定时间。
1.4.3 经颅磁刺激组 采用YRD CCY-I型磁刺激仪,脉冲磁场峰值强度为3 T。造模1 d后,将大鼠置于固定器中,头部固定,圆形线圈磁场中心置于大鼠左前囟上方,应用90%静息运动阈值(造模前,测量大鼠的运动阈值,结果示运动阈值为最大脉冲强度的21%),刺激频率5 Hz。每序列2 s,间歇28 s,共15 min。1 d组于造模清醒后2 h治疗1次,7 d组于造模后与1 d组同一时间每天重复治疗1次,持续到达预定时间[13]。
1.4.4 联合组 干预方法同电针组加经颅磁刺激组治疗。
1.5 取材及指标检测
1.5.1 行为学检测 运用运动功能BBB[14]计分法对大鼠脊髓损伤进行评估,将大鼠后肢运动分为22个等级,后肢全瘫为0分,完全正常为21分。综合评定大鼠脊髓损伤后的功能,包括感觉、运动、反射及肢体动作协调等方面。
1.5.2 组织取材 在行为学检测结束后立即取材。取每组6只大鼠腹腔注射麻醉后开胸,暴露心脏,用灌注针从左心室心尖部插入直至主动脉,灌注生理盐水约240 mL后灌注4%多聚甲醛溶液约280 mL,取出损伤脊髓节段,约长1 cm,放入4%多聚甲醛溶液中固定,随后进行脱水,石蜡包埋,切片,厚4 μm,用于HE染色和免疫组化。取剩余每组大鼠6只,麻醉后剪下损伤脊髓节段,放于液氮中,后保存于-80 ℃冰箱待蛋白检测。
1.5.3 HE染色法观察大鼠脊髓形态变化 将制备好的石蜡切片常规脱蜡、水化后浸入苏木素染色液5 min,纯水冲洗后浸入伊红染色液1 min,再洗,镜下观察着色情况,必要时加入0.5%盐酸乙醇1~2 s,中性树胶封片。采用400×光学显微镜下观察大鼠脊髓组织形态结构变化。
1.5.4 免疫组织化学法检测损伤脊髓BDNF、TrkB和p75NTR阳性表达 石蜡切片常规脱蜡、水化后行抗原修复,滴加3%过氧化物酶阻断液浸泡10 min,滴加 150 μL一抗(BDNF1∶500,TrkB1∶250,P75NTR1∶250),4 ℃过夜;滴加反应增强液150 μL 10 min,滴加150 μL酶标抗兔IgG聚合物10 min,避光条件下滴加DAB显色液反应5 min,自来水冲洗10 min。苏木素复染,1%盐酸酒精分化,自来水冲洗浸泡,脱水,透明,中性树胶封片,400×光学显微镜下观察。
1.5.5 Western blot法检测损伤脊髓BDNF、TrkB和p75NTR蛋白表达 取损伤脊髓组织80 mg,加200 μL RIPA裂解液(含蛋白酶抑制剂)后匀浆,提取蛋白。计算样品蛋白浓度,金属浴95 ℃变性10 min。制备SDS-PAGE凝胶,上样、电泳和转膜,5%脱脂奶粉封闭2 h,4 ℃过夜孵育一抗(rabbit anti-GAPDH 1∶1 000,BDNF 1∶1 000,TrkB 1∶1 000,P75NTR1∶1 000);洗膜,孵育二抗。均匀滴加ECL超敏化学发光液,于ECL成像系统曝光拍照,定量分析各蛋白条带灰度值。
1.6 统计学处理
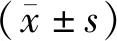
2 结果
2.1 BBB评分法评估大鼠后肢运动神经功能
空白组与假手术组大鼠后肢功能正常,差异无统计学意义(P>0.05),排除手术对于模型的影响;与空白组比较,1 d、7 d模型组BBB评分均显著下降,差异具有统计学意义(P<0.05);1 d时:各组BBB评分差异无统计学意义(P>0.05);7 d时:与模型组和经颅磁刺激组比较,电针组和联合组BBB评分显著升高,差异具有统计学意义(P<0.05);与电针组比较,联合组BBB评分显著升高,差异具有统计学意义(P<0.05)。见表1。
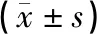
表1 各组大鼠干预后不同时间BBB评分比较
2.2 各组大鼠脊髓HE染色
在HE染色中,图像细胞质呈粉红色淡染,细胞核呈蓝色深染。空白组和假手术组大鼠脊髓组织神经细胞结构完整,核仁清晰。组织结构排列紧密,未见空洞、出血等。干预1 d,模型组可见脊髓组织结构被破坏,组织坏死,细胞皱缩,灰、白质分界不清,中央管结构紊乱,白质神经纤维肿胀增粗,排列紊乱,灰质内红细胞大量聚集,细胞间质水肿,细胞核固缩、破碎等,并可见明显的空泡。电针组、经颅磁刺激组、联合组与模型组病理改变相似;干预7 d,模型组可见白质与灰质的边界仍然模糊不清,内有固缩、破碎的细胞核,白质神经纤维结构肿胀明显,灰质内出血减少。电针组、联合组较模型组组织结构更加完整,空洞减少,可观察到更多结构正常细胞,整体修复情况优于模型组。见图1。
2.3 各组大鼠脊髓BDNF表达比较
脊髓经免疫组织化学法染色,BDNF免疫阳性产物主要在脊髓组织的运动神经元中表达,以胞浆着色为主,呈现棕黄色的,空白组和假手术组中可见分布于胞浆的棕黄色小颗粒。空白组与假手术组BDNF蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组BDNF蛋白表达均显著下降,差异具有统计学意义(P<0.05);1 d时:各组BDNF蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组和经颅磁刺激组比较,电针组和联合组大鼠脊髓组织中BDNF蛋白表达显著升高,差异具有统计学意义(P<0.05);与电针组比较,联合组大鼠脊髓组织中BDNF蛋白表达显著升高,差异具有统计学意义(P<0.05)。见图2、表2。
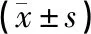
表2 各组大鼠干预后损伤脊髓组织BDNF阳性表达比较
Western blot法检测显示,空白组与假手术组BDNF蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组BDNF蛋白表达均显著下降,差异具有统计学意义(P<0.05);1 d时:各组BDNF蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组比较,经颅磁刺激组BDNF蛋白表达微升高,差异具有统计学意义(P<0.05),与模型组和经颅磁刺激组比较,电针组和联合组大鼠脊髓组织中BDNF蛋白表达显著升高,差异具有统计学意义(P<0.05);与电针组比较,联合组大鼠脊髓组织中BDNF蛋白表达显著升高,差异具有统计学意义(P<0.05)。见图3、表3。
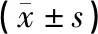
表3 各组大鼠干预后损伤脊髓组织BDNF蛋白表达比较
2.4 各组大鼠脊髓TrkB表达比较
脊髓经免疫组织化学法染色,TrkB免疫阳性产物主要在脊髓组织的运动神经元中表达,主要集中在胞膜、胞质,呈现棕黄色,空白组与假手术组中可见分布于胞膜、胞质的棕黄色小颗粒。空白组与假手术组TrkB蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组TrkB蛋白表达量均显著变化,差异具有统计学意义(P<0.05);1 d时:各组TrkB蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组与经颅磁刺激组比较,电针组和联合组TrkB蛋白表达显著升高,差异具有统计学意义(P<0.05);与电针组比较,联合组TrkB蛋白表达显著升高,差异具有统计学意义(P<0.05)。见图4、表4。
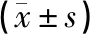
表4 各组大鼠干预后损伤脊髓组织TrkB阳性表达比较
Western blot法检测显示,空白组与假手术组TrkB蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组TrkB蛋白表达量均显著下降,差异具有统计学意义(P<0.05);1 d时:各组TrkB蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组和经颅磁刺激组比较,电针组和联合组TrkB蛋白表达显著升高,差异具有统计学意义(P<0.05);与电针组比较,联合组TrkB蛋白表达显著升高,差异具有统计学意义(P<0.05)。见图5、表5。
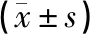
表5 各组大鼠干预后损伤脊髓组织TrkB蛋白表达比较
2.5 各组大鼠脊髓p75NTR表达比较
p75NTR的免疫阳性产物主要在脊髓组织的运动神经元中表达,其亚细胞定位主要位于阳性细胞的胞浆,呈现棕黄色。空白组与假手术组p75NTR基本不表达或表达较少,当受到刺激或应激状态下被诱导进而介导细胞凋亡。空白组与假手术组p75NTR蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组p75NTR蛋白表达量均显著上升,差异具有统计学意义(P<0.05);1 d时:各组p75NTR蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组和经颅磁刺激组比较,电针组与联合组p75NTR蛋白表达显著下降,差异具有统计学意义(P<0.05);与电针组比较,联合组p75NTR蛋白表达显著下降,差异具有统计学意义(P<0.05)。见图6、表6。
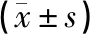
表6 各组大鼠干预后损伤脊髓组织p75NTR阳性表达比较
Western blot法检测显示,空白组与假手术组p75NTR蛋白表达差异无统计学意义(P>0.05);与空白组比较,1 d、7 d模型组p75NTR蛋白表达量均显著上升,差异具有统计学意义(P<0.05);1 d时:各组p75NTR蛋白表达差异无统计学意义(P>0.05);7 d时:与模型组比较,电针组和联合组p75NTR蛋白表达显著下降,差异具有统计学意义(P<0.05);与经颅磁刺激组比较,联合组p75NTR蛋白表达显著下降,差异具有统计学意义(P<0.05)。见图7、表7。
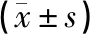
表7 各组大鼠干预后损伤脊髓组织p75NTR蛋白表达比较
3 讨论
BDNF是1982年Barde等从猪脑中分离出的一种神经元存活诱导因子[15]。在治疗脊髓损伤中作为细胞存活和神经突起生长促进剂具有非常大的潜力作用[16]。BDNF在脊髓损伤中发挥作用的途径主要是通过相应受体结合来激活细胞内多种下游信号通路[17]。TrkB是BDNF具有高亲和力的特异性受体(酪氨酸激酶受体)[18]。BDNF诱导的TrkB信号可能通过经磷脂酰-3激酶( P1-3K ) /Akt通路、Ras/细胞外信号调节激酶(ERK)途径、磷脂酶C-γ( PLC-γ) /3-磷酸肌醇(IP-3)通路和N-甲基-D-天冬氨酸(NMDA)受体的磷酸化等途径来实现促进的轴突生长以及细胞内环境的改善[19-22]。另一方面,BDNF与p75NTR结合可以通过激活p53来激活Jun N末端(JNK)激酶,触发细胞死亡,通过JNK非依赖性机制触发促凋亡级联反应[23-24]。
《灵枢·寒热病》关于“体惰”的描述:“身有所伤血出多,及中风寒,若有所堕坠,四肢懈惰不收,名曰体惰。”与现代医学对于脊髓损伤的描述极为相似。《难经·二十八难》云:“督脉者,起于下极之俞,并于脊里,上至风府,入属于脑。”督脉与脊髓并行于脊柱之中,伤其脊骨是表象,损其督脉是实质,故脊髓病变当求治于督脉[25]。督脉电针治疗脊髓损伤能够促进轴突的生长、功能的恢复和抑制细胞凋亡因子等[26]。冯红霞等[27]发现电针“大椎”“命门”穴结合康复训练能改善不完全性脊髓损伤的感觉、运动功能,效果优于单纯的康复训练。经颅磁刺激(TMS)技术是1985年由Barker及其助手创立的,其原理是利用交变磁场产生的感应电流,对运动皮层产生电流刺激,同时对于运动皮层诱发电位作出相应记录[28]。重复经颅磁刺激治疗脊髓损伤的可能机制有:TMS刺激大脑皮层激活上运动神经元,进而诱发神经冲动在皮质脊髓束传导;TMS能够直接刺激中枢神经,实现对大脑皮层的重塑,刺激运动通路,进一步增强瘫痪肢体的功能[29]。Hoffman采用经颅磁刺激对四肢瘫痪的患者进行了为期3周的实验,研究表明患者运动皮层的投射面积增加,说明经颅磁刺激可以诱发皮层功能改变[30]。临床研究发现,rTMS可以改善患者的呼吸、消化和运动功能,具有镇痛的作用[31-34]。电针和经颅磁刺激一样都具有安全可靠、无痛、无创、操作便捷和可重复等优点。
本实验选取1 d和7 d两个时间点,希望更好地观察脊髓损伤后大鼠行为学及其各项生物学检测指标在急性期1 d的变化,以及随着干预次数和时间的增加,在脊髓损伤反应期7 d的指标变化和电针组、重复经颅磁刺激组和联合组的效果对比。结果表明1 d时相较于模型组,电针组、重复经颅磁刺激组和联合组对比大鼠行为学及其各生物学检查指标的效果差异不明显,而在7 d时电针组和联合组的结果有统计学差异,重复经颅磁刺激组也有所提高,这与前期研究相一致[35-36]。通过1 d和7 d比较可知,首先大鼠自身具有一定的自愈能力。而进行督脉电针、重复经颅磁刺激或是两者的联合治疗能加速它的恢复。
本实验通过BBB评分,对脊髓损伤大鼠后肢功能进行行为学评价,可知在7 d的时间点时,各干预组大鼠后肢功能相较于模型组评分有所提高,电针组和联合组有显著改善,说明其可以改善脊髓损伤大鼠神经功能损伤症状,重复经颅磁刺激组的改善不显著,但具有一定的上升趋势,在下一步的研究中可以延长干预时间,观察重复经颅磁刺激在脊髓损伤恢复期。HE染色观察脊髓也能看到在7 d的时间点时,神经元边缘开始清晰,出现小胶质细胞的增生,但是脊髓灰质和白质边界仍不清晰,损伤部位组织结构致密程度有所改善。但相对于正常大鼠水平,仍有一定的差距。免疫组织化学法和Western blot法的检查结果基本一致。在7 d的时间点时,可见在对BDNF、TrkB及p75NTR的蛋白表达影响方面,联合组的效果优于电针组;电针组的效果优于重复经颅磁刺激组和模型组;重复经颅磁刺激组与模型组比较,效果不显著。
综上所述,本实验观察电针联合重复经颅磁刺激对脊髓损伤大鼠BDNF及其受体TrkB和p75NTR表达的影响,探讨单纯电针或重复经颅磁刺激在脊髓损伤中发挥的作用,以及联合治疗是否能够比单纯电针或重复经颅磁刺激在该实验中效果更好。结果表明电针相对单纯经颅磁刺激在大鼠脊髓损伤的反应期效果更好,联合治疗对比单纯电针的效果更显著。说明督脉电针联合重复经颅磁刺激可改善脊髓损伤大鼠神经功能损伤症状,促进受损脊髓的出血减少、神经元再生,其机制可能与上调激素中BDNF及TrkB以及下调p75NTR的表达有关。
