透明质酸结合蛋白1和细胞周期蛋白A在子宫内膜癌组织中表达及临床意义*
2022-09-14张金玲王莉菲梁秀云
杨 琳,张金玲,王莉菲,梁秀云
深圳市人民医院·暨南大学第二临床医学院·南方科技大学第一附属医院妇科,广东 深圳 518020
子宫内膜癌是女性生殖系统常见的恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%。近年来,子宫内膜癌在世界范围内的发病率有上升及年轻化趋势,是威胁女性健康重要的疾病之一[1-4]。子宫内膜癌的病因并不十分清楚,越来越多的学者认为,所有导致肿瘤的机理是直接或间接影响了细胞周期调控因子的正常运转,细胞周期持续演进,细胞进入自主的无约束的增殖和分裂,表现出旺盛的增殖活性进而产生恶性转化。因此,段光明等[5]认为肿瘤是一类细胞周期病。透明质酸结合蛋白1(hyaluronan binding protein 1, HABP1)和细胞周期蛋白A(Cyclin A)都是细胞周期的正向调节因素,其表达规律的改变是细胞周期破坏的重要特征之一。HABP1是一种多功能蛋白,其独特的晶体结构和多种生物学特性,可以与多种细胞蛋白发生作用。是线粒体凋亡信号通路的一个重要调节因子,涉及介导细胞—细胞及细胞—基质间的黏附、细胞信号的转导等方面。近年来的研究发现[6-8],HABP1 在一些肿瘤组织中呈现异常表达,同时参与某些肿瘤的转移和侵袭过程,而且与化疗药物诱导的细胞凋亡存在着密切关系。Cyclin A 是细胞周期驱动机制中的一个重要调控因子,其异常表达可导致细胞周期调节失控,促进细胞在DNA复制不完全时即进入M 期,从而直接或间接地导致细胞的恶性转化和肿瘤的形成。HABP1 和Cyclin A 在多种肿瘤组织中呈现异常表达(如肝癌、食管癌、乳腺癌等),参与肿瘤的转移和侵袭过程,并可以预示肿瘤的生物学行为和临床结果。直到现在,国内外尚无关于HABP1和Cyclin A在子宫内膜癌组织表达相关性的研究报道。本研究拟通过采用免疫组织化学染色法检测Cyclin A及HABP1在正常子宫内膜、非典型增生子宫内膜、子宫内膜腺癌中的表达,研究和探讨其表达水平与子宫内膜腺癌临床病理参数之间的关系,进一步探究二者之间有无关联性,以期初步求证Cyclin A 及HABP1 可否成为早期预测子宫内膜癌发生和判断子宫内膜癌预后的标志物。现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2015—2017年样本医院手术存档的资料,采取随机随机抽样的方法分为3 组:(1)正常子宫内膜组织标本20例。(2)来源于手术切除的子宫内膜非典型增生组织标本或同期宫腔镜检查获得的子宫内膜非典型增生组织标本24 例。(3)子宫内膜腺癌组织56 例,组织学分级G1 组18例、G2 组20 例、G3 组18 例;有淋巴结转移14 例,无淋巴结转移42 例;参照FIGO(2009 年)的分类标准,Ⅰ期和Ⅱ期32 例,Ⅲ期和Ⅳ期24 例;肌层浸润>1/2 的21 例,肌层浸润≤1/2 的35 例。标本来源的所有患者均未做化疗或放疗。
1.2 方法
1.2.1 免疫组织化学染色 (1)切片脱蜡至水:石蜡切片依次放入二甲苯I→二甲苯II→二甲苯:无水酒精(1:1)→无水酒精I→无水酒精II→95%乙醇→80%乙醇→70%乙醇→50%乙醇脱蜡至蒸馏水。(2)切片染色:①石蜡切片从蒸馏水中拿出放入PBS 中浸泡5 min。②置于90 ℃抗原修复液中进行抗原修复6~7 min。③3%过氧化氢(H2O2)(无色液体)去离子水孵育10 min,消除内源性过氧化物酶活性。缓冲液洗H2O2。④滴加5%BSA 封闭液,室温孵育10~15 min,倾去,勿洗。封闭组织蛋白,以防止非特异性反应。⑤直接滴加200 倍稀释的抗人Cyclin A 单抗,湿盒中37 ℃孵育2 h 后PBS 冲洗,3 min×3 次;随后进行阴性对照组染色:用0.01 mol/L PBS 代替单抗。⑥滴加二抗,室温孵育20 min 后PBS 冲洗,3 min×3 次。⑦滴加SABC,室温孵育20 min 后PBS 冲洗,3 min×3 次。⑧DAB显色,显微镜下观察显色效果。阴性对照组不染色而实验组染色之后停止显色,放入蒸馏水中充分冲洗(3 min×3次)。⑨苏木素染细胞核1 min→蒸馏水洗1 min→分色液分色30 s→自来水中返蓝2 h。⑩梯度乙醇脱水(流程中每个环节2 min,过程与脱蜡至水相反),二甲苯透明,中性树胶封片。
1.2.2 图像分析 HABP1 和CyclinA 主要表达于细胞浆中,呈棕黄色。免疫组织化学染色的切片在光学显微镜下观察,显微图像分析系统进行数字成像,并采集图片,计算光密度值(IOD),分析各组之间的HABP1 和Cyclin A的平均光密度值。
1.3 统计学方法
采用SPSS 13.0 软件进行统计分析。数值连续变量以均数±标准差(±s)表示。用t 检验进行不同临床分期和有无淋巴结转移以及肌层浸润深度分析。采用方差分析子宫内膜腺癌、非典型增生子宫内膜与正常子宫内膜间差异、子宫内膜腺癌不同分化程度间差异。Cyclin A 和HABP1 相互关系采用相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HABP1和Cyclin A在不同子宫内膜组织免疫组织化学染色结果
子宫内膜腺腺癌根据其分化程度分为三级,G1:高分化腺癌,腺体较规则,可见复层细胞,细胞排列紧密;G2:中等分化腺癌,腺体很不规则,部分癌组织呈实体结构。癌细胞呈单层或复层紧密排列;G3:低分化腺癌,腺体结构很少见或极不规则,癌巢多呈实性。HABP1 和Cyclin A 抗体染色的样本阳性区主要是子宫内膜细胞浆中,可以看到对应组织学分级所具有的典型的形态特征。HABP1 和Cyclin A 在子宫内膜组织的免疫组织化学染色结果见图1和图2。
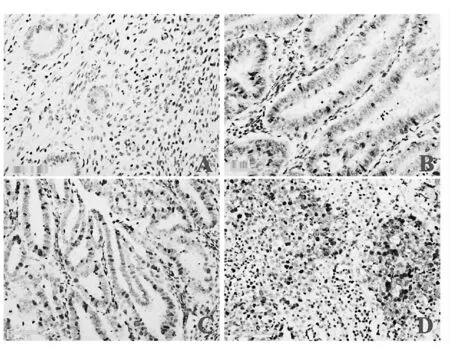
图1 CyclinA在子宫内膜组织化学染色结果

图2 HABP1在子宫内膜组织化学染色结果
2.2 HABP1和Cyclin A在不同子宫内膜组织中的表达
三组患者HABP1 和Cyclin A 的表达呈逐渐上升的趋势。在非典型增生子宫内膜和子宫内膜癌组,二者的表达均高于在正常子宫内膜组的表达水平,差异有统计学意义(P<0.05)。非典型增生子宫内膜和子宫内膜癌两组间HABP1 和Cyclin A 的表达,差异有统计学意义(P<0.05),见表1。

表1 HABP1和Cyclin A在不同子宫内膜组织中的表达
2.3 HABP1和CyclinA在各子宫内膜腺癌组织中的表达
HABP1 和Cyclin A 的表达在低分化组明显高于高分化组和中分化组,差异有统计学意义(P<0.05);在肌层浸润深度>1/2 的子宫内膜腺癌中,表达明显高于肌层浸润深度≤1/2 的子宫内膜癌,差异有统计学意义(P<0.05);在有淋巴结转移的子宫内膜腺癌中,表达也明显高于无淋巴结转移组的子宫内膜癌,差异有统计学意义(P<0.05),见表2。由此可见,子宫内膜腺癌的组织分化越差、肌层浸润越高。
表2 HABP1和Cyclin A在各子宫内膜腺癌组织中的表达(±s)

表2 HABP1和Cyclin A在各子宫内膜腺癌组织中的表达(±s)
a 表示与正常子宫内膜组比较,P<0.05;b 表示与子宫内膜非典型增生组比较,P<0.05。
组别临床分期Ⅰ期+Ⅱ期(n=32)Ⅲ期+Ⅳ期(n=24)组织分化G1(n=18)G2(n=20)G3(n=18)肌层浸润>1/2(n=21)无或≤1/2(n=35)淋巴结转移阴性(n=42)阳性(n=14)HABP1表达Cyclin A表达1 083.87±463.47 2 381.01±898.79a 737.17±294.47 2 994.01±1 142.76a 395.47±171.86 834.31±275.18a 2 149.31±923.18b 559.47±314.46 1157.31±824.09a 1 949.31±1 026.31b 2 106.31±837.62a 1 374.82±324.91 2 586.47±938.29a 984.71±424.03 879.41±355.14 2 516.31±792.65a 946.26±381.61 2 706.35±972.41a
2.4 HABP1和Cyclin A的相互关系
HABP1 和Cyclin A 间存在呈正相关,差异有统计学意义(P<0.05),见图3。
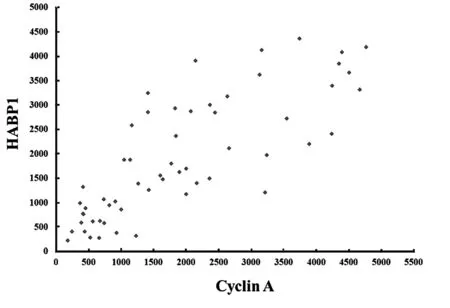
图3 HABP1和Cyclin A的相互关系
3 讨论
子宫内膜癌的病因尚不明确,侵袭和转移是肿瘤治疗失败、临床预后不良的重要生物学原因。影响预后的因素较为复杂,年龄、肿瘤分期、组织学分级、肌层浸润深度和淋巴结转移是公认的影响其预后的独立危险因素。
诱发恶性肿瘤有多种原因,如抑癌基因的缺失、生长因子信号转导通路的持续和癌基因的过度扩增等。近年来越来越多的学者注意到细胞生长周期的失调在肿瘤的发生中起重要作用。有研究[5]认为肿瘤是一类细胞周期病。肿瘤的本质是细胞失控性生长—增殖过度和凋亡减少。几乎所有癌基因的功能效应,最终都会汇聚到细胞周期机制上来。
HABP1 和Cyclin A 都是细胞周期的正向调节因素,其表达规律的改变是细胞周期破坏的重要特征之一。异常表达导致细胞异常增殖不仅涉及肿瘤的起始阶段,而且促进细胞癌变的发生和使肿瘤组织具有侵袭、转移和复发的能力,其过度表达与肿瘤发生、发展、不良预后有关。
一般情况下,细胞周期驱动机制调控异常,细胞就会进入非正常状态,即病理状态,从而出现如细胞转化、癌变等异常情况。Cyclin A 正是细胞周期驱动机制中的一个非常重要的因子。目前研究发现,Cyclin A 基因位于染色体4q27 上,是432 个氨基酸组成的球形结构,由12 个a 螺旋形成(它是两段分别由90个左右的氨基酸形成的相似折叠)。相对分子质量为60×103,它在DNA 开始合成前即出现。有证据证实,如果把Cyclin A抗体或反义质粒注入G1期培养的组织细胞中,可以阻止细胞进入S 期[7]。Cyclin A 在G1→S 转换中起着非常重要的作用。在哺乳动物组织细胞培养中,Cyclin A 与p33cdk2 结合形成复合体,在G1晚期开始增多,调节细胞增殖并进入S 期,于S 期和G2 期达到峰值,Cyclin A/p33cdk2 激酶在G1→S 转换过程中被活化且存在于S 期的细胞核中[7],具有促进有丝分裂的作用。Cyclin A 异常表达可导致细胞周期调节失控,促进细胞在DNA 复制不完全时即进入M 期,从而直接或间接地导致细胞的恶性转化和肿瘤的形成[8]。
近年来的研究表明,很多肿瘤组织中HABP1 和Cyclin A 都表达过度,而且参与了肿瘤的侵袭和转移过程,故它可以预示肿瘤的临床结果及生物学行为。例如:在肝癌组织的细胞中,低分化肝癌组中Cyclin A 阳性表达比高分化肝癌组明显升高。所以,细胞分化越差,Cyclin A 的表达越高[9]。在星形细胞瘤中,Cyclin A表达与肿瘤病理分级显著相关[10]。Cyclin A 阳性表达与喉鳞癌病理组织学分级呈负相关[11]。
HABP1是透明质酸黏素家族中的一个特殊成员,它能够特异性的与透明质酸结合[12]。生理条件下,HABP1 主要以一种非共价键连接的三聚体形式存在,在氧化环境中,以六聚体的形式存在,这一六聚体形式使HABP1 与其配体结合的能力大大提高[13]。不同类型的细胞在不同的生理条件下,HABP1可存在于不同的细胞器中,除了线粒体外,还可出现在细胞核、细胞浆及细胞膜上。根据HABP1的结构特点及这种生物学特性,推测它是一种多功能蛋白,参与细胞内的分子运输,以连接不同细胞器间的信号转导记忆连接细胞器和细胞膜之间的信号转导。HABP1与细胞凋亡之间的关系是近年来的研究热点。有研究[14-16]发现,HABP1 可以通过多条通路诱导细胞凋亡。HABP1与透明质酸具有很高的亲和力, HABP1通过与HA结合介导细胞内和细胞间的信号转导,具有促进细胞黏附的特性。透明质酸是构成细胞外基质和细胞间质的主要成分,不仅对维持组织结构、促进细胞黏附、活化和迁移以及细胞信号的转导有着重要作用,而且还是促进肿瘤细胞的侵袭和转移、引发肿瘤细胞抗药反应的主要物质。尽管在肿瘤细胞的HABP1 基因中并未发现有肿瘤特异性的突变位点,但是HABP1 蛋白在许多恶性肿瘤组织中呈高表达。Rozanov等[17]研究发现乳腺癌细胞株中有HABP1蛋白的过度表达。用抗HABP1 的单抗对甲状腺癌、卵巢癌、结肠癌、胰腺癌、胃癌、食管癌以及肺腺癌组织中进行免疫组化染色,与各自的非恶变组织进行对照,结果显示,HABP1蛋白在这些癌组织中呈高表达,同时发现,HABP1高表达的肿瘤中HA 的含量也是升高的,说明HABP1 与HA 间的相互作用可能与肿瘤有关[18]。由此可见,根据HABP1 所介导的各种功能来看,HABP1 可能是恶性肿瘤的发生、发展、转移过程中一个重要的调节因子。尽管已有研究证实在多种腺癌组织中HABP1 蛋白呈高表达,但是在子宫内膜癌中的表达情况及其在肿瘤发生、发展中的作用,国内无报道,国外报道也较少。
本实验研究发现, HABP1 和Cyclin A 的表达呈逐渐上升的趋势。在非典型增生子宫内膜和子宫内膜腺癌组,二者的表达均高于在正常子宫内膜组的表达水平,差异有统计学意义。从前文的分析可见,子宫内膜癌的组织分化越差、肌层浸润越深、临床分期越晚,HABP1 和Cyclin A的表达越高。这提示了HABP1和Cyclin A不仅参与子宫内膜癌的发生,而且与子宫内膜癌进展有关,还参与了子宫内膜癌肿瘤的转移和侵袭过程。
综上所述,本实验结果表明,HABP1 和Cyclin A 参与子宫内膜腺癌的发生发展以及侵袭转移,异常高表达可作为子宫内膜癌的早期预测和子宫内膜病变不同阶段的诊断的参考指标。
