脑胶质瘤靶向SPIO⁃PLA⁃P53分子探针的构建及磁共振成像实验研究
2022-09-14段丽珍郭莉莉柏根基
段丽珍,郭莉莉,柏根基
南京医科大学附属淮安第一医院影像中心,江苏 淮安 223300
胶质瘤是成人最常见且恶性程度较高的原发性脑肿瘤[1-2]。胶质瘤很少被治愈,低级别胶质瘤的中位生存期为11.6年,而高级别胶质瘤患者的中位生存期不足3年[3-6]。超顺磁性氧化铁纳米颗粒(su⁃perparamagnetic iron oxide nanoparticles,SPIO)是一种具有良好生物相容性的纳米粒子,作为磁共振成像(magnetic resonance image,MRI)阴性对比剂在实验研究中具有重要地位[7-8]。而具有靶向性能的MRI 分子探针,因其可以反映体内特定生物分子的特征,评价组织的微结构变化,对于实现疾病的定性诊断具有重要意义[9]。
P53基因参与调解细胞周期和细胞凋亡,其突变产物P53蛋白高表达可促进细胞癌变,并加快癌细胞的生长发育,加重恶变程度[10]。多项研究表明脑胶质瘤细胞存在P53蛋白的过表达,是脑胶质瘤的关键生物标志物[11-12]。本研究设计了P53标记的靶向超顺磁性氧化铁纳米颗粒SPIO⁃PLA⁃P53,用于脑胶质瘤的特异性MRI,为脑胶质瘤的诊断提供新思路。
1 材料和方法
1.1 材料
C6大鼠脑胶质瘤细胞株(长沙丰晖生物科技有限公司),SPIO(中科雷鸣北京科技有限公司),聚乳酸⁃聚乙二醇⁃羧酸(PLA⁃PEG⁃COOH)(西安瑞禧生物科技有限公司),氯仿、2⁃(N⁃吗啡啉)乙磺酸[2⁃(n⁃morphorphine)ethanesulfonic acid,MES]、1⁃(3⁃二甲氨基丙基)⁃3⁃乙基碳二亚胺盐酸盐[1⁃(3⁃dimeth⁃ylaminopropyl)⁃ 3⁃ethylcarbodiimide hydrochloride,EDC](西格玛奥德里奇上海贸易有限公司),N⁃羟基琥珀酰亚胺(N⁃hydroxysuccinimide,NHS,西格玛奥德里奇上海贸易有限公司),P53(1C12)Mouse mAb(上海超研生物科技有限公司)。
1.2 方法
1.2.1 C6细胞表面P53抗原检测
采用流式细胞仪检测细胞表面及内部P53蛋白的表达情况。
1.2.2 靶向分子探针的合成
SPIO⁃PLA 分子探针的合成:向装有30 g PLA⁃PEG⁃COOH粉末的离心管中加入1 mL氯仿,超声波溶解,随后加入10 mg 的SPIO溶液混匀,注入10 mL水乳化搅拌过夜。待有机溶剂挥发完全后,洗涤PLA⁃PEG⁃COOH 4 次,将样品4 ℃保存备用。计算所得样品的铁浓度。
SPIO⁃PLA⁃P53 分子探针的合成:取2 mg 的SPIO⁃PLA 置于超滤管中,用MES 缓冲溶液(pH=5.51)洗涤2 次,稀释至2 mL,分别加入0.3 mg EDC和0.6 mg NHS活化,超滤2次,加入260 μg的P53抗体,混合、搅拌过夜。将所得样品超滤4次。最后测试铁浓度,将其稀释至1 mg/mL。
1.2.3 纳米探针的物理性质检测
透射电镜扫描SPIO⁃PLA⁃P53分子探针:取2 μL混合均匀的SPIO⁃PLA⁃P53 溶液滴于300 目的铜网上,自然干燥30 min,除去多余液体,置于透射电镜下观察纳米粒子的大小及形态。
分子探针的动态散射及Zeta 电势测定:分别用超声波清洗剂将1%SPIO⁃PLA及1%SPIO⁃PLA⁃P53溶液分散均匀,过滤后加入石英比色皿中,在波长633 nm 的He/Ne激光下对样品进行测定。
1.2.4 细胞培养及荷瘤大鼠模型构建
C6 胶质瘤细胞在RPMI 1640 培养基、37 ℃、5%CO2恒温培养箱内进行培养。选取9只Wistar雄性大鼠(6~8周,体重200~250 g),本研究获得淮安市第一人民医院研究伦理委员会批准(编号:DW⁃P⁃2021⁃014⁃01)。大鼠术前禁食12 h,不禁水,备皮,麻醉,消毒,铺巾。俯卧位将大鼠固定于立体定仪内,以两侧内眦连线中点为起点,切开头皮,于前囟中点前l mm,中线右旁开3 mm,用圆头牙科钻孔,有落空感时立刻停止,用微量注射器抽取10 μL 单细胞悬液(1×106个/mL),沿骨孔缓慢垂直进针,约至硬脑膜下6 mm处停止,停针约5 min(扩容),再退回1 mm,随后缓慢均匀注射10 min(1 μL/min),注射完毕停留5 min,结束后缓慢拔针,用EC胶封住骨孔,缝合消毒。
1.2.5 细胞毒性实验
用CCK⁃8 法检测C6 细胞活力。将C6 细胞以2×104个/孔接种于96 孔板上。分成3 组,第1 组不做任何处理,第2 组用200 μg/mL 的SPIO⁃PLA 纳米探针溶液替换培养基,第3 组用200 μg/mL 的SPIO⁃PLA⁃P53纳米探针溶液替换培养基,将上述3组细胞于培养箱中孵育48 h 后加入培养基及10 μL CCK⁃8液继续培养2 h,然后用酶标仪测量光密度值并记录细胞活性。
1.2.6 分子探针检测体外血脑屏障通透性
常规培养鼠脑微血管内皮细胞株(RCMEC),随机分为3 组,1 组为对照组,另外2 组作为实验组。实验组分别在培养皿中加入200 μg/mL 的SPIO⁃PLA及SPIO⁃PLA⁃P53纳米探针溶液,对照组不作特殊处理,孵育48 h。随后制备单细胞悬液并置于EP管中并进行MRI T2WI成像。采用7.0 T小动物专用磁共振仪及配套线圈采集图像。扫描参数如下:TR:3 000 ms;TE:36 ms;FOV:3.2 cm×3.2 cm;层厚:1 mm;层间距:1 mm;矩阵大小:256×256。
1.2.7 MRI成像及评估
MRI 成像:对9只荷瘤大鼠进行MRI,随机选取3只作为SPIO⁃PLA组(对照组),6只作为SPIO⁃PLA⁃P53组(实验组)。两组大鼠依次进行MRI平扫及增强扫描。平扫获取T1WI、T2WI图像后进行T2WI增强扫描:对照组尾静脉缓慢注射SPIO⁃PLA分子探针溶液(1 mg/mL),剂量为每100 g体重1.5 mL,实验组尾静脉缓慢注射相同剂量SPIO⁃PLA⁃P53 分子探针溶液,24 h 后进行增强扫描。T1WI 扫描参数:TR:331.6 ms;TE:8.5 ms;T2WI扫描参数:TR:3 000 ms;TE:36 ms;FOV:3.2 cm × 3.2 cm;层厚:1 mm;层间距:1 mm;矩阵大小:256×256。T1WI 及T2WI 扫描总时长约12 min。
MRI 图像评估:使用ITK⁃SNAP 软件(version 3.8.0)(http:// www.itksnap.org)依次打开图像序列,找到病灶显示的最佳断面,避开血管及液化坏死区,使用画图工具选取病灶实性部分、同层面左侧基底节区及咬肌的感兴趣区(region of interest,ROI),测量平扫及增强的T2WI信号值,每个病灶至少选取两处ROI,取平均值。计算肿瘤组织/咬肌平扫及增强T2WI信号比值和同层面左侧基底节区/咬肌平扫及增强T2WI信号比值进行统计分析。
1.2.8 脑组织普鲁士蓝染色
MRI结束后立即处死大鼠,分离脑组织,福尔马林固定,石蜡包埋。将2%亚铁氰化钾溶液和20%盐酸溶液等比例混合成普鲁士蓝染液,石蜡切片脱蜡至蒸馏水,切片入染液中染色30 min,蒸馏水洗2遍,无水乙醇脱水,二甲苯透明,中性树胶封片。
1.3 统计学方法
使用GraphPad Prism 8 软件对结果进行统计分析,使用独立样本t检验分析每组平扫与增强扫描肿瘤组织/咬肌T2WI 信号比值的改变,并进行SPIO⁃PLA 组及SPIO⁃PLA⁃P53 组的比较。同时,测量两组同一层面左侧基底节区/咬肌T2WI 信号比值改变情况,P<0.05 为差异有统计学意义。利用Boot⁃strap 方法对实验组数据进行小样本抽样分析,得到实验数据抽样分析的均值及置信区间。
2 结果
2.1 流式细胞仪检测C6细胞P53抗原
C6 细胞表面P53 表达率仅为0.8%,几乎不表达。C6 细胞经破膜处理后P53 的表达率达90.8%(图1)。

图1 流式细胞仪检测C6细胞P53抗原表达Figure 1 The expression rate of p53 in C6 cells detected by flow cytometry
2.2 纳米颗粒的形态及物理性质
2.2.1 SPIO⁃PLA⁃P53探针透射电镜图
透射电镜下SPIO⁃PLA⁃P53 呈球形壳⁃核结构,大小较均匀,纳米探针内核直径约10 nm(图2)。

图2 SPIO⁃PLA⁃P53分子探针透射电镜图Figure 2 SPIO⁃PLA⁃P53 molecular probe detected by transmission electron microscope
2.2.2 动态光散射仪测试
动态光散射仪测量结果显示,SPIO⁃PLA平均水合粒径约为109.8 nm,SPIO⁃PLA⁃P53平均水合粒径约为121.8 nm(图3)。

图3 SPIO⁃PLA(A)与SPIO⁃PLA⁃P53(B)分子探针平均水合粒径图Figure 3 Average hydrated particle size of SPIO⁃PLA(A)and SPIO⁃PLA⁃P53(B)molecular probes
2.2.3 Zeta电位检测
SPIO⁃PLA纳米粒子的平均Zeta电位为-30.3 mV左右,经过P53 修饰后,合成的SPIO⁃PLA⁃P53 纳米粒子的平均Zeta电位为-26.3 mV(图4)。

图4 SPIO⁃PLA(A)与SPIO⁃PLA⁃P53(B)分子探针的Zeta电位图Figure 4 Zeta potential map of SPIO⁃PLA(A)and SPIO⁃PLA⁃P53(B)molecular probes
2.3 细胞毒性试验
SPIO⁃PLA 及SPIO⁃PLA⁃P53纳米探针与细胞共孵育后与对照组相比,3 组细胞活力均保持在80%以上(图5)。

图5 SPIO⁃PLA 及SPIO⁃PLA⁃P53 纳米探针与C6 细胞共孵育后的细胞活性(n=3)Figure 5 Viability of C6 cells after co⁃incubation of SPIO⁃PLA and SPIO⁃PLA⁃P53 nanoprobes(n=3)
2.4 分子探针血脑屏障通透性分析
A 管为RCMEC 单细胞悬液,B 管为SPIO⁃PLA探针共孵育后RCMEC 细胞悬液,C 管为SPIO⁃PLA⁃P53 探针共孵育后RCMEC 细胞悬液。通过MRI T2WI 扫描,A 管为高信号,B 管、C 管为明显低信号(图6)。此结果表明SPIO⁃PLA 和SPIO⁃PLA⁃P53 纳米探针可进入RCMEC细胞内,缩短横向弛豫时间。

图6 分子探针共孵育后RCMEC细胞悬液的T2WI扫描结果Figure 6 T2WI scans of cell suspension of RCMEC after co⁃incubation with molecular probes
2.5 MRI成像
根据大鼠行为学表现及成瘤效果,选取荷瘤14 d大鼠进行MRI。SPIO⁃PLA组SPIO⁃PLA分子探针增强前后T2WI对比图显示,肿瘤T2WI信号值分别约37.90 ±1.43、37.35±1.11,瘤体T2WI 信号下降率约1.5%。SPIO⁃PLA⁃P53组SPIO⁃PLA⁃P53分子探针增强前后T2WI对比图显示,肿瘤T2WI信号值分别约36.49±1.75、31.75±1.28,瘤体T2WI 信号下降率约13.0%,可见SPIO⁃PLA⁃P53组信号下降较明显(图7)。
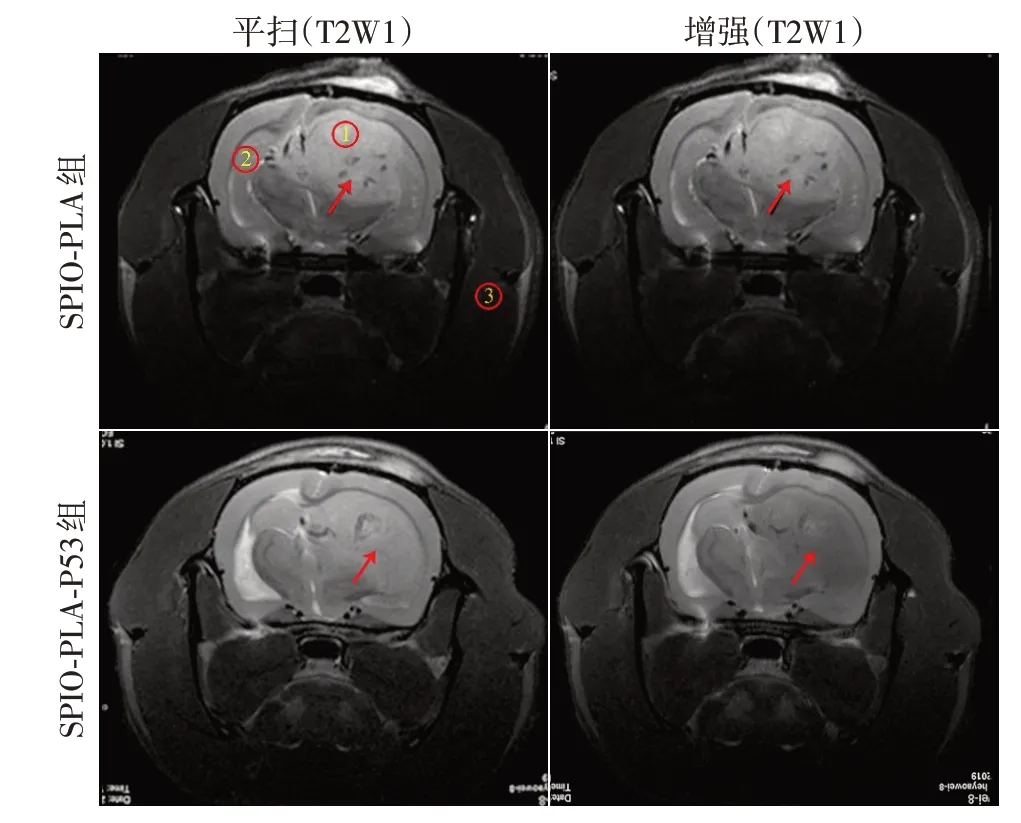
图7 SPIO⁃PLA组及SPIO⁃PLA⁃P53组分子探针增强前后T2WI序列扫描图像对比Figure 7 Comparison of T2WI sequence scan images before and after molecular probe enhancement in SPIO⁃PLA group and SPIO⁃PLA⁃P53 group
2.6 MRI图像评估
SPIO⁃PLA 组及SPIO⁃PLA⁃P53组大鼠平扫与增强扫描左侧基底节区/咬肌T2WI信号比值差异无统计学意义(P>0.05,表1),同时两组平扫与增强扫描左侧基底节区/咬肌T2WI 信号比值组间比较,差异无统计学意义(P>0.05,表1)。两组大鼠在分别注射SPIO⁃PLA分子探针及SPIO⁃PLA⁃P53分子探针后,正常脑组织T2WI信号无明显改变。

表1 SPIO⁃PLA组与SPIO⁃PLA⁃P53组平扫与增强扫描左侧基底节区信号值与同层面咬肌信号比值比较Table 1 Comparison of the signal value of the left basal ganglia region and the masseter muscle signal ratio at the same level between the SPIO⁃PLA group and the SPIO⁃PLA⁃P53 group on plain and enhanced scans
SPIO⁃PLA组大鼠在平扫与增强扫描肿瘤组织/咬肌T2WI信号比值差异无统计学意义(P>0.05,表2);SPIO⁃PLA⁃P53 组平扫与增强扫描肿瘤组织/咬肌T2WI 信号比值下降较明显,差异有统计学意义(P<0.05,表2)。两组平扫肿瘤组织/咬肌信号比值组间比较,差异无统计学意义(P>0.05,表2),增强扫描肿瘤组织/咬肌信号比值组间比较,差异有统计学意义(P<0.05,表2)。

表2 SPIO⁃PLA⁃P53组与SPIO⁃PLA⁃P53组平扫与增强扫描肿瘤组织信号值与同层面咬肌信号比值比较Table 2 Comparison of the signal value of the tumor tissues and the masseter muscle signal ratio at the same level between the SPIO⁃PLA group and the SPIO⁃PLA⁃P53 group on plain andenhanced scans
本研究为小样本数据,其概率特征值很难确定,导致分析结果与实际结果可能存在偏差。因此采用Bootstrap 方法来解决小样本数据的统计问题,得到SPIO⁃PLA⁃P53 组平扫肿瘤组织/咬肌的T2WI信号比值95%CI:3.594 2~3.736 7,均值3.453 3,增强扫描肿瘤组织/咬肌的T2WI 信号比值95%CI:3.251 4~3.378 3,均值3.155 0(图8)。

图8 SPIO⁃PLA⁃P53组增强前后肿瘤组织/咬肌T2WI信号比值Bootstrap方法参数分布图Figure 8 Bootstrap parameter distribution of T2WI signal ratio of tumor tissue/masseter muscle before and after enhance⁃ment in SPIO⁃PLA⁃P53 group
2.7 脑组织普鲁士蓝染色
对SPIO⁃PLA组及SPIO⁃PLA⁃P53组大鼠脑组织进行普鲁士蓝染色(图9),SPIO⁃PLA 组细胞核呈浅红色,细胞间隙见少许铁离子显色,SPIO⁃PLA⁃P53组见弥漫分布的蓝色铁颗粒,分布于细胞内部及间隙。

图9 SPIO⁃PLA组和SPIO⁃PLA⁃P53组大鼠脑组织普鲁士蓝染色Figure 9 Prussian blue staining of rat brain tissues in SPIO⁃PLA group and SPIO⁃PLA⁃P53 goup
3 讨论
随着纳米材料及分子影像的发展,在微观分子水平上的显像技术及治疗方法被用于肿瘤的诊疗[13-15]。靶向MRI 分子探针可使对比剂在感兴趣部位实现特异性积聚,以提高诊断准确性及灵敏度[16-17]。分子探针与靶点的结合是对比剂蓄积的关键。靶点通常与疾病的发生发展关系密切,靶向分子的特异性结合决定了显影的特异性。本研究成功用P53抗体标记了Fe3O4纳米颗粒合成特异性SPIO⁃PLA⁃P53纳米分子探针,并证明所获得的靶向纳米粒子能够有效对大鼠胶质瘤进行特异性分子显影。
SPIO是一种新型磁共振对比剂,广泛应用于分子影像基础实验中[18]。SPIO 优异的磁性是其作为T2加权MRI对比剂的主要条件,扫描时可明显缩短组织横向弛豫时间,使T2 值减低。许多研究表明,各种化合物及探针包被的SPIO 在动物实验中都表现出了良好的生物相容性[19-21]。在本研究中,细胞毒性实验结果显示与探针溶液共孵育后,细胞的存活率达80%以上,证明目标探针无明显毒性作用,可安全进行动物实验。
众多学者对SPIO 在胶质瘤的示踪及治疗效能方面进行了大量研究。由于脑胶质瘤的微血管受到损害,Shen等[22]发现静脉注射含有药物的超顺磁性氧化铁纳米粒子(SPIO⁃NPs),有效载荷药物高,同时可以联合MRI 追踪药物分布映射治疗效果。Maritim 等[23]制备了具有活体荧光和MRI 性能的纳米粒子SPIO@DSPE⁃PEG/DOX/ICG,用于评估胶质瘤治疗效果。本研究将P53 蛋白作为靶点,联合SPIO 构建SPIO⁃PLA⁃P53 纳米分子探针,作为脑胶质瘤MRI特异性对比剂,对荷瘤大鼠进行显像,MRI显示瘤体在注射靶向纳米探针后T2WI 信号减低(P<0.05),病理结果证实瘤体内大量铁离子沉积,客观验证了靶向SPIO⁃PLA⁃P53纳米分子探针的诊断效能,为脑胶质瘤的特异性显像和治疗提供了新的靶点。
由于研发资金和时间的限制,本研究是小样本数据,分析结果与实际结果不可避免地存在差异。因此采用Bootstrap 方法来解决小样本数据的统计问题[24-25]。本研究选取了实验组T2WI 信号值作为样本进行评估。获得SPIO⁃PLA⁃P53 组平扫肿瘤组织/咬肌的T2WI信号比值95%CI为3.594 2~3.736 7,增强扫描肿瘤组织/咬肌的T2WI信号比值95%CI为3.251 4~3.378 3,即所得数据在置信区间均可视为合理。
胶质瘤是最常见的脑部恶性肿瘤。本研究以SPIO 为载体制成胶质瘤靶向分子探针SPIO⁃PLA⁃P53,对脑胶质瘤大鼠脑组织进行检测,明确大鼠胶质瘤的定位,将为脑胶质瘤诊断提供新思路。
