BMP⁃2缓释型PLGA微囊作为引导骨再生支架的初步研究
2022-09-14王莹,陈晨*,陈刚
王 莹,陈 晨*,陈 刚
1南京医科大学附属口腔医院牙体牙髓科,江苏 南京 210029;2南京医科大学口腔疾病研究江苏省重点实验室,江苏 南京 210029;3江苏省口腔转化医学工程研究中心,江苏 南京 210029;4南京医科大学附属口腔医院口腔修复科,江苏 南京 210029
严重牙槽骨缺损制约了口腔种植义齿技术的临床应用,利用引导骨再生的填充材料促进骨修复是一种备受期待的解决方法[1-2]。在修复少量骨缺损时,骨填充材料内部的细胞仅依靠周围组织血管的养分渗透即可正常生长[3-4],获得了较好的效果。但是支架材料若仅依靠周围养分的渗透,而缺乏充分的血管化,形成的正常骨质通常不会超过材料表面的1 mm[5],所以单纯用骨替代材料修复大范围骨缺损的效果仍不能满足临床要求。血管内皮细胞作为支架血管化的主要参与者,可以分泌成骨相关因子,如骨形态发生蛋白(bone morphogenetic pro⁃tein,BMP),对成骨细胞的增殖、迁移、分化甚至矿化都有直接的调控作用[6]。所以血管化不良的支架材料不但无法为内部细胞输送养分,也不能持续释放相关细胞因子募集周围细胞长入。
为解决这一问题,设计一种能持续释放相关因子的支架,促进其血管化和成骨能力,进而修复大范围的牙槽骨缺损,一直是研究者们努力的方向[7]。本研究前期制备了一种聚乳酸⁃聚乙醇酸共聚物[poly(lactic⁃co⁃glycolic acid),PLGA]微囊支架并证明了其特殊结构非常利于早期的血管长入及后期的成骨[8]。前期利用传统乳液挥发法制备的微囊虽然具备载药缓释的潜力,但是所制得的微囊粒径分布过宽,存在大量不适合细胞培养的10 μm 级别的过小微囊;内部囊腔大小、数量不规则,甚至存在不含囊腔的实心球体,整体包封率及释放性能可控性差[9]。因此,本研究开发了一种新的双通道微量同轴注射PLGA微囊的制备方法。在该方法中内外径不同的双通道同轴针头的外针连接装载PLGA溶液的注射器,内针连接装载细胞因子或药物的注射器,同轴针头置于收集装置的水相中。再将两支注射器分别固定于双通道微量注射泵的A、B 通道。注射泵对双通道的注射速度精确控制,在收集装置内以一定速度旋转流动的水相内,得到一种新型的具备“壳⁃芯”结构的PLGA 微囊,A 通道的PLGA 溶液形成为微囊的“壳”,B 通道的内容物形成微囊的“芯”。这种方法使得每一颗成品微囊都具有单个、圆形的规则内腔。与“批量成型”的乳液挥发法相比,新方法的工艺属于“单颗成型”,无论如何改变各项工艺参数,都能对每颗微囊造成同样影响,得到均一性极高的产物。
本研究提出的PLGA微囊制备方法理论上通过改变同轴注射针头的内外径和注射泵双通道的注射速度,可精确控制微囊的外径和内径,即囊壁的厚度。在其他条件不变的情况下,不同囊壁厚度的微囊同步降解,囊壁越薄的微囊结构完整性越早破坏,囊腔内包封的内容物越早释放。替换B 通道内的药物或因子,可方便地使微囊负载不同的内容物。本研究在微囊成型时同步载入BMP⁃2,并利用不同囊壁厚度控制BMP⁃2的缓释,初步验证了其对成骨细胞不同强度的趋化作用。
1 材料和方法
1.1 材料
微量注射泵(SP⁃2000,宁波安诺公司);磁力搅拌器(MS⁃H⁃Pro+,北京大龙公司);同轴针头(A 型:内径0.26 mm+外径0.85 mm;B型:内径0.16 mm+外径0.85 mm,合肥思品科技有限责任公司);荧光显微镜(Leica 公司,德国);扫描电子显微镜(scan⁃ning electron microscope,SEM,TESCAN MAIA3 公司,捷克);超微量紫外分光光度计(Thermo Fisher公司,美国),恒温摇床(上海旻泉公司),激光粒度仪(Mastersizer 2000,Malvern 公司,英国);PLGA(75:25,分子量12 kDa,济南岱罡生物工程有限公司);聚乙烯醇[Poly(vinyl alcohol),PVA,上海洵昱实业有限公司];小鼠颅骨成骨细胞系MC3T3⁃E1(上海中国科学院细胞库);胎牛血清(ScienCell 公司,美国);α⁃MEM 基础培养基(Gibco 公司,美国);0.25%胰酶(Gibco 公司,美国);CCK⁃8 试剂盒(合肥Biosharp 公司);荧光素钠(Sigma⁃Aldrich 公司,美国);0.1%亚甲基蓝染色液(北京Solarbio 公司);BMP⁃2(上海Novoprotein 公司),Calcein/PI 细胞活性与细胞毒性检测试剂盒(上海碧云天公司);PBS(Gibco公司,美国)。
1.2 方法
1.2.1 PLGA微囊的制备方法
取8 g PVA 溶于400 mL 去离子水制备成2%的PVA溶液,与磁力搅拌子一起盛于500 mL烧杯中置于磁力搅拌器上备用,取1 g PLGA 溶于10 mL 二氯甲烷配置成10%的PLGA溶液置于50 mL注射器,将包封的内容物溶液装入20 mL 注射器。将装有PLGA溶液的注射器与装有包封内容物溶液的注射器分别安装到微量注射泵的A、B通道,调整A通道注射速度为580 mL/h,B 通道注射速度为80 mL/h,分别连接A 型同轴针头的外针和内针入口,将同轴针头置于PVA溶液液面以下,调整磁力搅拌器转速为190 r/min,注射器排气后开始注射,注射结束后将针头从PVA 溶液中取出,制备过程如图1。磁力搅拌器控制温度在39 ℃,搅拌8~12 h 后,静置烧杯让PLGA微囊沉淀,随后弃大部分上清,加入无菌去离子水转移至50 mL 离心管,震荡离心管以清洗微球,用离心机调整转速300 r/min 离心3 min 弃上清。重复清洗、离心过程3次。更换B型同轴针头,控制微量注射泵及磁力搅拌器的参数不变,重复微囊制备过程。

图1 PLGA微囊制备示意图Figure 1 Schematic diagram of preparation of PLGA microspheres
1.2.2 PLGA微囊的形态及粒度分析
在B通道注射器内置入0.1%亚甲蓝染色液,按1.2.1中制备方法制备微囊并冷冻干燥,用光学显微镜及扫描电子显微镜在10 kV 电压下观察PLGA 微囊的形态。收集同一批次制备的所有微囊并用粒度分析仪测试微囊粒径,检测3批样本,取均值。
1.2.3 PLGA微囊囊壁厚度分析
按照1.2.1 中PLGA 微囊的制备方法,在B 通道注射器内加入100 μg/mL 的荧光素钠溶液,更换使用两种型号同轴针头,分别收集两种微囊并于正置荧光显微镜下观察,用图像处理软件Image J测量微囊囊壁厚度(n=286)并统计分析。
1.2.4 PLGA微囊的降解
冻干后两种囊壁厚度的PLGA 微囊分别称取50 mg 置于1.5 mL 离心管中,每种厚度设5 个离心管,每个离心管中加入1 mL PBS(PH=7.4),将离心管置于150 r/min 恒温摇床,每隔1、3、7、14、21、28、35、42、49、70 d 取出离心管并离心,去上清,冷冻干燥、称重,并用SEM观察PLGA微囊形态变化。
1.2.5 PLGA微囊细胞相容性检测
在B 通道注射器内置入无菌生理盐水,按1.2.1制备方法制备空白微囊并冷冻干燥。取50 mg冷冻干燥的空白PLGA 微囊于1.5 mL 离心管,在75%乙醇中浸泡1 h,去除乙醇,用PBS 漂洗3 遍,加入完全培养基100 μL,置于37 ℃150 r/min 恒温摇床5 d,离心取上清,用1 mL完全培养基稀释作为实验组浸提液培养基。将MC3T3⁃E1 细胞按4×103个/孔的密度接种于96孔板,于37 ℃、5%CO2和100%湿度的孵箱中进行培养,实验组用浸提液完全培养基,对照组用正常完全培养基,每组设5个孔,每2天换液,分别在培养第1、3、5、7天后,吸弃原培养液,每孔加入100 μL含10%CCK⁃8的完全培养基,避光孵育2 h,吸取90 μL液体置于另一96孔板,用酶标仪于450 nm波长下检测吸光度值。
取20 μL冷冻干燥的空白PLGA微囊,在75%乙醇中浸泡1 h,去除乙醇,用PBS 漂洗3 遍,置于6 孔板中作为实验组,不加微囊组为对照组,每组3 个孔。将MC3T3⁃E1 细胞按1×104个/孔的密度接种于6 孔板,于37 ℃、5%CO2和100%湿度的孵箱中进行培养,每3 d 换液,7 d 后用Calcein/PI 细胞活性与细胞毒性检测试剂盒按照说明书对细胞进行染色,倒置荧光显微镜观察染色结果。
1.2.6 细胞趋化实验
按照1.2.1 中PLGA 微囊的制备方法,将B 通道注射器替换为500 ng/mL的大鼠BMP⁃2,更换两种型号的同轴针头,获得并收集载有BMP⁃2的两种囊壁厚度的PLGA 微囊。各取20 μL 体积的两种PLGA微囊,在75%乙醇中浸泡1 h,去除乙醇,用PBS漂洗3 遍后置于24 孔板中Transwell 小室的下室,并加入培养基700 μL,上室加200 μL 培养基重悬后的MC3T3⁃E1 细胞,接种密度为5×105个/室。不加微囊组为空白对照,每组3 个孔,24 h 后观察细胞迁移结果。
1.3 统计学方法
所有定量数据均采用统计分析软件SPSS 22.0进行独立样本t检验,结果以均数±标准差()表示,P<0.05为差异有统计学意义。
2 结果
2.1 PLGA微囊的形态及粒度分析
同轴双通道注射法制备的PLGA微囊形态及粒度表征见图2,结果显示:该方法制备的两种厚度囊壁的PLGA微囊大小均一,表面光滑,粒径均值无明显差异,约为167.58 μm。
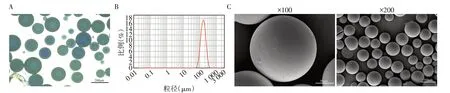
图2 双通道微量注射泵制备的PLGA微囊表征Figure 2 The characterizations of PLGA microspheres prepared by dual⁃channel micro⁃syringe pump
2.2 PLGA微囊囊壁厚度分析
荧光显微镜下两组囊壁厚度的PLGA 微囊(图3A、B),图像处理软件Image J测量微球囊壁厚度统计结果显示:A 型同轴针头制备的PLGA 微囊囊壁厚度为(23.82±7.10)μm;B型同轴针头制备的PLGA微囊的囊壁厚度为(35.31±5.55)μm,B 型针头制备的PLGA 微囊囊壁厚度明显大于A 型同轴针头,差异具有统计学意义(P<0.001,图3C、D)。
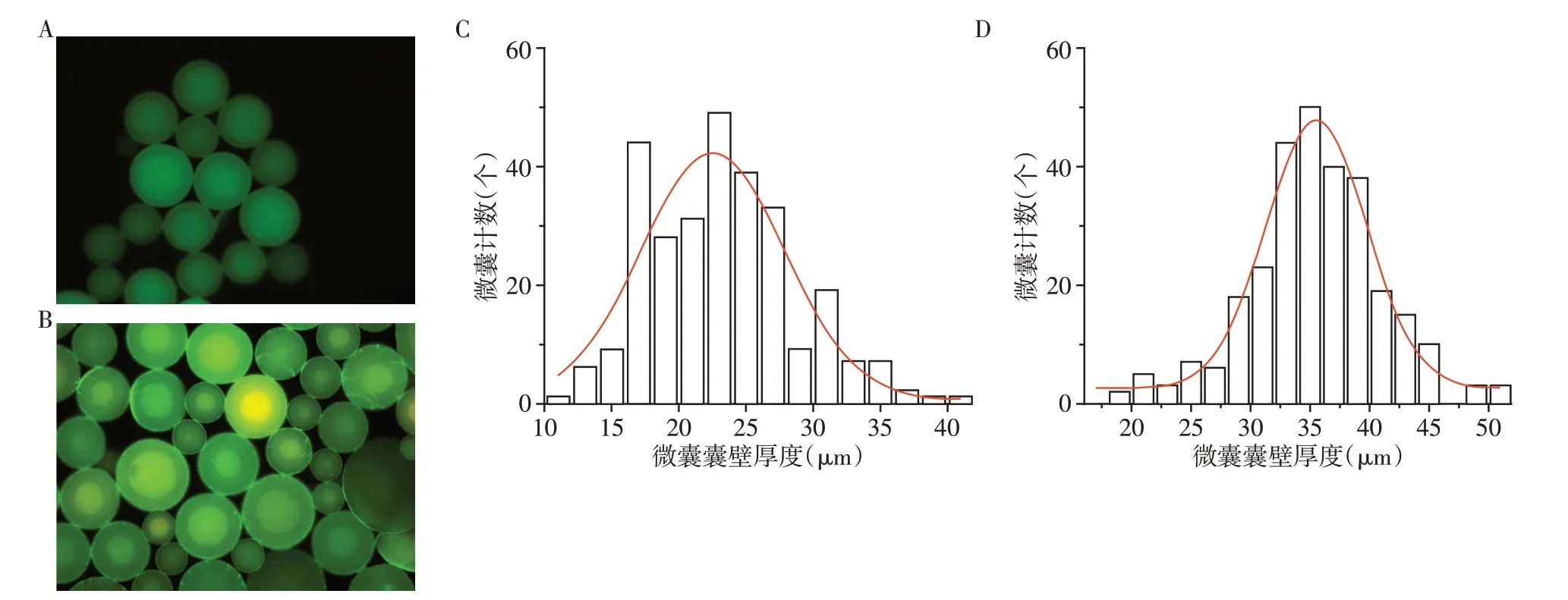
图3 不同囊壁厚度的PLGA微囊Figure 3 PLGA microspheres with different shell thickness
2.3 PLGA微囊的降解
两种厚度PLGA 微囊均可在60 d 左右基本降解,SEM观察其不同时间点的微囊形态变化,35 d后PLGA 微囊在SEM 镜下基本丧失其原本特征(图4A)。PLGA 微囊降解动力学变化(图4B),随着时间的推移,PLGA微囊质量逐渐减少,最初20 d微囊降解速度较慢,20 d之后微囊降解速度加快,降解末期42 d 以后降解速度减慢直至降解完成。降解全过程中囊壁厚薄不同未见对微囊的降解速率产生明显影响。

图4 PLGA微囊的降解结果Figure 4 The degradation results of PLGA microspheres
2.4 PLGA微囊细胞相容性检测结果
图5 可见细胞培养第7 天时加入PLGA 微囊的实验组与对照组的细胞均能正常增殖,并且细胞可黏附到PLGA 微囊表面;CCK⁃8 实验结果显示细胞从1、3、5、7 d都表现出增长趋势,且加入PLGA微囊浸提液培养后细胞活力与对照组基本无差异(1、3、7 d时,P>0.05)。

图5 PLGA微囊细胞相容性检测Figure 5 Cell compatibility test of PLGA microspheres
2.5 细胞趋化实验
趋化实验结果显示(图6),与空白组相比,两组载有BMP⁃2 的微囊作用24 h,诱导细胞迁移量明显增多,差异有统计学意义。而载有BMP⁃2 的薄型PLGA微囊24 h内诱导细胞迁移的量也明显多于厚型PLGA微囊,差异有统计学意义(P<0.05)。

图6 包封BMP⁃2的PLGA微囊对成骨细胞的趋化作用Figure 6 The chemotactic effects of PLGA microspheres encapsulated with BMP⁃2 on osteoblastcells
3 讨论
传统乳液挥发法制备的PLGA微囊多用作缓释药物的载体[10],该工艺较易制备几十微米甚至更小粒径的微囊。然而PLGA 微囊直径过小,表面积不足,不利于细胞黏附,其堆叠后作为骨填充物过于密实,微囊间孔隙太小,不利于细胞传导,此外微囊直径<10 μm容易被吞噬细胞吞噬,微囊直径>200 μm容易引起细胞免疫反应[11],因此直径100~200 μm的微囊粒径较为理想。常用的乳液挥发法制备的微囊越小则越趋向于形成单一规则囊腔,若微囊直径越大则囊腔数量、分布越不规则,从无囊腔到数个甚至众多较小囊腔密集分布,如此则既无法控制药物载量也无法调控缓释[12]。所以传统工艺制备的PLGA 微囊难以兼具百微米的较大直径和单一、规则并可控的囊腔[13-14]。
本研究中所制得的PLGA微囊为规则的球形,具有良好的生物相容性,表面适宜贴壁型细胞黏附生长,且微囊粒径分布集中度较高,平均为167.58 μm,堆叠后形成的骨填充支架具备同样级别尺寸的高度连通的孔隙,使其整体呈现优良的细胞传导性。双通道微量同轴注射法在稳定获得大直径微囊的基础上,成功在单个微囊内获得了单一规则的囊腔,更为重要的是微囊囊壁的厚度可通过控制制备参数而改变。
实验结果表明两种微囊均可在60 d 左右基本完成降解。不同囊壁厚度的微囊取同等质量用作降解实验,且二者的PLGA原料相同,所以降解速度无明显差别。而囊壁越薄的微囊越早破损,越早释出包封的内容物,因此理论上可以认为控制了囊壁的厚度等同于控制了微囊内因子的释出时间。囊壁越薄包封的细胞因子量越大,释放越早,也越能更早诱导周围组织中细胞向骨缺损区趋化。然而囊壁过薄必然带来微囊强度下降、降解时间过短以及因子突释等缺陷[12]。应用组织工程技术引导骨再生时骨填充物的空间维持能力是决定最终效果的一个重要因素,而空间维持能力又取决于材料的强度和降解速度[15]。填充材料强度过低或降解过快皆不利于骨修复空间的维持。所以本研究中所制备的缓释型PLGA微囊还需要根据最终应用场景的需求精确调整制备参数。
本研究首创的微量注射泵双通道同轴注射法制备的缓释型PLGA微囊相较于传统乳液挥发法微囊,制备方法简单,原材料的利用率大大提高,微囊粒径分布集中,且所获微囊在百微米直径的基础上具备单一规则的囊腔。新制备方法中的PLGA分子量、溶液浓度、双通道各自的注射速度及收集装置中液体的搅拌速度的变化,都会对最终微囊的直径和囊壁厚度产生影响[16]。本研究经过初步探索,在维持约167.58 μm 粒径的基础上,稳定获得了两种不同囊壁厚度的微囊。Transwell 细胞迁移实验提示载有BMP⁃2的PLGA微囊对成骨细胞具有诱导作用,且因薄型PLGA 微囊早期因子释放量大于厚型微囊,趋化作用更明显。对该新方法各项制备参数的调控影响仍需进一步研究,也需要体内实验的进一步验证,本研究结果为开发可控性骨组织工程技术材料提供了一种新思路。
