LC⁃MS/MS 法同时测定大鼠血浆中来那度胺、伏立诺他和地塞米松的浓度
2022-09-14张馨予颜月园胡玉涛
张馨予,颜月园,刘 刚,胡玉涛
1江苏联合职业技术学院连云港中医药分院,江苏 连云港 222007;2连云港市药物研发共性技术中心,江苏 连云港222007
来那度胺是一种免疫调节类的抗肿瘤药,可直接诱导肿瘤细胞凋亡[1]。来那度胺联合其他药物如硼替佐米、沙利度胺等治疗肿瘤的临床试验也成为近年来国内外研究的热点[2-5]。地塞米松是临床上常用的一种糖皮质激素,临床上主要用于治疗过敏性皮炎、支气管哮喘和风湿性关节炎等疾病[6]。地塞米松常与其他药物联用治疗疾病[7],如地塞米松与来那度胺的联合用药,临床上主要用于治疗多发性骨髓瘤[8-11]。伏立诺他是一种新型分子靶向抗肿瘤药物,通过抑制组蛋白去乙酰化酶的活性而使细胞周期停滞和/或细胞凋亡,它在骨癌的治疗中也受到重视。研究表明,来那度胺、伏立诺他和地塞米松三者联合用药在治疗多发性骨髓瘤方面具有临床研究价值[12-13],因此同时监测来那度胺、伏立诺他和地塞米松的血药浓度对于三者的联合用药研究具有重要意义。
目前,研究人员多采用液相色谱法(liquid chro⁃matography,LC)、液相色谱⁃质谱联用法(liquid chro⁃matography⁃mass spectrometry,LC⁃MS)测定来那度胺、伏立诺他或地塞米松其中的一种[14-18]或进行联合用药分析[4-5],文献调研显示未发现同时定量大鼠血浆中来那度胺、伏立诺他和地塞米松的报道。近年来,因灵敏度高、稳定性好,LC⁃MS 法越来越多地应用于药物分析领域,尤其是固相萃取及超高效色谱分离技术,使得高通量样品定量检测成为可能[19-20]。本研究建立了固液萃取法处理血液样品,LC⁃MS/MS 法同时检测两种组分,定量限满足生物微量含量分析,为来那度胺,伏立诺他、地塞米松的联合用药提供了重要研究基础。
1 材料和方法
1.1 材料
来那度胺(批号20200516)、伏立诺他(批号20191116)、地塞米松(批号20191025),内标物甲糖宁(批号20191114),均由南京泽朗生物科技有限公司提供,对照品经HPLC 峰面积归一化法检测,质量分数均在98.6%以上。甲醇(Merk公司,德国)、乙腈(国药集团)为色谱纯;超纯水经过Milli⁃Q系统纯化制备;其余试剂均为分析纯,购自北京国药集团。
安捷伦三重四级杆1290 LC⁃6460 QQQ 串联质谱仪(配有四元低压梯度泵和MassHunter 工作站,安捷伦公司,美国)、Eppendorf 5427 R低温高速离心机(Eppendorf公司,德国),Mettler ME155DU 型十万分之一电子分析天平(梅特勒⁃托利多仪器有限公司,美国),Oasis®HLB 固相萃取柱(规格60 mg,沃特世公司,美国)。
1.2 方法
1.2.1 仪器条件
色谱柱为Agilent Zorbax Eclipse Plus C18柱(100 mm×2.1 mm,1.8 μm);流动相为5 mmol/L乙酸铵+0.1%甲酸水溶液⁃乙腈。梯度洗脱:0~1.5 min,20%~30% 乙 腈;1.5~2.0 min,30%~35%乙 腈;2.0~2.5 min,35%乙腈;系统平衡3 min;体积流量0.6 mL/min;柱温35 ℃;进样量5 μL。
质谱采用电喷雾正离子源(ESI+源),多反应监测(multiple reaction monitoring,MRM)模式;驻留时间为100 ms。检测离子的质核和碰撞电压:来那度胺m/z 260→149,13 eV;地塞米松m/z 393→355,5 eV;伏立诺他m/z 265→232,13 eV;内标甲糖宁m/z 271→155,37 eV。检测电压3.5 kV;离子源温度120 ℃;锥孔电压220 V;脱溶剂温度350 ℃;脱溶剂气体(N2)体积流量9 L/min。
1.2.2 溶液的制备
混合对照品溶液:分别取来那度胺、伏立诺他、地塞米松对照品适量,精密称定,单独以甲醇溶解来那度胺,以70%甲醇溶解伏立诺他和地塞米松,并定容,制成质量浓度分别为1.03、1.04、1.03 mg/mL的对照品储备液;分别精密量取适量储备液于同一容量瓶中,以甲醇稀释至刻度,配制得系列混合对照品工作液,低温避光保存。
内标工作液:取甲糖宁对照品10 mg,精密称定,置于10 mL 容量瓶中,用甲醇溶解并稀释至刻度,摇匀,得质量浓度为1 mg/mL 的内标储备液。临用前将内标储备液用甲醇稀释成质量浓度为40 μg/mL 的内标工作液。
1.2.3 动物实验
8只雄性(190±25)g SD大鼠购自南京市青龙山实验动物养殖中心(SCXK 2008⁃0033)。大鼠适应环境饲养6 d,维持温度24~27 ℃,湿度(50±10)%,实验前12 h 停止进食,饮用水一直供饮,动物实验遵守相关动物管理准则,给药4 h后可进食。
取来那度胺、伏立诺他、地塞米松对照品适量,精密称定,加0.5%甲基纤维素溶液制成三者质量浓度分别2.01、2.01、1.98 mg/mL的混合水悬液。
灌胃前每只大鼠眼眶取无药空白血液用于标准血浆样品及质控(quality control,QC)样品的制备。灌胃针给每只大鼠灌胃药物溶液(10 mL/kg),灌胃后10、20、30、45 min 及1、2、3、5、12、18 h 时间点进行大鼠眼眶取血,约0.25 mL 血液样品收集在K2⁃EDTA 离心管中,立即以4 ℃、6 000 r/min 离心10 min,制得血浆样品,进样分析前贮存于-20 ℃环境下。
1.2.4 标准血浆样品及QC样品的制备
标准血浆样品:分别精密量取上述系列混合对照品工作液适量,加入100 μL 空白血浆中,制成6 个浓度梯度的混合标准血浆样品,含来那度胺质量浓度范围为1.03~515.00 ng/mL、伏立诺他1.04~520.00 ng/mL、地塞米松1.03~515.00 ng/mL。每个标准血浆样品中含内标(internal standard,IS)甲糖宁200 ng。
空白血浆中制备成低、中、高3 个浓度水平的QC 样品:来那度胺(1.03、103.00、515.00 ng/mL)、伏立诺他(1.04、104.00、520.00 ng/mL)和地塞米松(1.03、103.00、515.00ng/mL)。
1.2.5 血浆样品处理
先加入1 mL 甲醇冲洗,后加入1 mL 超纯水冲洗以活化固相萃取小柱。取空白、标准血浆或用药后血浆样品100 μL,置1.5 mL 无菌离心管中,加入5 μL IS(40 μg/mL),涡旋40 s 混匀,取混合溶液装载进活化后的固相萃取柱,加入1 mL超纯水冲洗小柱,后加入1.2 mL 甲醇洗脱,取甲醇洗脱液于试管中,35 ℃N2吹干,加入100 μL 80%甲醇水溶液复溶,涡旋振荡40 s,4 ℃低温12 000 r/min离心5 min,取上清进样5 μL 进行分析。
1.2.6 方法学考察
专属性:取6份不同来源的空白大鼠血浆,配制加入对照品的标准血浆样品,取大鼠灌胃服药后的血浆样品,分别进行分析以考察方法专属性,记录质谱MRM图。
线性关系和最低定量限(lower limit of quantifica⁃tion,LLOQ):取含IS的标准血浆样品,以血浆中被分析物的浓度(x)为横坐标,被分析物与IS的峰面积比(y)为纵坐标,进行线性回归(权重因子为1/x2)。在信噪比S/N ≥10时,重复分析5次标准血浆样品,其精密度的相对标准偏差(relative standard deviation,RSD)应≤15%,准确度的误差在参考值80%~120%内的标准血浆样品中的最低浓度为LLOQ[21]。
精密度和准确度:为考察日内和日间精密度与准确度,用空白血浆制成低、中、高质量浓度QC 样品各3 份,连续测定3 d,用建立的定量标准曲线计算相应的质量浓度。
提取回收率和基质效应:配制低、中、高浓度的QC 样品,每个浓度平行制备5 份,按前述蛋白沉降方法处理后进行液质分析,记录质谱响应峰面积为C。空白血浆处理后添加对照品工作液,制备QC同浓度的溶液,进样分析,记录峰面积为B。同浓度的对照品工作液,不加血浆直接进样记录峰面积为A。内源性物质引起的基质效应表示为B/A×100%,提取回收率为C/B×100%。
稳定性:为排除外界因素对测试结果的影响,分析血浆QC 样品在不同储存条件下以考察稳定性,分别考察样品在室温下储存24 h 的短期稳定性、在-20 ℃下储存14 d 的长期稳定性、3 次冷冻⁃解冻循环后(-20~20 ℃)的稳定性、在4~6 ℃下放置在仪器进样器内12 h 的后处理稳定性,采用冻融样品与新鲜制备的样品对照获得准确度数据。
2 结果
2.1 专属性
空白样品和标准血浆样品的典型质谱图谱见图1,各化合物的分离度合适,血浆中的内源性物质对检测无干扰。
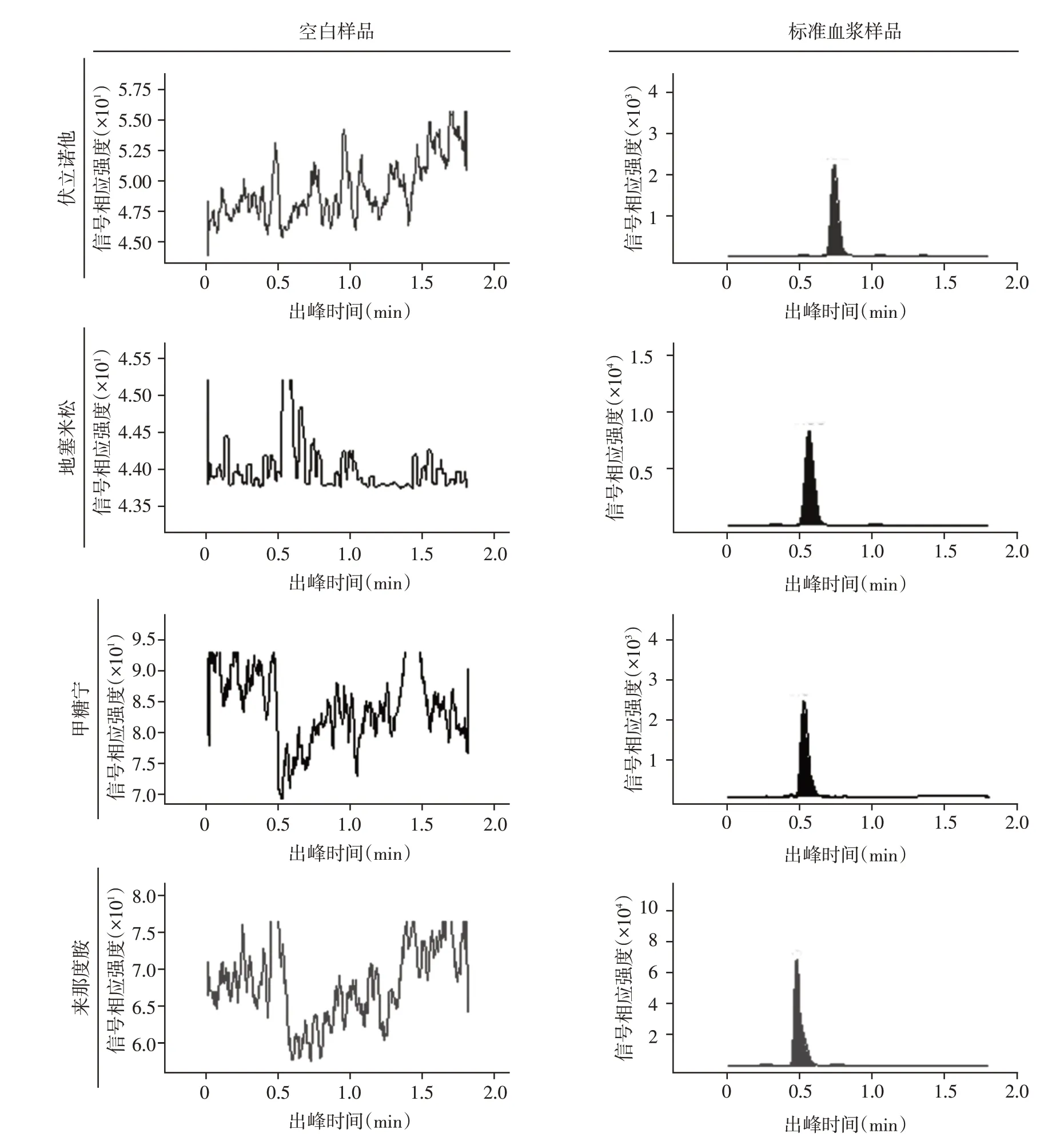
图1 来那度胺、伏立诺他和地塞米松的空白和标准血浆样品的MRM质谱图Figure 1 MRM mass spectra of blank and standard plasma samples of lenalidomide,vorinostat and dexamethasone
2.2 线性关系和LLOQ
结果表明,来那度胺、伏立诺他和地塞米松在各自的浓度范围内线性关系良好(R2≥0.995),线性方程分别为Y=0.038 1X-0.958 9(R2=0.998 3),Y=0.006 8X-0.1308(R2=0.997 9)和Y=0.015 8X-0.723 2(R2=0.996 8),3 种化合物的LLOQ 分别达到1.03、1.04、1.03 ng/mL,显示出该法适合微量分析。
2.3 精密度和准确度
结果显示,来那度胺、伏立诺他和地塞米松的各浓度QC 样品的日内和日间精密度RSD 均小于7.4%,准确度为94.7%~106.7%(表1)。
2.4 提取回收率和基质效应
分析结果见表1。极性均较小的来那度胺、伏立诺他和地塞米松的基质效应均在92.3%~109.7%,基质效应不明显。提取回收率在87.4%~103.6%之间,能够满足生物样品浓度测定的要求。在实验过程中,考察IS 的提取回收率和基质效应(n=5)分别为(91.7±6.7)%和97.2%~104.4%。
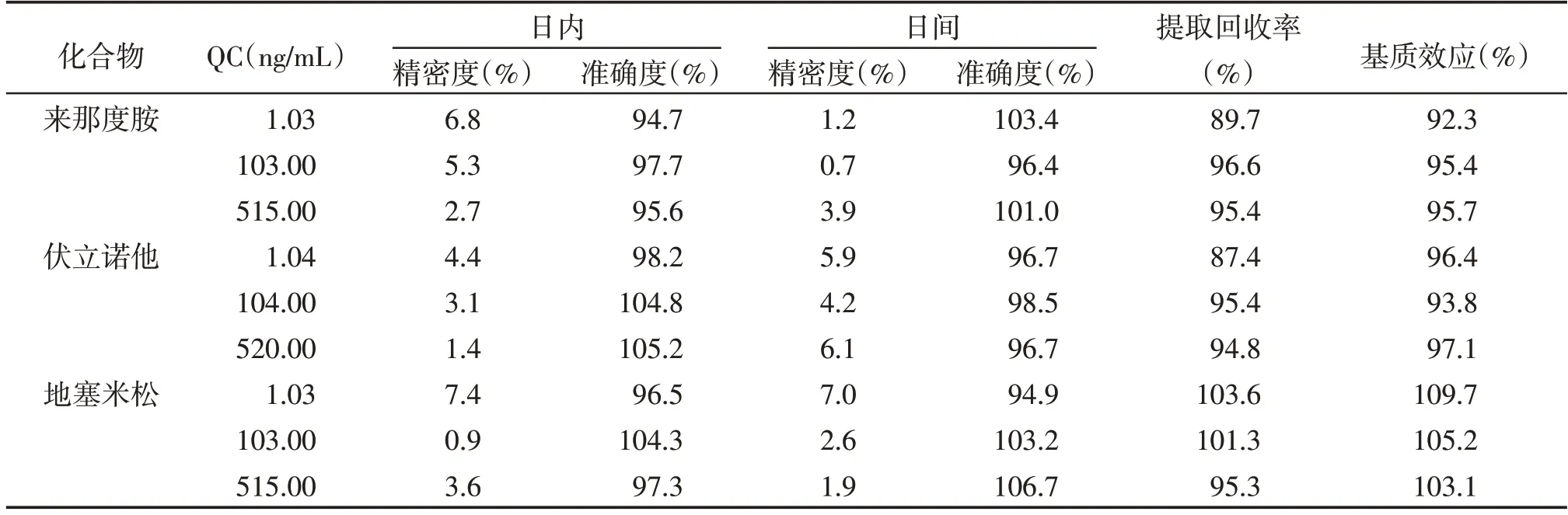
表1 精密度、准确度、提取回收率和基质效应结果Table 1 Results of precision,accuracy,extraction recovery and matrix effect
2.5 稳定性
结果见表2。准确度误差均符合要求[(100.0±12.8)%],结果表明来那度胺、伏立诺他和地塞米松的血浆样品在上述储存条件下性质稳定。
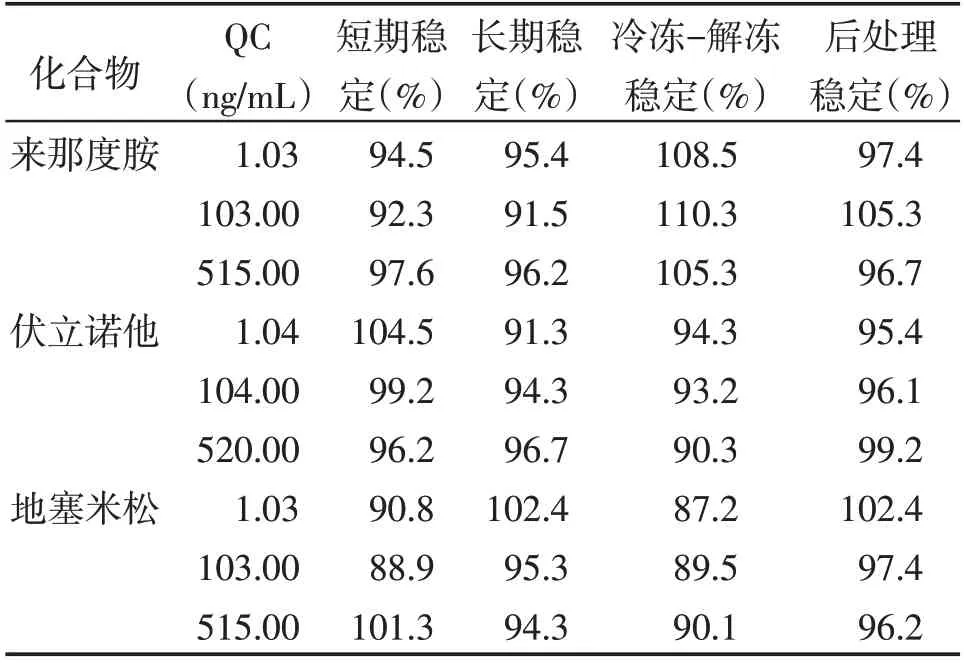
表2 不同条件下来那度胺、伏立诺他和地塞米松稳定性结果Table 2 The stability of lenalidomide,vorinostat and dexamethasone at different conditions
2.6 药代动力学研究
方法学考察后,该方法应用于大鼠血浆中来那度胺、伏立诺他和地塞米松的定量分析,血药浓度曲线见图2。
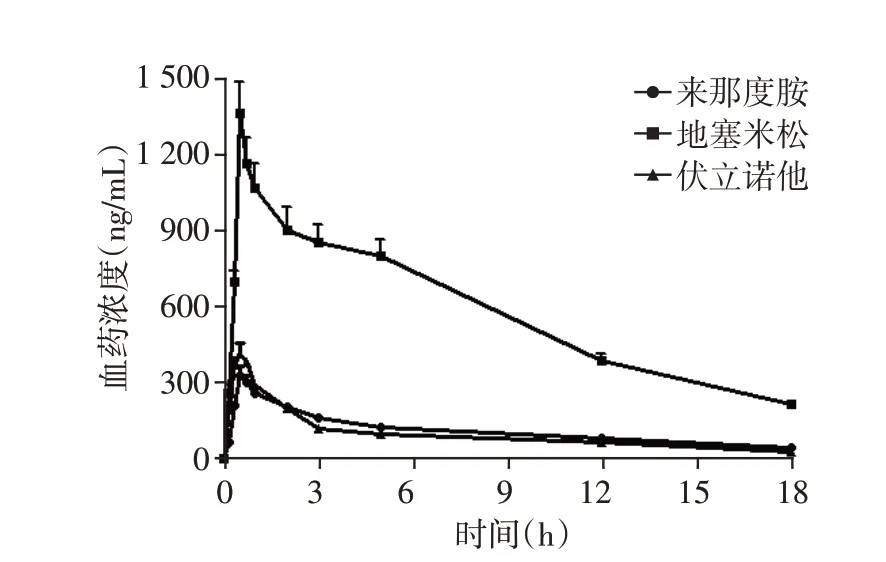
图2 单剂量口服给药后来那度胺、伏立诺他和地塞米松的血药浓度⁃时间曲线(n=8)Figure 2 Plasma concentration⁃time curves of the lenalid⁃omide,vorinostat and dexamethasone after a single oral administration(n=8)
来那度胺、伏立诺他和地塞米松在给药2 h 以内均能达到最大血药浓度(Cmax),分别为(327.7±37.2)ng/mL、(413.6±40.2)ng/mL 和(1 362.8±125.6)ng/mL,总体而言,上述药品都能很快吸收,在给药12 h时来那度胺、伏立诺他和地塞米松的含量仍高于LLOQ。和其他研究相比,各化合物的药代动力学结果有所不同,原因可能是联合用药导致药药协同作用。
3 讨论
预实验中,为选择最佳血浆处理方法,考察比较了液液萃取法、固液萃取法、蛋白沉淀法对被分析物提取效率的影响。液液萃取法选择性好,可以获得较小的基质效应,但提取率的重复性差;蛋白沉淀法处理血浆样品简单、快速,但基质效应明显,固液萃取法的提取回收率和基质效应结果都较好,操作省力,故采用固液萃取法。
根据指标性成分的理化性质和色谱行为,比较了以甲醇、乙腈与水、甲酸⁃水、磷酸⁃水、乙酸铵+甲酸构成的洗脱系统。结果表明,以甲醇⁃水或酸水为系统各成分的分离效果不理想,乙腈⁃酸的流动相系统色谱峰的对称性不好,经优化后的乙腈⁃乙酸铵+甲酸⁃水的流动相可使各成分的分离效果较好,分离度符合要求,基线较平稳。本研究选择梯度洗脱,可改变被分析物的保留时间,从而提高被分析与共流出物的分离度以减小基质效应。
IS 在生物样品定量分析中用来修正提取过程中损耗,本研究的化合物结构、提取回收效果均有较大差异,虽然氘化标准品是最佳内标物选择,但是这种IS 价格贵且不一定有售。甲糖宁的提取回收方式、质谱分析条件和来那度胺、伏立诺他、地塞米松有很大相似性,甲糖宁的洗脱时间和3 个待测物不同,对待测物峰型和分离度的影响小,同时价廉易得,因此,本研究选择甲糖宁为IS。
综上,本研究建立了同时测定大鼠血浆中来那度胺、伏立诺他和地塞米松的LC⁃MS 方法,并应用于大鼠药代动力学研究。经方法学验证,该方法可同时测定来那度胺、伏立诺他和地塞米松的血药浓度,且快速、经济,为这些药物的研究提供了重要的分析手段。
