生长分化因子15对福尔马林诱导双相疼痛的镇痛作用及机制的初步探究
2022-09-14朱写译黄金路李欣燕
朱写译,黄金路,李欣燕*
1上海交通大学药学院,上海 200240;2上海交通大学附属第六人民医院药剂科,上海 200233
国际疼痛研究学会(International Association for the Study of Pain,IASP)于2020 年对疼痛的定义进行了更新,将疼痛定义为一种与实际存在或潜在的组织损伤相关的令人不快的感觉和情感体验,或与其相似的经历[1-2]。按照病程分类,疼痛可分为急性疼痛和慢性疼痛。急性疼痛为新近产生的、持续时间较短的疼痛,与明确的损伤或疾病有关,有着急性警告的功能。慢性疼痛被认为是持续超过正常愈合时间的疼痛,通常当疼痛持续或复发超过3~6 个月时可被视为慢性疼痛,其严重损害患者的身心健康[3]。在中国,约30%的人口受到慢性疼痛的困扰,其中大部分是年长患者,尤其是65 岁以上的老年人,有80%~85%的人患有疼痛相关疾病[4]。当患者处于长期疼痛难忍的状态下,不仅会影响患者的身体功能,通常还会伴随有焦虑、抑郁等心理疾病的发生,严重影响患者的正常生活。同时,长期的疼痛治疗也会给患者和社会造成巨大经济负担。目前,临床上治疗疼痛的药物主要有非甾体类抗炎药、阿片类药物以及一些辅助性镇痛药物。然而这些药物在临床上使用时,在安全性和有效性方面存在一定局限性,因此对新型镇痛药存在紧迫的需求。
生长分化因子15(growth differentiation factor 15,GDF⁃15),又称巨噬细胞抑制性细胞因子1(macro⁃phage inhibitory cytokine⁃1,MIC⁃1)、NSAID激活基因⁃1(NSAID activated gene⁃1,NAG⁃1)、胎盘转化生长因 子⁃β(placental transformation growth factor⁃β,PTGFB)或前列腺衍生因子(prostate derived factor,PDF)[5],属于转化生长因子β(transforming growth factor β,TGF⁃β)超家族成员。它是由Bootcov等[6]于1997 年首次从人骨髓单核细胞系U937 的cDNA 文库中分离并鉴定出,由308个氨基酸组成,在N端含有29个氨基酸的信号肽,成熟肽的长度为195~308个氨基酸。研究发现GDF⁃15在细胞内以多种形式存在:GDF⁃15前体单体(40 kDa)、GDF⁃15前体二聚体(80 kDa)以及成熟的GDF⁃15 二聚体(30 kDa)[5]。GDF⁃15受体胶质细胞源性神经营养因子家族α样受体(glial cell⁃line derived neurotrophic factor receptor alpha⁃like,GFRAL)是胶质细胞源性神经营养因子家族(glial cell derived neurotrophic factor,GDNF)的成员。在功能上,GDF⁃15与多种疾病相关,目前已报道的有肥胖[7]、糖尿病[8]、心衰和心肌梗死[9]、慢性阻塞性肺疾病[10-11]、癌症及恶病质[12]以及炎症[13]。然而,GDF⁃15 在疼痛中的作用目前研究很少,机制尚不十分清楚。因此,本研究采用经典的福尔马林诱导双相疼痛模型探讨了GDF⁃15 对疼痛的作用,并在此基础上初步探究了GDF⁃15的镇痛作用机制。
1 材料和方法
1.1 材料
重组人GDF⁃15 蛋白(His 标签)(货号:10936⁃H07Y,北京义翘神州有限公司);Anti⁃GFRAL 兔多克隆抗体(货号:ab235111,Abcam公司,美国);神经元核抗原(neuronal nuclei antigen,NeuN)鼠单克隆抗体、离子钙结合衔接分子1(ionized calcium bind⁃ing adapter molecule 1,Iba⁃1)鼠单克隆抗体、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)鼠单克隆抗体(Millipore 公司,德国);Alexa⁃555⁃标记的羊抗兔二抗、Alexa⁃488 标记的羊抗小鼠二抗(Invitrogen 公司,美国);TRIzol(Thermo Fisher 科技公司,美国);cDNA 逆转录试剂盒(Toyobo 有限公司,日本);Hieff®qPCR SYBR Green Master Mix(上海翌圣生物科技股份有限公司)。
激光共聚焦显微镜SP8 型、恒温冰冻切片机切片(Leica公司,美国);电泳仪、电转仪(Bio⁃Rad Labo⁃ratories 公司,美国);荧光实时定量PCR 仪(Eppen⁃dorf有限公司,德国)。
8~12周龄雌性KM小鼠(体重22~25 g左右),购自上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2003⁃0003。饲养于上海交通大学药学院实验动物中心,饲养环境温度为(22 ± 2)℃,湿度为(55 ±5)%,光照时间为7:00~19:00,水与食物供应充足,可自由摄取。所有动物实验均经上海交通大学实验动物伦理与使用委员会批准(批准编号:202201002)。
1.2 方法
1.2.1 福尔马林诱导双相疼痛模型的建立与给药方法
GDF⁃15鞘内注射给药:16只KM小鼠分2组,每组8 只,分别为溶剂对照组和实验组。实验前将小鼠放置于透明有机玻璃制成的观察笼中30 min以上以适应环境。实验组鞘内注射GDF⁃15溶液(50 ng,由生理盐水配制,体积为5 μL),溶剂对照组则鞘内注射生理盐水5 μL。小鼠鞘内注射具体方法为:小鼠仰卧位固定,覆盖其头部待其冷静,左手食指与拇指定位小鼠髂骨处,右手食指沿脊柱寻找到髂骨中线处的L5、L6 椎节间隙并标记,将注射器针头沿60°夹角插入标记处,当感觉到阻力时,将角度调整为30°夹角,并将针尖插入L5、L6 椎间隙中,如小鼠出现甩尾或后肢抽动表示操作成功,缓慢将GDF⁃15溶液或生理盐水注入蛛网膜下腔,控制注射时间为10~30 s,不可速度过快,注射完成后轻轻旋转针头拔出,观察小鼠是否恢复正常运动功能,恢复后即可进行后续实验。
给药后立即在小鼠左足部皮下注射浓度为5%的福尔马林溶液(由0.9%生理盐水配制,现配现用)10 μL,注射后将小鼠放回观察笼内。分别记录小鼠在注射福尔马林后0~5 min(Ⅰ相急性疼痛期)和20~40 min(Ⅱ相炎性疼痛期)内疼痛反应(舔足/咬足)总时长。
GDF⁃15腹腔注射给药:32只KM小鼠分4组,每组8只,分别为溶剂对照组和3个不同剂量GDF⁃15实验组。实验前将小鼠放置于透明有机玻璃制成的观察笼中30 min以上以适应环境,给药方式为腹腔注射GDF⁃15 溶液,分为高剂量组(100 μg/kg)、中剂量组(30 μg/kg)和低剂量组(10 μg/kg),均由生理盐水配制,溶剂对照组腹腔注射生理盐水10 mL/kg。给药后30 min在鼠左足部皮下注射浓度为5%的福尔马林溶液(由0.9%生理盐水配制,现配现用)10 μL,分别记录小鼠在注射福尔马林后0~5 min(Ⅰ相急性疼痛期)和20~40 min(Ⅱ相炎性疼痛期)内疼痛反应(舔足/咬足)总时长。
1.2.2 蛋白免疫印迹
取小鼠大脑、小脑以及脊髓组织,RIPA 组织裂解液(已含10%的蛋白酶抑制剂PMSF)提取总蛋白,BCA 法测定总蛋白浓度,加入5×SDS 上样缓冲液后,100 ℃条件下蛋白变性,-20 ℃保存。取等量蛋白进行SDS⁃PAGE 凝胶电泳,冰上转膜,5%脱脂奶粉封闭,4 ℃一抗孵育过夜,一抗包括GAPDH 抗体(1∶20 000)以及GFRAL 抗体(1∶1 000),TBST 漂洗4次,每次10 min,室温相应二抗孵育1 h,TBST漂洗4 次,每次10 min。用Image J 软件对蛋白条带进行扫描分析,以GAPDH 条带(36 kDa)为内参,比较目的蛋白条带(45 kDa)的表达水平。
1.2.3 组织免疫荧光
小鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉,用20 mL 生理盐水和20 mL 4%的多聚甲醛进行灌注。灌注结束后取出脊髓置于生理盐水中,剥离脊髓外膜,将脊髓腰膨大部分置于4%多聚甲醛中过夜,不同浓度蔗糖溶液依次进行脱水,脱水完成后使用OTC 进行包埋,并用Leica 恒温冰冻切片机切片,附于多聚赖氨酸处理的载玻片上。用含0.5%Triton⁃X100和5%BSA的PBS室温封闭60 min,一抗4 ℃孵育过夜,一抗包括GFRAL 抗体(1∶50)、Iba⁃1 抗体(1∶100)、GFAP 抗体(1∶100)以及NeuN 抗体(1∶100),PBS 漂洗3 次,用相应二抗室温孵育60 min,PBS漂洗4次,并用含DAPI 的抗荧光淬灭封片剂封片。Leica激光共聚焦显微镜SP8 型进行观察。
1.2.4 RT⁃PCR
鞘内给药即中枢给予GDF⁃15 进行福尔马林双相疼痛实验后,处死小鼠,取出脊髓组织,用TRIzol提取所取组织中的总RNA,按cDNA 逆转录试剂盒的步骤与程序制备cDNA,根据qPCR SYBR Green Master Mix 两步法反应体系对cDNA 进行扩增。内参为β⁃actin,用2-ΔΔCt法计算RNA表达量。白细胞介素(interleukin,IL)⁃6、IL⁃1β、前脑啡肽(proenkeph⁃alin,PENK)、肿瘤坏死因子(tumor necrosis factor,TNF)⁃α、强啡肽原(prodynorphin,PDYN)、β⁃actin引物序列如表1。

表1 RT⁃PCR引物序列Table 1 RT⁃PCR primer sequences
1.3 统计学方法
使用GraphPad Prism 7.0 软件进行数据处理与统计分析,数据以均值±标准误()表示。两组之间的比较采用非配对t检验,多组之间的比较采用单因素方差分析(one⁃way ANOVA),两两比较采用SNK⁃q检验,P<0.05为差异有统计学意义。
2 结果
2.1 中枢给予GDF⁃15对小鼠福尔马林诱导双相疼痛反应的影响
在福尔马林双相疼痛实验中,比较0~5 min(Ⅰ相急性疼痛期)以及20~40 min(Ⅱ相炎性疼痛期)内舔足和咬足的总时长作为痛阈值,结果如图1所示,在Ⅱ相炎性疼痛期,与溶剂对照组相比,GDF⁃15鞘内给药组小鼠舔足和咬足的总时长显著降低(P<0.05);而两组小鼠的Ⅰ相急性疼痛期舔足和咬足的总时长差异没有统计学意义。

图1 鞘内注射GDF⁃15对福尔马林诱导双相疼痛的影响Figure 1 Effects of intrathecal injection of GDF⁃15 pro⁃tein on formalin induced pain
2.2 系统性给予GDF⁃15对小鼠福尔马林诱导双相疼痛反应的影响
在Ⅰ相急性疼痛期,各剂量的GDF⁃15 腹腔注射组与溶剂对照组相比,福尔马林Ⅰ相急性疼痛期阈值无显著性差异(图2A);而在Ⅱ相炎性疼痛期,与溶剂对照组相比,各剂量的GDF⁃15 腹腔注射组小鼠的舔足和咬足的总时长均显著性降低,且呈剂量依赖性,最大镇痛效应Emax可达到82.2%,半数有效量ED50为14.0 μg/kg(图2B)。
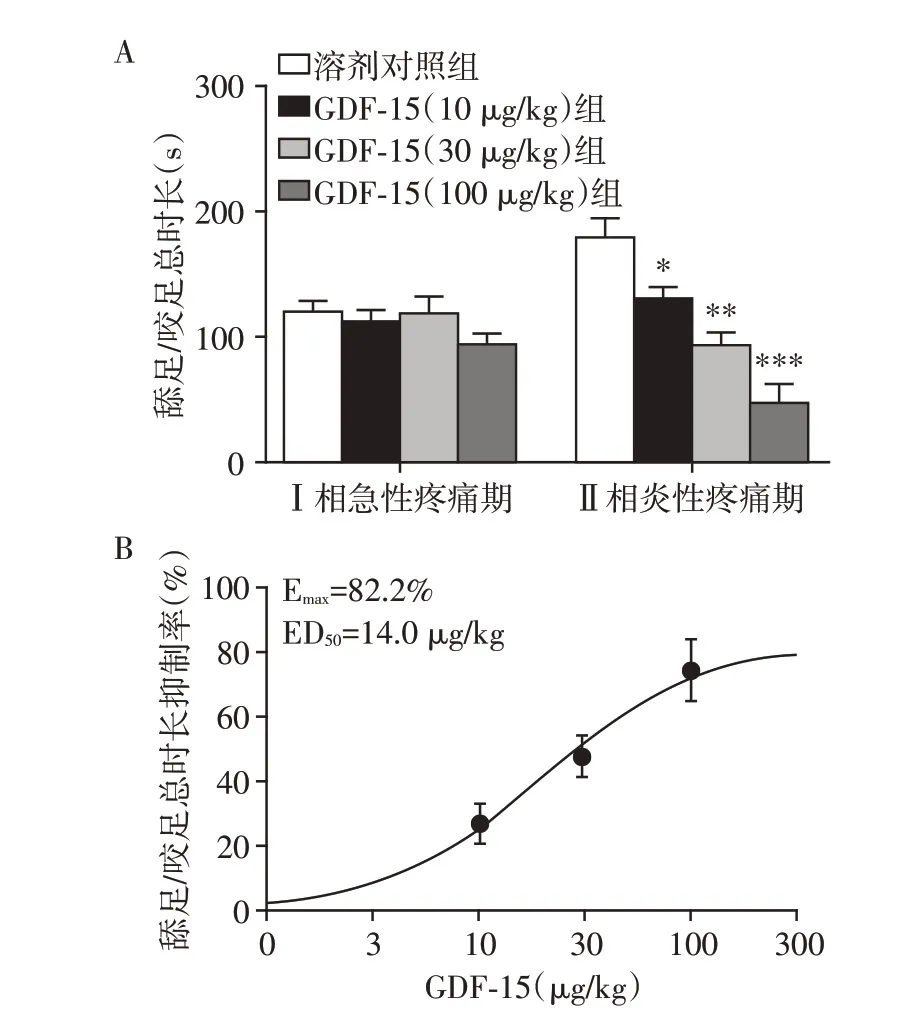
图2 腹腔注射GDF⁃15蛋白对福尔马林双相疼痛的影响Figure 2 Effects of intraperitoneal injection of GDF⁃15 protein on formalin induced pain
2.3 GDF⁃15特异性受体GFRAL的表达部位
GDF⁃15 的特异性受体GFRAL 在中枢系统的大脑、小脑以及脊髓中均有蛋白表达(图3A)。而根据组织免疫荧光结果(图3B)显示,在脊髓背角中,GFRAL蛋白与神经元标志物蛋白NeuN存在显著共染,且不与小胶质细胞标志物蛋白Iba⁃1 共表达,也不与星形胶质细胞标志物蛋白GFAP 共表达。

图3 GFRAL的表达情况Figure 3 Expression of GFRAL
2.4 中枢给予GDF⁃15对IL⁃6、IL⁃1β、TNF⁃α、PDYN以及PENK的mRNA表达的影响
GDF⁃15 鞘内注射组福尔马林诱导双相疼痛模型小鼠的脊髓中IL⁃6和TNF⁃α的表达量相较溶剂对照组显著降低(图4)。GDF⁃15处理组脊髓中IL⁃6的mRNA 表达降低至对照组的54%(P<0.05),TNF⁃α的mRNA 表达降低至对照组的28%(P<0.005),GDF⁃15 处理组脊髓中IL⁃1β、PDYN 以及PENK mRNA 与对照组相比均有不同程度的升高,但两组之间差异无统计学意义。

图4 鞘内注射GDF⁃15 对福尔马林小鼠IL⁃6、TNF⁃α、PDYN、PENK和IL⁃1β mRNA表达的影响Figure 4 Effects of intrathecal injection of GDF⁃15 on the mRNA expression of IL⁃ 6,TNF⁃α,PDYN,PENK and IL⁃1β
3 讨论
GDF⁃15被发现在多种疾病中明显上调,被认为是许多疾病的标志物。本研究创新性地研究了GDF⁃15 与疼痛之间的关系。采用了经典的福尔马林诱导疼痛模型,在实验动物的后足背部皮下注射福尔马林后可以产生双相疼痛反应:Ⅰ相急性疼痛和Ⅱ相炎性疼痛。Ⅰ相急性疼痛主要是因为初级伤害性传入神经的直接活化而引起的急性疼痛,而Ⅱ相炎性疼痛则涉及炎症引起的脊髓背角中枢敏化[14]。在本实验室,福尔马林模型已被用于多个镇痛靶点的验证:D⁃型氨基酸氧化酶[15](D⁃amino acid oxidase,DAAO)、甘氨酸受体[16](glycine receptor,GlyR)、胰高血糖素样肽⁃1受体[17](glucagon⁃like pep⁃tide 1 receptor,GLP⁃1R)等,同时针对这些靶点在该模型上也筛选了数十个有镇痛作用的小分子化合物、中草药成分、大分子多肽类等,其中小分子化合物有CBIO[15](DAAO 特异性抑制剂)、钩吻碱[16](α3甘氨酸受体激动剂)等,中草药有京尼平苷[17]、乌头类生物碱[18]、花椒素[19]等;多肽类有艾塞那肽等。
本研究首先通过中枢给药方式证明了GDF⁃15对福尔马林诱导的Ⅱ相炎性疼痛有显著镇痛作用,而对福尔马林诱导的Ⅰ相急性疼痛未见明显作用。本研究也对GDF⁃15在中枢的作用靶点进行了初步探究。GFRAL是GDNF的成员,在2017年被鉴定为GDF⁃15 的特异性受体,GDF⁃15 高度特异性地结合到GFRAL 后,募集Ret 与之结合,发挥一系列病理生理作用[8,20-22]。根据Hsu等[22]报道,GFRAL仅在脑干的最后区和孤束核中表达。但2005 年我国科学家在小鼠体内发现了一种GDNF 受体α样(GDNF receptor⁃α like,GRAL)基因[23],其编码的蛋白在中枢神经系统包括大脑、小脑和脊髓中表达,氨基酸序列比对发现GRAL 与GFRAL 为同一蛋白。本研究中通过Western blot 和组织免疫荧光方法确定了GDF⁃15 特异性受体GFRAL 在大脑、小脑以及脊髓中均存在表达,并首次提出在疼痛产生的关键部位脊髓背角中,GFRAL仅在神经元细胞上表达。提示GDF⁃15 可能通过脊髓背角神经元上的GFRAL受体发挥中枢镇痛作用,但此推论需要进一步实验,如设计GFRAL 小干扰RNA 和采用电生理技术等进行验证。
此外,诸多研究表明GDF⁃15 是一种与炎症相关的因子[13,24]。当炎症发生时,GDF⁃15起到保护作用。在体内实验中,给予脂多糖(lipopolysaccharide,LPS)能够诱导CD45+/CD11b+骨髓细胞中GDF⁃15表达,而体外实验中,给予LPS能够使骨髓来源的巨噬细胞中GDF⁃15 的表达增加[13];在另一项研究中发现,小鼠静脉给予GDF⁃15 可阻止LPS 和D⁃半乳糖胺诱导的炎症,其机制可能是通过降低IL⁃6、TNF⁃α和IL⁃1β的表达[25]。Kim 等[26]利用NAG⁃1/GDF⁃15转基因小鼠证明其减低LPS 的炎症反应,表现为NAG⁃1/GDF⁃15 转基因小鼠血清炎症因子(IL⁃6、MCP⁃1、TNF等)表达量较野生型降低。本研究通过检验中枢给予GDF⁃15对福尔马林诱导疼痛模型小鼠脊髓IL⁃6、IL⁃1β、TNF⁃α、PDYN 以及PENK 的mRNA 表达的影响,结果也发现,GDF⁃15 可以降低福尔马林诱导疼痛模型小鼠脊髓中促炎因子IL⁃6和TNF⁃α mRNA 的表达,提示抑制促炎因子IL⁃6 和TNF⁃α介导的炎症反应有可能是GDF⁃15 发挥镇痛作用的机制之一。另外,考虑到GDF⁃15 的特异性结合受体GFRAL主要表达于脊髓背角神经元上,而脊髓中IL⁃6 和TNF⁃α主要由胶质细胞分泌,因而鞘内给予GDF⁃15 引起IL⁃6 和TNF⁃α减少可能是由于神经元与胶质细胞之间存在着相互作用。近年来,越来越多的研究表明在胶质细胞和神经元之间存在双向信息交互,一方面胶质细胞对神经元释放的神经递质做出反应,另一方面又通过释放影响神经元和突触活动的细胞因子发挥其作用[27]。有报道称,在骨癌痛模型中,通过鞘内注射能够阻断神经元活化的c⁃Fos 反义寡核苷酸探针(c⁃Fos ASO)后,星形胶质细胞的活化也会受到抑制[28]。另有研究表明,慢性疼痛中,脊髓背角神经元上的大量膜结合型趋化因子CX3CL1转变为为游离型CX3CL1,与小胶质细胞独有的CX3CR1 受体结合,促进小胶质细胞活化,释放促炎细胞因子如TNF⁃α、IL⁃1β、IL⁃6等以介导疼痛信息的传递,形成神经元与小胶质细胞之间的相互作用[29]。因而可以推测鞘内注射GDF⁃15 可能作用于脊髓背角神经元上的受体GFRAL 继而通过神经元⁃胶质细胞信号通路影响胶质细胞的功能,但这一推测尚需要进一步实验进行论证。
本研究还发现,通过系统性给药方式给予GDF⁃15对福尔马林诱导Ⅱ相炎性疼痛有显著镇痛作用,且镇痛作用呈剂量依赖性。根据Hsu 等[22]的报道,GDF⁃15 的特异性受体GFRAL 不在外周组织中表达。但有学者认为在代谢疾病、组织损伤、炎症和癌症等病理条件下,GDF⁃15表达升高所产生的作用是否都依赖于GFRAL仍有待确定,鉴于GDF⁃15对未检测到GFRAL的细胞和组织也能产生多种作用[30],合理推测GDF⁃15可能存在不依赖GFRAL的作用或可能存在GFRAL 以外的尚未被识别的受体。也有报道支持了此推测,Lin 等[31]研究发现外周给予GDF⁃15 可以通过抑制大鼠初级感觉神经元中的河豚毒素抗性Nav1.8 钠通道活性产生镇痛作用。因此,系统性给予GDF⁃15如何发挥镇痛作用,还有待进一步研究。
GDF⁃15具有丰富的生物多效性,参与多种疾病过程。在心肌梗死期间,GDF⁃15可抑制心肌细胞凋亡并保护心肌;在肿瘤发生过程中,GDF⁃15 水平升高,发挥抗炎和抗凋亡作用;GDF⁃15 也参与代谢过程,并显示出优化代谢的效应。这些保护效应使得GDF⁃15备受医学界重视。GDF⁃15已被公认为一种与心力衰竭、糖尿病、肾病和癌症等多种疾病状态相关或预测不良临床结果的生物标志物[32]。而本研究结果则丰富了GDF⁃15 的生物学功能,为充分了解GDF⁃15的作用增加了证据。总之,本研究发现GDF⁃15可能是一个有效的镇痛分子,为疼痛的治疗提供了另一个可能途径。
