重组酶介导的肠出血性大肠杆菌O157:H7等温扩增方法的建立
2022-09-14王源林孙学伟刘宗财汪茂荣
蔡 欣,王源林,赵 杰,匡 衡,孙学伟,刘宗财,崔 茜,杨 展,汪茂荣*
1安徽医科大学八一临床学院东部战区总医院秦淮医疗区肝病科教研室,安徽 合肥 230000;2东部战区疾病预防控制中心,江苏 南京 210002;3中国人民解放军空军93801部队医院医疗所,陕西 咸阳 712201;4南京医科大学第一临床医学院感染病科,江苏 南京 210029;5滨州医学院基础医学院,山东 烟台 264003;6空军军医大学军事预防医学系,陕西 西安 710032;7东部战区空军医院呼吸内科,江苏 南京 210001
肠出血性大肠杆菌(enterohemorrhagicE.coli,EHEC)是一种常见的食源性致病微生物,主要引起食源性疾病[1-3]。EHEC 中主要的致病血清型是O157:H7,是1975 年从1 例出血性结肠炎患者中分离出来的,最早在1982年美国的俄勒冈州和密歇根州暴发流行[4]。由EHEC O157:H7引起的症状主要是非出血性腹泻[5-6],严重的可发展为溶血性尿毒症综合征[7-8]、出血性结肠炎、血栓性血小板减少性紫癜和永久性器官衰竭[9]。目前世界上很多国家中,仍有不少人缺乏干净的饮水和基本医疗卫生保障[10],由EHEC O157:H7造成的感染仍会对大众健康造成威胁,近两年不时有EHEC感染的报道[11-12]。早期发现是应对EHEC O157:H7 传播的最佳策略之一,可以及时控制感染者,遏制其暴发流行。因此,快速检测可以在这个阶段发挥关键作用,检测方法的研究具有重要意义。
之前常用的检测EHEC O157:H7 的方法为PCR 和脉冲场凝胶电泳等[13-14]。这些方法准确性较高,在实验室应用普遍,然而,它们都需要精密的设备和训练有素的人员,成本较高,应用场景有限。在条件有限的情况下,需要一种操作简便、省时省力的检测方法,从而早发现早治疗,为疾病防控赢取时间。重组酶介导的恒温扩增(recombi⁃nase⁃aided amplification,RAA)技术具有检测时间短、操作简便等优点[15-16],所以本研究基于此方法建立了EHEC O157:H7 的快速RAA 荧光法和RAA试纸条法(RAA⁃lateral flow dipstick,RAA⁃LFD),旨在为基层等特殊环境提供简便的筛查EHEC O157:H7的方法。
1 材料和方法
1.1 材料
MiniBEST 质粒纯化试剂盒(TaKaRa 公司,日本);RAA核酸扩增试剂盒(荧光法)、RAA核酸扩增试剂盒(试纸条法)、胶体金侧向流免疫层析试纸条、B⁃6100 RAA 恒温振荡离心仪、F⁃1620 恒温核酸扩增检测仪(江苏奇天基因生物科技有限公司);-20 ℃冰箱(青岛Haier 公司);Eppendorf 移液器(Eppendorf公司,德国)。
1.2 方法
1.2.1 重组质粒构建
从GeneBank 数据库(www.ncbi.nlm.nih.gov/gen⁃bank)中获得EHEC O157:H7 保守基因Stx Ⅰ和StxⅡ的核酸序列,寻找相对保守区域,挑选480 bp 的目的基因合成并导入PUC57质粒中,该质粒的构建由上海生工生物工程股份有限公司完成。以同样的方法构建其他常见的肠道致病菌(金黄色葡萄球菌、沙门氏杆菌、弯曲菌、耶尔森菌、志贺杆菌)质粒模板。
1.2.2 引物探针合成
引物和探针根据RAA引物和探针设计原则,在构建好的重组质粒内运用Primer Premier 5 在该扩增片段上分别设计2条上游引物、5条下游引物和1条探 针,利 用NCBI 网 站(https://www.ncbi.nlm.nih.gov/)的Primer⁃BLAST 验证引物和探针的特异性。所有引物和探针(表1)均由上海生工生物技术有限公司合成,并采用高效液相色谱法(high perfor⁃mance liquid chromatography,HPLC)进行纯化。

表1 RAA荧光检测EHEC O157:H7的引物和探针核酸序列Table 1 Sequences of primers and probe for fluorescent RAA assay for EHEC O157:H7
1.2.3 RAA荧光方法的建立
RAA 荧光法最佳引物的筛选:以含有EHEC O157:H7 DNA序列的质粒作为模板,将设计的2条上游引物、5条下游引物进行2×5组合,结合探针,并与RAA 荧光核酸扩增试剂盒中的其他试剂混合为50 μL 的扩增体系。将反应体系置于B⁃6100 RAA 恒温振荡离心仪中震荡混匀2 min,转移至F⁃1620恒温核酸扩增检测仪,39 ℃反应16 min,每20 s采集1次荧光值。挑选出起峰时间最早、峰值最高的上下游引物组合作为最佳引物。
RAA荧光法引物浓度和探针浓度优化:在50 μL扩增体系中分别加入1.5、1.8、2.1、2.4、2.7 μL原始浓度为10 μmol/L的最佳上下游引物进行扩增,以浓度为1×106拷贝数/μL的EHEC O157:H7质粒为模板进行荧光RAA核酸扩增,筛选出最佳引物浓度。在扩增体系中分别加入0.2、0.4、0.6、0.8、1.0 μL 原始浓度为10 μmol/L 的探针进行扩增,以浓度为1×106拷贝数/μL 质粒为模板进行荧光RAA 法扩增,筛选出最佳探针浓度。
1.2.4 RAA⁃LFD法的建立
在RAA荧光法优化的条件下,将荧光法优化好的引物和探针序列设计成LFD 法的引物和探针。将设计好的引物探针按照RAA 荧光法的50 μL 体系配置反应管,将反应管置于B⁃6100 RAA 恒温振荡离心仪中震荡混匀2 min后,设置反应温度39 ℃,反应时间16 min。反应结束后的扩增产物通过胶体金侧向流免疫层析试纸条检测。从反应管中取5 μL扩增产物,与95 μL PBS缓冲液在1.5 mL EP管中混匀,将试纸条的偶联垫末端垂直插入EP管中,使其接触混合液,2 min 后取出试纸条观察并拍照记录结果(阳性样品出现红色检测线和蓝色质控线,阴性样品不出现红色检测线仅出现蓝色质控线)。
1.2.5 灵敏性实验
以EHEC O157:H7 质粒为模板进行灵敏性评价。将构建质粒按浓度梯度10 倍倍比稀释成1×100~1×109拷贝数/μL阳性标准品备用。利用优化好的两个RAA 反应扩增体系依次对上述定量样品进行测定,确定方法的检出限。
1.2.6 特异性实验
采用与消化道感染相关或者临床症状相近的细菌质粒样本进行特异性评价。以5种在人群中较为常见的肠道细菌如金黄色葡萄球菌、沙门氏杆菌、弯曲菌、耶尔森菌、志贺杆菌及EHEC O157:H7质粒为模板同时进行检测,评价EHEC O157:H7 RAA荧光法和RAA⁃LFD法的特异性。
2 结果
2.1 EHEC O157:H7 RAA 扩增体系的建立
2.1.1 引物、探针筛选
以浓度为1×106拷贝数/μL 的EHEC O157:H7质粒为模板,进行RAA 荧光实验,筛选出最佳上下游引物E⁃F2、E⁃R2,扩增曲线如图1所示(未扩增的引物组合及每组的阴性对照未显示),E⁃F2、E⁃R2引物对在4 min 内即开始起峰,在16 min内达到峰值,表明最佳引物组合为E⁃F2、E⁃R2。
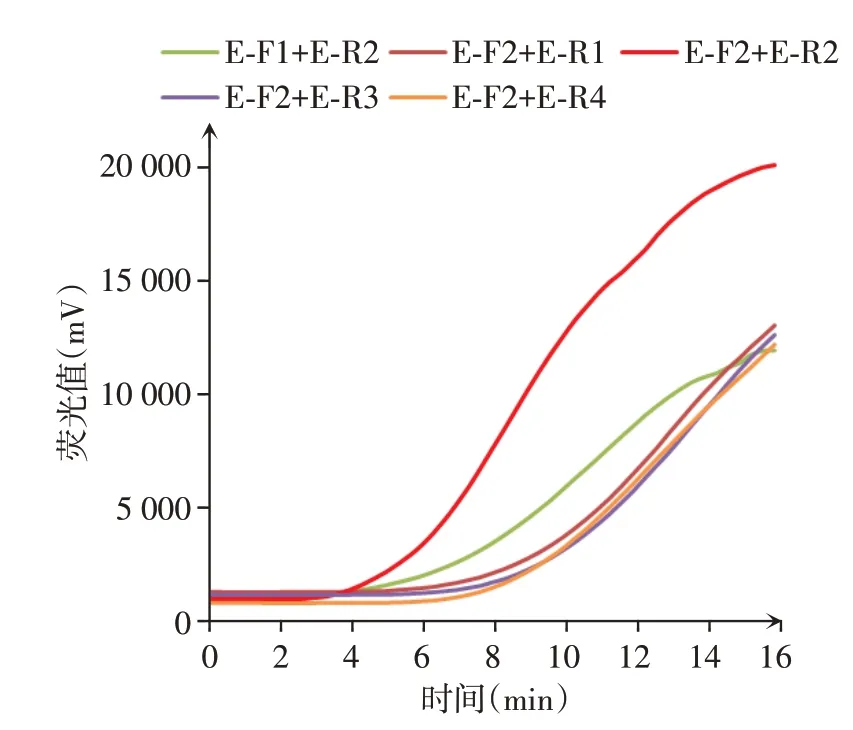
图1 EHEC O157:H7引物筛选Figure 1 Primer screening for EHEC O157:H7
2.1.2 引物和探针浓度的优化
根据2.1.1实验得出的最佳引物组合,以浓度为1×106拷贝数/μL质粒为模板,ddH2O为阴性对照,将浓度为10 μmol/L的E⁃F2、E⁃R2引物设置5个梯度加样量进行RAA荧光检测(图2A),引物体积为1.5 μL时扩增曲线效果最佳。同样,探针体积为1.0 μL时,扩增效果最佳(图2B)。

图2 引物和探针的浓度优化Figure 2 Concentration optimization of primers and probes
2.2 RAA⁃LFD法的建立
利用荧光法筛选好的引物和探针更改荧光标记的位置,设计出RAA⁃LFD法的引物和探针(表2)。

表2 EHEC O157:H7 RAA⁃LFD法检测引物和探针核酸序列Table 2 Sequences of primers and probe for RAA⁃LFD assay for EHEC O157:H7
2.3 灵敏性实验
RAA 荧光法灵敏性实验结果(图3A)显示,16 min左右1×104~1×109拷贝数的样本均有扩增曲线出现,1×100~1×103拷贝数样本和阴性对照无扩增曲线,由此得出最低检出限为1×104拷贝数。RAA⁃LFD法的灵敏性检测结果(图3B)显示,16 min左右1×104~1×109拷贝数出现红色检测线,1×100~1×103拷贝数及阴性对照仅出现蓝色质控线,RAA⁃LFD法最低检出限为1×104拷贝数。说明EHEC O157:H7 RAA荧光法及RAA⁃LFD法均具有较好的灵敏性。

图3 EHEC O157:H7灵敏性试验Figure 3 Sensitivity test of EHEC O157:H7
2.4 特异性试验
RAA荧光法检测结果(图4A)显示,只有EHEC O157:H7 出现光滑的扩增曲线,为阳性扩增,其他样本如金黄色葡萄球菌、沙门氏杆菌、弯曲菌、耶尔森菌、志贺杆菌及阴性对照均没有扩增,均为阴性。RAA⁃LFD法显示(图4B),只有EHEC O157:H7出现红色检测线,为阳性,其他样本及阴性对照仅出现蓝色质控线,均为阴性结果。表明本研究建立的RAA 荧光法和RAA⁃LFD 法特异性较高,不会发生交叉反应。

图4 EHEC O157:H7特异性试验Figure 4 Specific test of EHEC O157:H7
3 讨论
本研究结合RAA 技术建立EHEC O157:H7 的两种快速检测方法,操作简便,无须特殊学习和培训,与普通聚合酶链式反应(polymerase chain reac⁃tion,PCR)、荧光定量PCR 技术相比,无需高温条件及昂贵的仪器,与其他检测技术如环介导等温扩增反应(loop⁃mediated isothermal amplification,LAMP)等相比,可以大大缩短反应时间[17-21],只需在恒温39 ℃条件下16 min 即可完成检测。可适用于现场快速检测,尤其在海关、机场及基层偏远地区,具有较好的发展前景。
根据已有的研究,比较了本方法与其他检测方法的灵敏性和特异性,与普通PCR方法相比,本研究采用的RAA 荧光法及RAA⁃LFD 法灵敏性均较高[22],但与LAMP 法相比,灵敏性较低[23],原因可能是LAMP法较多的引物对组成可以提高检测方法的灵敏性。特异性方面,几种检测方法均有较好的特异性。RAA 荧光法及RAA⁃LFD 法在灵敏性方面介于普通PCR方法与LAMP法,但检测时间更短,所需条件更简便。
本研究同时也具有一定局限性,首先,针对RAA⁃LFD 法,由于需要打开试验管进行操作,具有污染的可能性,目前研究人员在超净台完成试剂配制,在独立房间进行实验,并在实验完成后用核酸清除剂处理,最大限度减少核酸污染情况。本研究所采用的RAA⁃LFD 方法灵敏度没有达到其他研究所报道的1×102~1×103拷贝数[19],原因可能是引物及反应体系的优化仍有待进一步研究。其次,由于条件所限,本研究没有使用临床样本进行实验,而是使用人工合成的质粒作为样本进行验证,后期将收集临床样本,完善该方面研究,使用临床样本进行灵敏性和特异性的验证和改善。
