热加工方式对牛乳过敏原αs1-酪蛋白二级结构和抗原性的影响
2022-09-08魏家祺周胜云丛艳君闫文杰
魏家祺,周胜云,丛艳君,*,闫文杰
(1.北京工商大学食品与健康学院,北京市食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2.北京联合大学生物化学工程学院,北京 100023)
据统计,全世界每天消耗的牛乳总量约为810 亿t[1]。鲜牛乳通常经过多种加工方式形成产品,以确保人类食用安全,热加工是常用的处理方式之一[2],目前,乳品工业中常用的液态乳热加工方法主要有:预热杀菌法、巴氏杀菌法、超高温灭菌法和保持杀菌法,加热温度和加热时间是决定乳品品质的关键因素。
牛乳中含量最高的蛋白质是酪蛋白,其由4 种组分构成,αs1-酪蛋白是含量最高的组分,也是主要过敏原[3]。研究表明,酪蛋白对热处理非常稳定,加热使其致敏性仅部分降低或没有变化[4]。Bloom等[5]发现,酪蛋白在95 ℃温度下加热60 min后,基本上不会影响其免疫反应性。Morisawa等[6]研究表明,经过热处理的α-酪蛋白不会影响嗜碱性粒细胞释放的组胺量。但是有研究[7]表明,加热到65~70 ℃时,α-酪蛋白的致敏性降低,而β-酪蛋白的致敏性显著增加,从而得出结论,不同加热条件下,过敏原蛋白质表现出不同的敏感性。
本研究通过8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针光谱、圆二色谱、间接竞争酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、免疫印迹实验方法探究不同加热条件下αs1-酪蛋白构象与抗原性的关系,揭示热加工方式调控αs1-酪蛋白抗原性的机理。
1 材料与方法
1.1 材料与试剂
鲜牛乳 三元食品公司。
低分子质量标准蛋白 天根生化科技(北京)有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠免疫球蛋白G 北京友谊中联公司;抗血清(多克隆抗体) 实验室自制;Tris(优级纯)、甘氨酸(优级纯)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS,优级纯)、考马斯亮蓝(分析纯)、甲醇(分析纯)、醋酸(优级纯)、吐温-20(优级纯)、乙醇(分析纯) 国药集团化学试剂有限公司;αs1-酪蛋白(纯度70%)、丙烯酰胺(优级纯)、甲叉双丙烯酰胺(优级纯)、过硫酸铵(优级纯)、四甲基乙二胺(优级纯)、α-巯基乙醇(优级纯)、甘油(优级纯)、牛血清白蛋白V bovine serum albumin V,BSA,生物级)、四甲基联苯胺(tetramethylbenzidine,TMB,优级纯)、二甲基亚砜(优级纯)、氨基黑(优级纯)、4-氯-1-萘酚(优级纯) 美国Sigma公司;浓盐酸(分析纯) 北京化学试剂公司;磷酸氢二钠、磷酸二氢钠、过氧化氢、碳酸氢钠(均为分析纯) 西陇化工股份有限公司。
1.2 仪器与设备
KHB ST-360酶标仪 上海科华实验系统有限公司;SHZ-C水浴恒温振荡器 上海龙跃仪器设备有限公司;BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;SH-2磁力搅拌器 北京东方开物科学器材有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;DYY-7C电泳仪 北京市六一仪器厂;CR22G离心机 日本Hitachi公司;F-7000圆二色谱仪 日本日立公司;RF5301荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 牛乳酪蛋白制备
鲜牛乳通过3 层消毒纱布过滤,除去杂质,然后用高速冷冻离心机(8 000 r/min、4 ℃、10 min)脱脂,得到脱脂乳。脱脂乳于40 ℃水浴锅内保温,5 mol/L HCl调节pH值至4.6,沉淀30 min后用高速冷冻离心机离心分离(8 000 r/min、4℃、15 min),收集沉淀,得到酪蛋白[8-9]。
将分离的酪蛋白和αs1-酪蛋白标准品分别溶于50 mmol/mL、pH 7.4磷酸盐缓冲液中,配制成0.1 mg/mL的溶液,于70、80、90、100 ℃分别加热10、20、30、40、50、60 min,于-20 ℃冰浴冷却。
1.3.2 圆二色谱分析加热αs1-酪蛋白二级结构变化
使用圆二色谱仪在远紫外区(190~260 nm),于室温25 ℃条件下测定0.1 mg/mL热处理的αs1-酪蛋白标准溶液,测定6 次取平均值。图谱经过仪器本底消除和溶液空白差减,利用杨氏算法得出αs1-酪蛋白中α-螺旋、β-折叠、β-转角和无规卷曲含量。
1.3.3 ANS荧光探针分析加热αs1-酪蛋白的疏水性变化
不同热处理的0.1 mg/mLαs1-酪蛋白标准溶液3 mL,加入15 μL ANS溶液作为荧光探针并于室温放置1 h。样品用荧光分光光度计扫描,扫描条件为激发波长390 nm,扫描波长400~650 nm,狭缝宽度5 nm,扫描速率100 nm/min,以特征荧光强度表示疏水性。
1.3.4αs1-酪蛋白多克隆抗体制备
用αs1-酪蛋白免疫C3H/He小鼠制备αs1-酪蛋白多克隆抗体。参考Peng Juan[10]、Yeung[11]等的方法,取6 只体质量为20~25 g的C3H/He小鼠,将0.2 mL 0.5 mg/mL的αs1-酪蛋白与等体积弗氏完全佐剂充分混合并乳化后,在小鼠背部皮下分6 点免疫;第22天,取0.1 mL 0.5 mg/mL的αs1-酪蛋白和等体积弗氏不完全佐剂乳化至混合物在水中不扩散,小鼠腹腔免疫;第36天,取0.1 mL 0.5 mg/mL的αs1-酪蛋白溶液小鼠腹腔免疫;第50天,取0.2 mL 0.5 mg/mL的αs1-酪蛋白溶液小鼠腹腔免疫;第60天,取6 只小鼠全血,离心制备血清备用。1 只未免疫的小鼠血清为阴性血清,作为对照。
1.3.5 间接竞争ELISA方法的建立和牛乳中αs1-酪蛋白残留量的测定
在优化酶标二抗稀释倍数、抗原稀释倍数、抗血清稀释倍数、包被抗原和抗血清反应温度和时间、底物最佳反应条件基础上,按照间接竞争ELISA程序,竞争抗原质量浓度0~1 400 ng/mL范围内建立间接竞争ELISA抑制曲线,并用此方法测定牛乳中αs1-酪蛋白的残留量。
间接竞争ELISA的具体步骤:以αs1-酪蛋白作为包被抗原,用0.05 mol/L、pH 9.6的碳酸盐缓冲液将αs1-酪蛋白稀释至5 μg/mL后,以100 μL/孔加入酶标板中,于4 ℃冰箱中过夜。αs1-酪蛋白抗原与一抗初级反应:在反应管中加入1∶1的αs1-酪蛋白抗原或待测样品(鲜牛乳)和1∶4 000稀释后的鼠多抗,不加αs1-酪蛋白抗原或样品的反应管作为无竞争反应体系,4 ℃冰箱中反应12 h。之后倾去酶标板孔内的液体,用200 μL/孔PBST洗板3 次,每次5 min,甩干。加入添加1 g/100 mL BSA的PBST封闭液进行封闭,每孔100 μL,37 ℃放置1 h,200 μL/孔PBST洗板3 次,每次5 min,甩干。将αs1-酪蛋白抗原与一抗混合物以100 μL/孔的量加入酶标板内,于37 ℃温育2 h。用PBST洗板4 次,200 μL/孔,每次5 min,甩干。用含1 g/100 mL BSA的PBST将HRP-羊抗鼠IgG稀释5 000 倍,以100 μL/孔加入孔内,37 ℃反应1 h。用200 μL/孔的PBST洗板3 次,200 μL/孔的双蒸水洗板2 次,每次5 min,甩干。加入新鲜配制的TMB应用液,100 μL/孔,常温暗处反应25 min,显示蓝色。每孔加入50 μL 2 mol/L硫酸终止反应,颜色由蓝变黄,用酶标仪测定波长450 nm处的光密度(OD450nm)[12-15]。

式中:B为梯度稀释αs1-酪蛋白作为竞争抗原测定的OD450nm;B0为无竞争体系的OD450nm;B1为未免疫小鼠血清作为一抗测定的OD450nm。
1.3.6αs1-酪蛋白SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
以分离的酪蛋白为研究对象。分离胶12.5%、浓缩胶4.5%、胶联度3.6%,进行垂直电泳,单板恒流10 mA。具体实验步骤为:αs1-酪蛋白抗原或样品溶液与电泳样品稀释液以体积比3∶1比例混合,于沸水浴处理5 min后上样,上样量10 μL。电泳结束后的分离胶用考马斯亮蓝R-250染色15 min,显现蛋白条带,以低分子质量标准蛋白做标准,用凝胶成像系统分析其分子质量。
1.3.7αs1-酪蛋白免疫印迹鉴定
将分离的酪蛋白首先进行SDS-PAGE,然后将胶上的蛋白转印到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,将膜用加样梳、铅笔作标记,将PVDF膜剪裁,与SDS-PAGE凝胶中分离胶大小一样,再将PVDF膜、滤纸和海绵一同浸泡于电极缓冲液(含20%甲醇的Tris-甘氨酸缓冲溶液)中30~60 min。将电泳完毕的SDS-PAGE分离胶取下,放入电转缓冲液中平衡20~30 min,在干净、平整的实验台上按以下顺序从正极到负极铺于凝胶夹上:凝胶夹板→海绵→3 层滤纸→PVDF膜→凝胶→3 层滤纸→海绵→凝胶夹板(此过程中应避免气泡产生,用光滑的玻璃棒从一侧向另一侧慢慢滚动,赶出气泡),夹紧“凝胶三明治”插入转移电泳槽,灌满缓冲液。将PVDF膜端靠近正极,凝胶面靠近负极,打开电源,定流192 mA,电转移4.0 h。转印后的PVDF膜一式2 份,1 份用氨基黑10B溶液染色5 min,脱色5 min,观察转印效果及蛋白质位置,另1 份用于免疫印迹。
将转印后的PVDF膜于大小合适的平皿中用dH2O洗涤5 min,用TBST溶液(添加体积分数0.05%吐温-20的pH 7.4 Tris缓冲溶液)于37 ℃漂洗4 次,每次15 min。再加入装有封闭液(10~20 mL)的平皿中,于37 ℃孵育1 h,封闭PVDF膜,然后用dH2O洗涤5 min。将PVDF膜与1∶4 000 倍稀释的多抗于37 ℃孵育2 h,再用dH2O洗涤5 min,用TBST洗涤3 次,每次10 min。将PVDF膜与合适浓度的HRP标记羊抗鼠二抗(1∶5 000稀释)于37 ℃孵育1 h,再用dH2O洗涤5 min,TBST溶液洗涤3 次,每次10 min。将漂洗后的PVDF膜浸没在新鲜配制的0.05 mol/L 4-氯-1-萘酚底物溶液中,显色(37 ℃,35~40 min),待蛋白条带显色清晰,即可用高纯水漂洗,终止反应。用dH2O冲净PVDF膜,置于双层滤纸中风干保存[7,16]。
1.4 数据处理
所有实验均做3 个平行,3 次重复。用Origin 8软件绘制图表,SPSS 17.0软件进行数据分析,采用Duncan’s multiple range test方法进行显著性分析。
2 结果与分析
2.1 圆二色谱分析αs1-酪蛋白的二级结构变化
采用圆二色谱分析蛋白质时,192 nm波长附近α-螺旋结构有1 个正谱带,波长208、222 nm附近有2 个负谱带,波长185~200 nm附近β-折叠有1 个正谱带,波长216 nm附近有1 个负谱带,波长206 nm附近β-转角有1 个正谱带[17-18]。
由图1可知:圆二色谱显示,在208~212 nm和218~222 nm附近有峰存在,这是α-螺旋结构的典型特征,说明有α-螺旋存在;波长224~230 nm附近有微弱且较宽的谱带,说明有β-折叠或者富含L-脯氨酸序列的区域[19]。

图1 加热处理的αs1-酪蛋白圆二色谱图Fig. 1 CD spectra of heated αs1-casein
由表1可知,αs1-酪蛋白经热处理后其二级结构构象发生变化,α-螺旋、β-折叠含量降低,在80 ℃、60 min,90 ℃、10 min,90 ℃、60 min条件下,α-螺旋含量显著低于未加热αs1-酪蛋白。70 ℃、20 min,80 ℃、20 min,90 ℃、20 min时无规卷曲含量显著增加。而韩波[20]通过圆二色谱分析技术研究牛乳酪蛋白分别于63 ℃、30 min,75℃、20 s,100 ℃、5 min,134 ℃、4 min加热条件下二级结构构象的变化情况,发现不同的加热条件并没有使牛乳酪蛋白的二级结构构象发生显著变化。故加热对αs1-酪蛋白构象的影响有待深入研究。
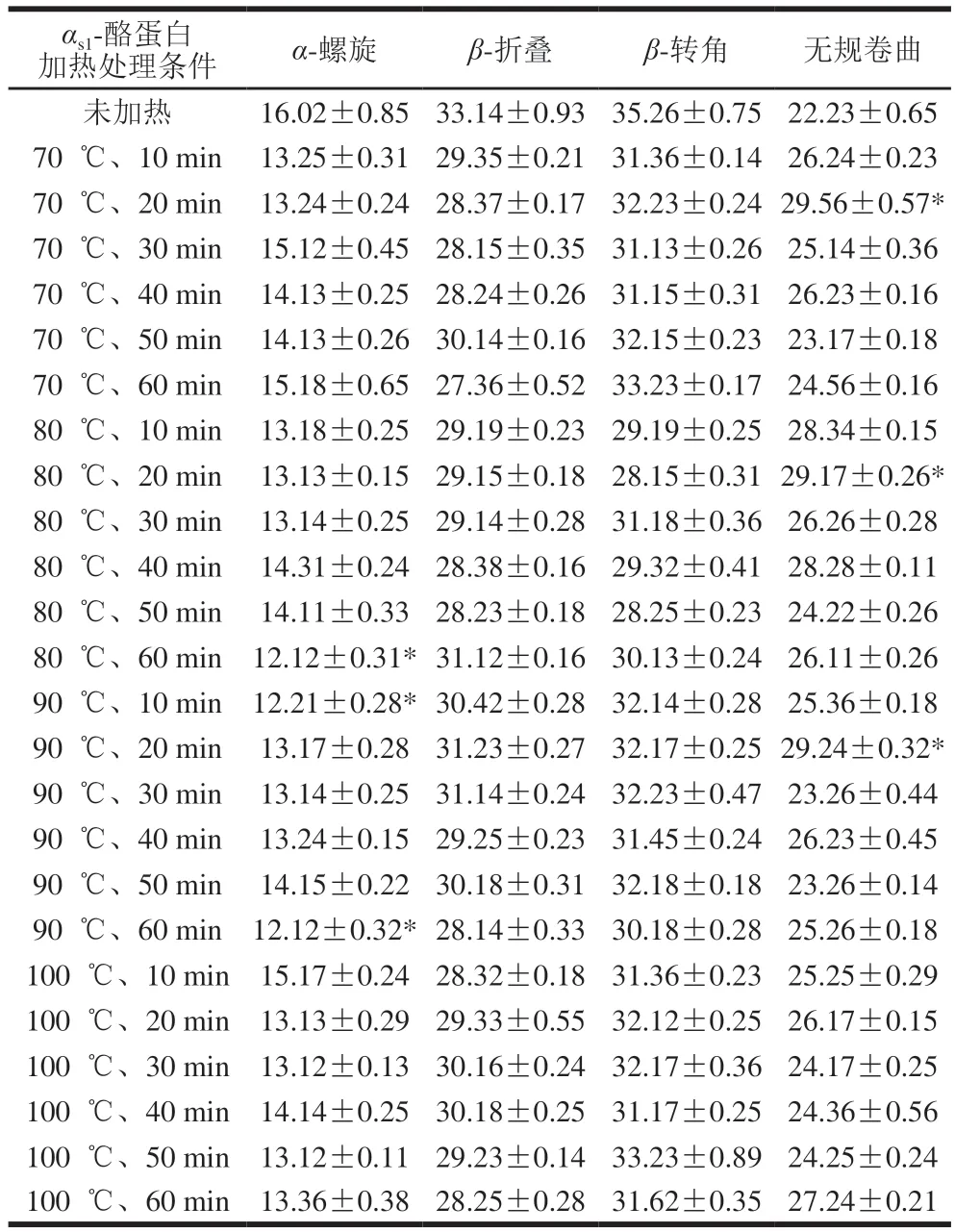
表1 αs1-酪蛋白的二级结构含量Table 1 Secondary structure composition of unheated and heated αs1-casein %
2.2 ANS荧光探针光谱分析αs1-酪蛋白表面疏水性的变化
蛋白质分子之间的疏水作用是维持其构象的主要作用力,同时对蛋白质的功能性质也存在一定的影响[21],本研究采用ANS荧光探针法研究经不同热处理的αs1-酪蛋白表面疏水性的变化情况[22]。由图1可知:αs1-酪蛋白的疏水性结构随着不同的处理时间和温度发生变化。在70~100 ℃加热处理下,αs1-酪蛋白表面疏水性均随时间的延长呈无规则变化趋势,70~80 ℃时,加热20 min时相对最强,50 min时相对最低,60 min又趋于增强;90 ℃时,加热20 min时相对最强,加热60 min相对最低,100 ℃时,加热20 min相对最强,加热10 min相对最低,加热40、50、60 min又趋于增强。另外αs1-酪蛋白的浓度也会影响其展开和聚合程度。随着加热温度的升高,体系中αs1-酪蛋白重新组成聚合体,也会导致其疏水性下降[23]。
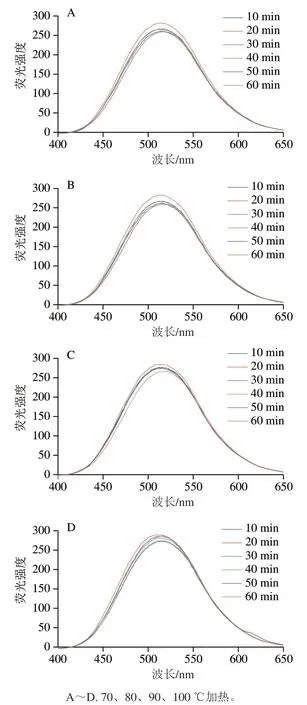
图2 加热处理的αs1-酪蛋白的表面荧光强度Fig. 2 Surface fluorescence intensity of heated αs1-casein
2.3 间接竞争ELISA测定牛乳中αs1-酪蛋白残留量结果
由图3可知,牛乳中αs1-酪蛋白的残留量在加热温度为70 ℃和90 ℃时,随时间的延长变化趋势相近,具体为0~20 min随时间的延长上升,20~30 min趋于下降,30~40 min趋于上升,之后趋于下降。于80 ℃和100 ℃加热,随时间的延长变化趋势相近,具体为0~20 min随时间的延长上升,20~30 min趋于下降,30~40 min又趋于上升,40~50 min趋于下降,60 min以后又处于上升阶段。

图3 热处理牛乳中αs1-酪蛋白残留量Fig. 3 Residual amount of αs1-casein in heated milk
采用Duncan’s multiple range test方法分析,鲜牛乳在70 ℃分别处理0、10、20、30、40、50、60 min,αs1-酪蛋白残留量差异极显著(P<0.01),αs1-酪蛋白残留量最高的是20 min处理组,为(4 551.26±0.26) ng/mL,最低的是60 min处理组,为(4 497.02±1.16) ng/mL;鲜牛乳在80 ℃分别处理0、10、20、30、40、50、60 min,αs1-酪蛋白残留量差异极显著(P<0.01),最高的是20 min处理组,为(4 593.99±0.64) ng/mL,最低的是0 min组(对照组),为(4 513.46±1.16) ng/mL;鲜牛乳在90 ℃分别处理0、10、20、30、40、50、60 min,αs1-酪蛋白残留量差异极显著(P<0.01),最高的是20 min处理组,为(4 615.36±1.04) ng/mL,最低的是对照组,为(4 513.46±1.16) ng/mL;鲜牛乳在100 ℃分别处理0、10、20、30、40、50、60 min,αs1-酪蛋白残留量差异极显著(P<0.01),最高的是20 min处理组,为(4 575.92±1.39) ng/mL,最低的是对照组,为(4 513.46±1.16) ng/mL。综上分析,70、80、90、100 ℃加热处理牛乳时均为在20 min时表现出较强的抗原性,分析其原因可能是加热使牛乳中αs1-酪蛋白构象发生变化,更多的作用表位暴露出来,从而导致致敏性增强。70 ℃加热处理60 min时αs1-酪蛋白残留量为4 497.02 ng/mL,较对照组的过敏原残留量低,表现出较低抗原性。
2.4 αs1-酪蛋白SDS-PAGE分析结果
由图4可知,不同加热处理对αs1-酪蛋白的分子质量没有影响,通过凝胶成像技术测得αs1-酪蛋白分子质量约为32 kDa。


图4 不同加热处理αs1-酪蛋白SDS-PAGE分析图Fig. 4 SDS-PAGE patterns of heated αs1-casein
2.5 αs1-酪蛋白免疫印迹鉴定结果
SDS-PAGE之后将不同热处理的酪蛋白转印到PVDF膜上,通过免疫印迹实验进行鉴定。由图5可知,未免疫小鼠血清作为阴性对照与酪蛋白没有产生反应条带,说明小鼠多克隆抗体与经不同热处理的αs1-酪蛋白发生了特异性免疫反应。这个结果既验证了多克隆抗体的特异性,又说明热处理后αs1-酪蛋白的致敏性依然存在。

图5 αs1-酪蛋白免疫印迹鉴定图Fig. 5 Western blotting of αs1-casein
食品热加工可以诱导过敏原蛋白质结构发生不同改变,如聚集、去折叠等,这些改变都可能影响IgE结合能力,从而增加或降低过敏原的致敏性[24]。通常归因于食物基质中过敏原蛋白质构象表位的破坏或其与脂肪或糖发生的化学反应限制了过敏原对免疫系统的可用性;另一方面,食物基质的作用使过敏原蛋白质新表位形成及消化率降低可能会增加其致敏性[25]。研究牛乳热加工技术对于过敏原致敏性的影响,对于优化乳品热加工工艺、开发低致敏乳制品均具有重要意义。
3 结 论
本研究表明:在80 ℃、60 min,90 ℃、10 min,90 ℃、60 min条件下热处理后,αs1-酪蛋白中α-螺旋结构含量显著低于未加热αs1-酪蛋白,在70 ℃、20 min,80 ℃、20 min,90 ℃、20 min条件下热处理后,αs1-酪蛋白中无规卷曲含量显著增加,70~100 ℃加热20 min条件下表面荧光强度最强,间接竞争ELISA显示,在70~100 ℃、20 min条件下,αs1-酪蛋白的抗原残留量均较高,而免疫印迹方法显示,不同温度-时间加热条件下αs1-酪蛋白仍具有免疫反应特性,建议进一步通过动物实验揭示热处理调控αs1-酪蛋白抗原性的机制。
