双酶水解对脱脂牛乳致敏性的影响
2022-09-08钱冠林岳喜庆
钱冠林,孙 敬,刘 微,程 娇,岳喜庆,郑 艳
(沈阳农业大学食品学院,辽宁 沈阳 110866)
牛乳是八大过敏原之一,世界范围内牛乳过敏的患者占食物过敏患者的2.0%~7.5%[1],其中婴幼儿占过敏总人数的2.69%[2]。牛乳过敏主要由酪蛋白(casein,CN)、α-乳白蛋白(α-lactalbumin,α-La)和β-乳球蛋白(β-lactoglobulin,β-Lg)引起[3],研究表明牛乳过敏人群有65%对CN过敏[4],82%对β-Lg过敏[5],超过50%的患者对α-La过敏。另有30%~35%的牛乳过敏患者对含量较低的牛血清白蛋白、乳铁蛋白和免疫球蛋白(immunoglobulin,Ig)过敏[6-7]。牛乳蛋白过敏导致哮喘、湿疹以及消化系统和呼吸系统等过敏症状[8]。
近年来,降低牛乳致敏性的方法主要有物理法、化学法及生物法[9],但这些方法存在破坏牛乳营养成分、成本过高、条件难以控制或者引起蛋白质结构改变等缺陷,对牛乳的色泽与风味产生影响[10]。酶法具有作用条件温和、高效、来源广泛等特点[11]。蛋白酶可以切断致敏蛋白肽键成为小分子肽段,破坏致敏蛋白的线性结构,或改变蛋白质的空间结构,破坏构象型表位,从而达到降低牛乳致敏性的目的。目前对酶法降低单一牛乳蛋白致敏性研究较多,对天然脱脂牛乳作为完整体系的脱敏研究较少;相比于单一酶解,双酶法将从更多酶切位点裂解致敏乳蛋白,从而达到更好的脱敏效果,且对相关产品生产具有现实意义[12]。
本研究以脱脂牛乳为研究对象,考察双酶水解方式对其致敏性及品质的影响,以期为低致敏乳制品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜脱脂牛乳 辽宁越秀辉山乳业集团有限公司;兔乳蛋白过敏血清由课题组自制;牛乳过敏患者血清池由中国医科大学提供的8 例IgE水平较高患者血清等量混合后建立。
食品级碱性蛋白酶(酶活力105 466 U/g)、食品级风味蛋白酶(酶活力20 786 U/g) 丹麦Novozyme公司;羊抗兔IgG、邻苯二胺(o-phenylenediamine,OPD)、邻苯二甲醛(o-phthalaldehyde,OPA)、8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid hydrate ammonium salt,ANS)、二硫苏糖醇(dithiothreitol,DTT) 美国Sigma公司;乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA)、2-硝基苯甲酸 美国Genview公司;福林酚、甘氨酸 北京索莱宝科技有限公司;三羟甲基氨基甲烷(Tris)、三(羟甲基)甲基甘氨酸(Tricine)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵、四甲基乙二胺 上海麦克林生化科技有限公司;低分子质量蛋白Marker 生工生物工程(上海)股份有限公司;生物素标记的羊抗人IgE抗体 美国KPL公司;溴化钾(光谱级)、无水碳酸钠、冰乙酸等常规试剂(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SQP万分之一天平 北京赛多利斯公司;ICC basic IB R RO 15 ec恒温水浴磁力搅拌器 德国IKA公司;Centrifuge 54308离心机 德国Eppendorf公司;UV2700紫外-可见分光光度计 日本岛津公司;STARTER2100 pH计 美国Ohaus公司;1645050蛋白电泳仪 美国Bio-Rad公司;Amersham Imager 600凝胶成像仪 美国GE公司;S11P-250恒温培养箱 上海精宏实验设备有限公司;Eon酶标仪 美国BioTek公司;Nicolet 5DXC红外光谱仪 美国Nicolet公司;F-4600荧光分光光度计日本日立公司;Zatasizer Nano Series纳米粒度及Zeta电位分析仪 英国马尔文公司。
1.3 方法
1.3.1 酶解工艺
根据课题组前期研究方法[13]:取脱脂牛乳150 mL(蛋白质含量3.48 g/100 g)及碱性蛋白酶、风味蛋白酶溶液(均为100 mg/mL),预热20 min(碱性蛋白酶(55±5) ℃,风味蛋白酶(50±5) ℃),在脱脂牛乳自然pH 6.65的条件下将蛋白酶溶液与脱脂牛乳按需混合,水浴90 ℃灭活10 min,冷却至室温,4 ℃、4 000 r/min离心5 min,取上清液4 ℃冷藏备用。
1.3.2 双酶复合一步酶解条件的确定
1.3.2.1 双酶添加量及配比的确定
固定酶解时间1 h,设置蛋白酶添加量分别为2 000、3 000、4 000、5 000、6 000 U/g,在碱性蛋白酶与风味蛋白酶配比(质量比)为3∶1、2∶1、1∶1、1∶2、1∶3的条件下考察其对脱脂牛乳水解度及分子质量分布的影响,确定最适添加量和配比。
1.3.2.2 双酶复合酶解时间的确定
在确定双酶配比及添加量的基础上,将酶解时间分别设定为20、40、60、80、100、120 min,考察酶解时间对脱脂牛乳水解度及酶解产物分子质量分布的影响。
1.3.3 双酶分步法酶解脱脂牛乳
确定双酶复合添加量、配比和酶解时间后,考察双酶分步处理对其水解度及分子质量分布的影响,实验条件设定见表1。

表1 双酶分步法酶解脱脂牛乳方案Table 1 Schemes of one- and two-step hydrolysis of skimmed milk with Alcalase and Flavorzyme
1.3.4 水解度测定
使用OPA法测定酶解产物水解度[14]。取400 μL适当稀释后的样品置于离心管中,加入3.00 mL 0.8 mg/mL OPA溶液,振荡混匀,精准反应2 min后测定其OD340nm。使用精氨酸标准溶液绘制标准曲线。水解度按式(1)计算。
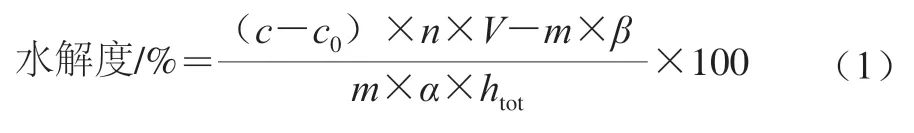
式中:c为由标准曲线得出的水解液中精氨酸浓度/(mmol/L);c0为由标准曲线得出的未水解样品中精氨酸浓度/(mmol/L);n为样品稀释倍数;V为样品总体积/L;m为样品中蛋白质的质量/g;乳清蛋白中修正因子α、β分别为1.00、0.40;htot为总肽键数(8.8 mmol/g)。
1.3.5 分子质量分布测定
根据Laemmli[15]的方法略作修改。采用Tricine-SDS-聚丙烯酰胺凝胶电泳(Tricine-SDS-polyacrylamide gel electrophoresis,Tricine-SDS-PAGE)测定酶解产物的分子质量分布,使用16%分离胶、10%夹层胶及4%浓缩胶,将未处理样品与水解产物分别与等体积含DTT的4×Loading buffer混合,沸水中孵育10 min,2 000 r/min离心5 min,30 V条件下电泳1 h后转为100 V继续电泳2 h。电泳后的凝胶固定20 min,染色40 min,过夜脱色。
1.3.6 酶解产物IgG结合能力测定
体外竞争抑制酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法可以对酶解产物与特异性抗体IgG结合能力进行灵敏测定,根据孟轩夷[16]的方法,略作修改:1)抗原包被:取酶标板A,每孔加入100 μL碳酸盐缓冲液(0.05 mol/L,pH 9.6)稀释后的牛乳蛋白(脱脂牛乳10 μg/mL、CN 30 μg/mL、α-La 5 μg/mL、β-Lg 0.5 μg/mL),4 ℃孵育过夜;2)封阻:次日取出酶标板A,倾去包被液,使用300 μL PBST(含体积分数0.05%吐温-20的PBS)对样品孔洗涤5 min,共3 次,每个操作步骤后洗涤程序同此方法;使用250 μL 1 g/100 mL明胶溶液填充未饱和的酶标板A样品孔,随后在37 ℃条件下孵育1 h,另取酶标板B以相同方式封阻;3)样品与抗体反应:对酶标板B进行洗涤,每孔加入60 μL样品,空白孔加入相同体积的PBS作为无竞争对照;在每个孔内加入60 μL稀释后的兔血清(样品中加入血清稀释倍数:脱脂牛乳、CN 1∶500,α-La 1∶7 000,β-Lg 1∶20 000),37 ℃孵育1 h;4)竞争反应:对酶标板A的样品孔进行洗涤,将酶标板B样品孔内的混合反应物转移100 μL至酶标板A,37 ℃孵育1 h;5)二抗反应:对酶标板A样品孔进行洗涤,每孔加入100 μL稀释后的辣根过氧化物酶(horse radish peroxidase,HRP)标记的羊抗兔IgG(样品中加入IgG稀释倍数:CN 1∶10 000;α-La、β-Lg 1∶5 000),37 ℃孵育1 h;6)显色:洗涤酶标板A样品孔,加入100 μL OPD底物缓冲液,于37 ℃避光孵育15 min;7)终止:每孔加入50 μL 2 mol/L H2SO4终止反应;8)比色:测定490 nm波长处的吸光度。IgG抑制率按式(2)计算。
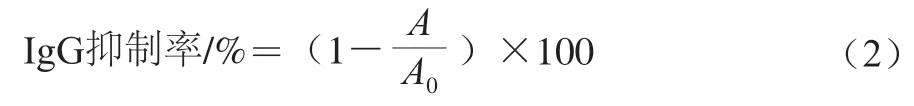
式中:A为待测样品孔的吸光度;A0为无竞争组的吸光度。
1.3.7 酶解产物的IgE结合能力测定
酶解产物与牛乳过敏患者血清中IgE结合能力是表征体内过敏反应强弱的有效指标,根据Huang Lu等[17]的方法,略作修改:1)抗原包被:使用质量浓度为20 μg/mL的样品包被;2)封阻:操作同1.3.6节(2);3)一抗反应:洗涤样品孔,每孔加入1∶22稀释的患者血清100 μL,37 ℃孵育1 h;4)二抗反应:洗涤样品孔,每孔加入100 μL生物素标记的1∶1 000稀释的羊抗人IgE,37 ℃孵育1 h;5)亲和素反应:洗涤样品孔,每孔加入100 μL 1∶20稀释的HRP标记链霉亲和素,37 ℃孵育1 h;6)显色:洗涤样品孔,每孔加入100 μL OPD底物缓冲液,于37 ℃孵育15 min;7)终止:每孔加入50 μL 2 mol/L H2SO4终止反应;8)比色:测定490 nm波长处的吸光度。酶解产物的IgE抑制率计算公式同1.3.6节。
1.3.8 酶解产物结构测定
1.3.8.1 酶解产物二级结构测定
取适量脱脂牛乳酶解产物冻干粉与干燥溴化钾以1∶150比例在玛瑙研钵中充分研磨并均匀混合,使用压片机压片,压力达到10 T后停止加压,取出压片,使用红外光谱仪在400~4 000 cm-1波数下扫描32 次。使用Omnic 8.0和Peakfit 4.0软件对采集的图谱进行处理。
1.3.8.2 酶解产物游离巯基含量测定
采用Ellman’s DNTB法[18]测定酶解产物游离巯基含量,使用1.0 mL PBS稀释酶解产物至1 mg/mL,与4.0 mL Tris-Gly缓冲液(含1.042 g Tris、0.676 g Gly、0.117 g EDTA,蒸馏水溶解后定容至100 mL)混合,避光后加入50 μL Ellman’s试剂,以PBS作为空白对照,25 ℃避光反应1 h,10 000 r/min离心15 min,测定412 nm波长处吸光度。游离巯基含量按式(3)计算。

式中:n为酶解产物稀释倍数;ρ为酶解产物蛋白质量浓度/(mg/mL)。
1.3.8.3 酶解产物表面疏水性测定
使用ANS荧光探针测定酶解前后产物表面疏水性变化[19]。将待测样品使用PBS梯度稀释至0.012 5、0.025 0、0.050 0、0.100 0 mg/mL,避光条件下取4.0 mL稀释后待测样品与20 μL ANS溶液(10 mL PBS溶解0.025 31 g ANS,避光保存)振荡混匀,静置3 min,测定其荧光强度。测定参数设置为:激发波长390 nm,发射波长470 nm,扫描发射波长400~600 nm,以酶解产物的蛋白质量浓度(mg/mL)为横坐标,荧光强度为纵坐标,进行线性回归分析,拟合曲线斜率即为表面疏水性(H0)。
1.3.8.4 酶解产物粒径及Zeta电位、脱脂牛乳体系稳定性测定
将待测酶解产物置于纳米粒度及Zeta电位分析仪中,25 ℃平衡3 min后测定酶解产物粒径及Zeta电位。使用聚合物分散性指数(polymer dispersity index,PDI)[20]表示脱脂牛乳体系稳定性变化。
1.4 数据处理
数据结果表示为平均值±标准差,实验重复3 次,小写字母不同表示具有显著差异性。采用GraphPad Prism 8软件绘图,使用SPSS 17.0软件进行统计分析。
2 结果与分析
2.1 双酶一步水解条件的优化
2.1.1 双酶复合添加量和配比对脱脂牛乳酶解效果的影响
由图1可知,随着E/S增加,脱脂牛乳的水解度显著上升(P<0.05)。5 种不同蛋白酶配比中,碱性蛋白酶与风味蛋白酶配比为1∶3时脱脂牛乳水解度随E/S增加提高最多,在E/S为6 000 U/g时达到33.89%,风味蛋白酶比例的提高是促使同E/S条件下水解度持续上升的原因,可能是风味蛋白酶兼具内切酶与外切酶的性质[21],可以在更多位点上酶切蛋白质,使水解度提高。

图1 碱性蛋白酶与风味蛋白酶添加量与配比对脱脂牛乳水解度的影响Fig. 1 Effects of E/S ratio and Alcalase/Flavorzyme ratio on degree of hydrolysis of skimmed milk hydrolysates
由图2可知,在E/S为2 000 U/g时,碱性蛋白酶和风味蛋白酶对CN和α-La酶解效果优于β-Lg,随着E/S提高,β-Lg加快降解,直到E/S为4 000 U/g时,β-Lg条带完全消失。值得注意的是,在E/S为2 000 U/g条件下,随着风味蛋白酶的比例升高,β-Lg的降解率下降,此时水解度却呈现上升趋势,表明风味蛋白酶对β-Lg降解能力有限。

图2 碱性蛋白酶与风味蛋白酶添加量与配比对脱脂牛乳水解产物分子质量分布的影响Fig. 2 Effects of E/S and Alcalase/Flavorzyme ratio on the molecular mass distribution of skimmed milk hydrolysates
过度酶解会产生苦味氨基酸,影响产品的口感[22]。综合考虑,在保证酶解效果的前提下,确定E/S为3 000 U/g、碱性蛋白酶与风味蛋白酶配比为3∶1为双酶一步酶解的最适添加量和配比。
2.1.2 双酶一步酶解时间对脱脂牛乳酶解效果的影响
由图3可知,在水解60 min内,脱脂牛乳水解度呈现显著上升趋势(P<0.05),80 min时水解度超过15%,此时Tricine-SDS-PAGE条带显示3 种致敏乳蛋白条带基本消失,在反应后期,由于底物减少,水解度上升趋势减缓。

图3 碱性蛋白酶与风味蛋白酶酶解时间对脱脂牛乳水解度(A)及分子质量分布(B)的影响Fig. 3 Effects of alcalase and flavorzyme hydrolysis time on degree of hydrolysis (A) and molecular mass distribution (B) of skimmed milk hydrolysates
结合2.1.1节结果,双酶一步酶解脱脂牛乳的最适条件为E/S=3 000 U/g、碱性蛋白酶与风味蛋白酶配比3∶1、酶解时间80 min。
2.2 双酶分步酶解对脱脂牛乳酶解效果的影响
蛋白酶添加顺序及酶解方式对蛋白质水解度及肽类的产生有一定影响[23],因此确定双酶一步酶解最适的酶解条件后,从蛋白酶添加顺序及酶解时间对分步酶解脱脂牛乳效果进行对比研究。
由图4可知,组2与组4水解度显著高于组3及组5(P<0.05),且组2与组4之间酶解效果差异不显著。Tricine-SDS-PAGE条带显示,组2对β-Lg及α-La降解效果优于组4,可能是由于组2中碱性蛋白酶水解时间比组4长,且碱性蛋白酶对β-Lg酶解效果优于风味蛋白酶,因此电泳条带消失更明显,该结果与2.1.1节的结论互相印证。

图4 双酶分步酶解对脱脂牛乳水解度(A)及分子质量分布(B)的影响Fig. 4 Effects of two-stept hydrolysis on degree of hydrolysis (A) and molecular mass distribution (B) of skimmed milk hydrolysates
组2~5水解度均显著低于组1(P<0.05),电泳条带结果表明,双酶一步酶解对3 种致敏蛋白降解效果均优于双酶分步酶解,因此后续研究将围绕双酶一步酶解展开。
2.3 双酶一步酶解对脱脂牛乳致敏蛋白IgG结合能力的影响
2.3.1 酶解对CN与IgG结合能力的影响
竞争抑制率表示牛乳中残留的竞争抗原蛋白对兔血清中抗体与标准CN的结合抑制作用。半抑制质量浓度(IC50)表示达到一半抑制率时所需竞争抗原质量浓度,IC50与蛋白的抗体结合能力成反比,即所需竞争抗原质量浓度越大,该蛋白的抗体结合能力越弱,致敏性越低。
由图5可知,在80 min内,CN的IC50随酶解时间延长而提高,由19.63 µg/mL上升至78.29 µg/mL,CN与IgG结合能力下降74.93%(P<0.05),表明水解有效降低了CN的致敏性。

图5 双酶一步水解对CN结合IgG能力的影响Fig. 5 Effects of one-step hydrolysis on IgG binding capacity of casein
2.3.2 酶解对α-La与IgG结合能力的影响
由图6可知,碱性蛋白酶与风味蛋白酶复合处理有效降低了α-La的IgG结合能力,即降低了α-La的致敏性。但是IC50显示,水解初期,α-La的IgG结合能力快速下降,在20 min内α-La的IC50由3.77 µg/mL上升至220.89 µg/mL,IgG结合能力显著下降98.29%(P<0.05),随后又上升,在80 min时抑制率为97.24%,致敏性升高但变化不显著,可能是由于酶解导致蛋白质结构发生改变,构象型表位被破坏,随着酶解时间延长,更多的抗原表位暴露,暴露速率大于酶解破坏速率,因此导致IgG结合能力增加。

图6 双酶一步酶解对α-La结合IgG能力的影响Fig. 6 Effects of one-step hydrolysis on IgG binding capacity of α-La
2.3.3 酶解对β-Lg与IgG结合能力的影响
由图7可知,在IC50水平上,水解40 min内,β-Lg的IgG结合能力逐渐下降,在40~80 min时间段内,IgG结合能力呈先上升再下降的波动,可能是由于水解时抗原结合表位不断暴露所致,80 min时IgG结合能力最低,IC50从2.62 µg/mL上升到40.06 µg/mL,IgG结合能力显著降低93.46%(P<0.05),致敏性显著降低。
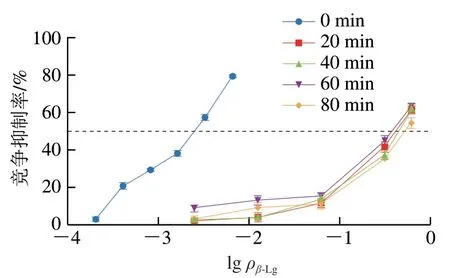
图7 双酶一步酶解对β-Lg结合IgG能力的影响Fig. 7 Effects of one-step hydrolysis on IgG binding capacity of β-Lg
2.3.4 双酶一步酶解对脱脂牛乳总蛋白结合IgG能力的影响
由图8可知,在酶解60 min内,脱脂牛乳总蛋白的IgG结合能力显著下降73.8%(P<0.05),酶解60~80 min,脱脂牛乳IgG结合能力有所上升但不显著(P<0.05),IgG抑制率为69.6%,表明双酶酶解显著降低了脱脂牛乳蛋白整体致敏性。酶解60~80 min,脱脂牛乳蛋白IgG结合能力与α-La的IgG结合能力变化趋势相似,可能是由于在此区间α-La与牛乳中其他成分形成的复合物被破坏,导致致敏性升高。脱脂牛乳作为完整体系成分较为复杂,含有更多种类致敏蛋白及致敏表位,因此IgG结合能力高于单一致敏蛋白,呈现出更高的致敏性。
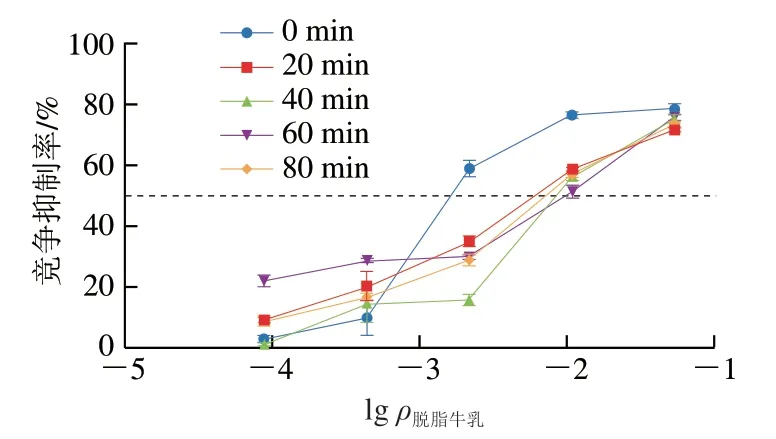
图8 双酶一步酶解对脱脂牛乳总蛋白IgG结合能力的影响Fig. 8 Effects of one-step hydrolysis on IgG binding capacity of skimmed milk proteins
2.4 双酶一步酶解对脱脂牛乳蛋白结构的影响
2.4.1 双酶一步酶解对脱脂牛乳蛋白二级结构的影响
傅里叶变换红外光谱可以对蛋白质结构中氨基基团、酰胺Ⅰ、Ⅱ、Ⅲ带及蛋白质环状结构化学键振动等波段信息进行检测[24]。酰胺Ⅰ带区域(1 600~1 700 cm-1)是C=O键振动主要区域,该区域谱峰与蛋白质二级结构存在对应关系[25]。由图9可知,脱脂牛乳蛋白二级结构主要以α-螺旋、β-折叠为主,其相对含量均为32%,并有少量β-转角及无规卷曲结构,相对含量分别为19%及17%。随着酶解时间的延长,脱脂牛乳蛋白中α-螺旋相对含量显著降低,可能是由于酶解使蛋白质螺旋结构展开或断裂,β-折叠结构的减少表明蛋白质弹性结构被破坏;β-转角相对含量呈现增加的趋势,可能在酶解过程中α-螺旋、β-折叠结构向β-转角结构发生转换,蛋白的抗原结合位点大多存在于β-转角结构[26],此过程也可能导致β-转角抗原结合位点暴露,使脱脂牛乳致敏性增加,与2.3.4节结果一致;无规则卷曲结构相对含量下降表明酶解使蛋白质构象发生改变。
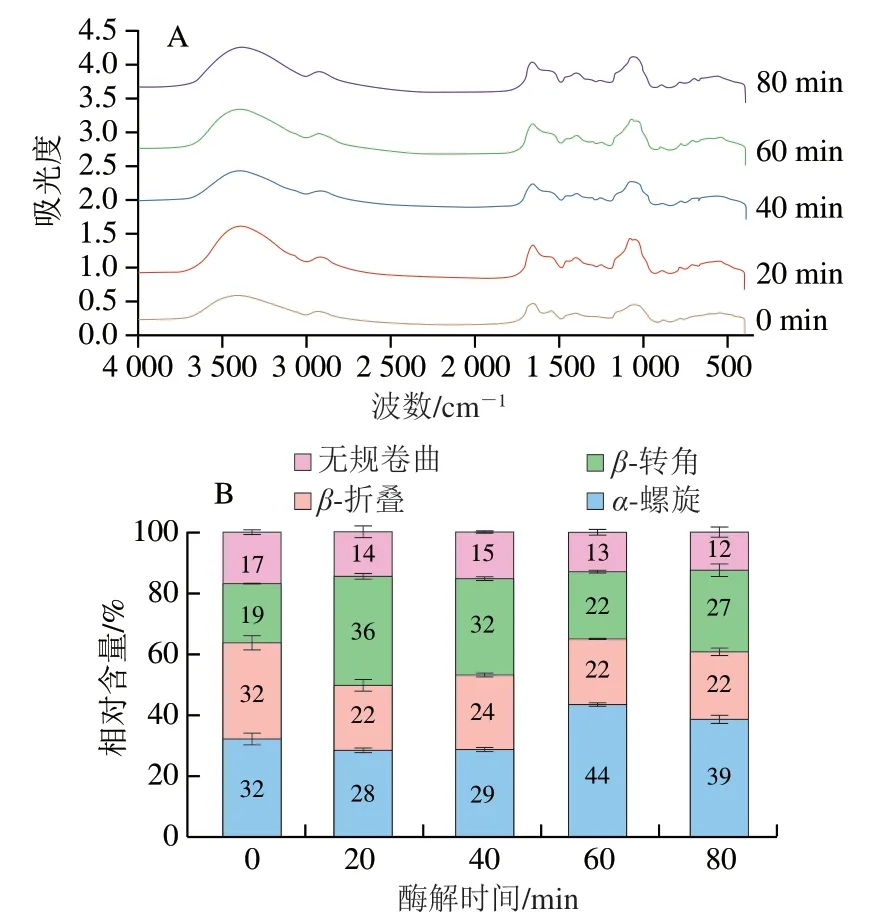
图9 双酶一步酶解对脱脂牛乳蛋白二级结构的影响Fig. 9 Effects of one-step hydrolysis on secondary structure of skimmed milk proteins
2.4.2 双酶一步酶解对脱脂牛乳游离巯基含量的影响
巯基通过交联形成的二硫键维持蛋白质结构的稳定,其含量的变化也表明蛋白质结构发生改变[27]。由图10可知,在0~20 min内脱脂牛乳中游离巯基含量极显著增加(P<0.01),随后20~80 min含量达到14.29 μmol/g,增加显著(P<0.05),表明酶解破坏了脱脂牛乳蛋白空间结构,使二硫键断裂。有研究表明,β-Lg内部包含的游离巯基Cys 121位点所在肽段AA 102~124可被超过97%牛乳过敏患者血清识别[28],酶解过程中脱脂牛乳蛋白结构的去折叠化会导致游离巯基Cys 121位点暴露,使脱脂牛乳致敏性增加。
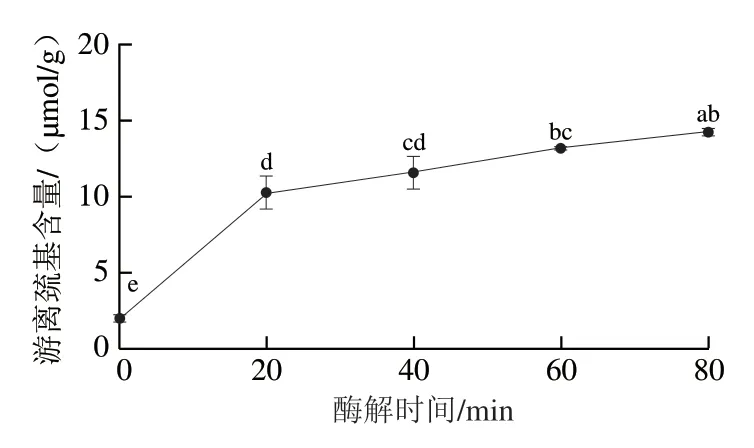
图10 双酶一步酶解对脱脂牛乳游离巯基含量的影响Fig. 10 Effects of one-step hydrolysis on free sulfhydryl content of skimmed milk
2.4.3 双酶一步酶解对脱脂牛乳H0的影响
蛋白质疏水性基团之间可以通过相互作用力维持蛋白质三级结构,通过蛋白质表面疏水性变化可以了解蛋白质三级结构的改变,荧光光谱的最大荧光强度与蛋白质表面疏水性呈线性关系[29]。由图11可知,酶解后的脱脂牛乳蛋白荧光强度上升,荧光光谱发生蓝移,在40 min内脱脂牛乳蛋白H0显著上升(P<0.05),与2.4.1节结果结合分析,可能是由于脱脂牛乳蛋白被酶解破坏,使蛋白质结构松散,存在于蛋白质分子内部的疏水性结构暴露。40~80 min,脱脂牛乳蛋白H0每20 min间隔内上升不显著,可能是由于α-螺旋结构增加,疏水性基团互相交联,重新掩埋于蛋白质分子内部,阻碍与ANS荧光探针的结合,使H0增加不显著。

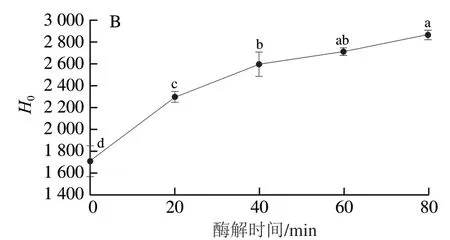
图11 双酶一步酶解对脱脂牛乳蛋白H0的影响Fig. 11 Effects of one-stephydrolysis on H0 of skimmed milk
2.4.4 双酶一步酶解对脱脂牛乳Zeta电位的影响
由图12可知,酶解80 min内脱脂牛乳呈负Zeta电位,未酶解时脱脂牛乳具有较强负电位(-(12.15±0.21) mV),表明此时体系中带有同种电荷的粒子较多,粒子间斥力较大,体系稳定。酶解开始后Zeta电位绝对值显著下降(P<0.05),酶解40 min以后Zeta电位变化不显著,表明酶解使脱脂牛乳体系中带电粒子表面净电荷减少,粒子间静电斥力减弱,更易发生聚集,使脱脂牛乳体系稳定性降低[30]。
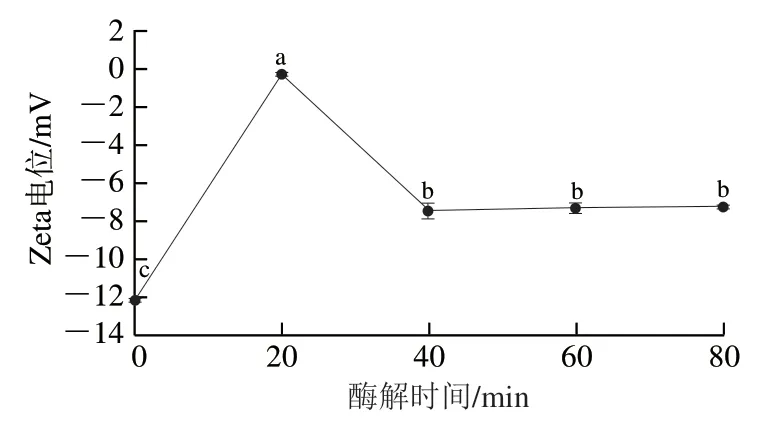
图12 双酶一步酶解对脱脂牛乳Zeta电位的影响Fig. 12 Effects of one-step hydrolysis on Zeta potential of skimmed milk
2.4.5 双酶一步酶解对脱脂牛乳粒径的影响
由图13可知,脱脂牛乳平均粒径随酶解时间延长显著增加(P<0.05),平均粒径由248 nm显著上升至470 nm(P<0.05),80 min后平均粒径为346.9 nm,与Zeta电位结果一致,可能由于粒子间发生了聚集。粒度分布结果显示,脱脂牛乳的粒度呈正态分布,峰值约为295 nm,酶解20 min分布后形成分别位于220 nm及1 281 nm附近的双峰,可能由于酶解破坏大分子蛋白质使粒径减小,与此同时也改变了脱脂牛乳体系净电荷数目,使粒子产生聚集,导致粒径增加。脱脂牛乳的PDI显著上升(P<0.05),表明酶解处理导致脱脂牛乳体系稳定性变差[31]。

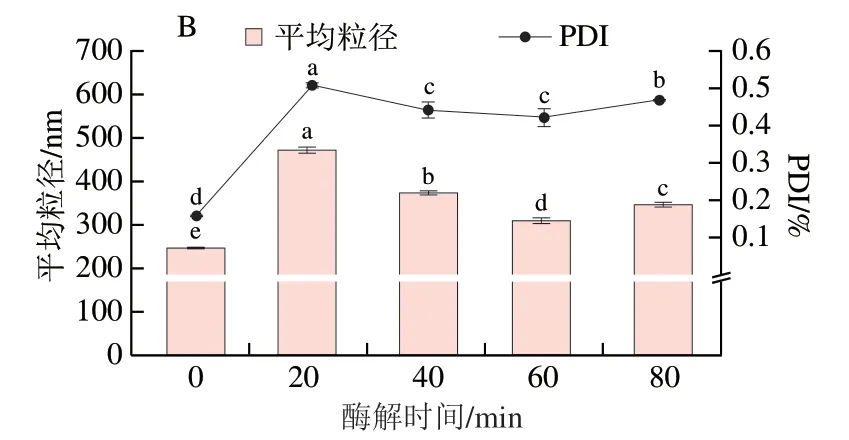
图13 双酶一步酶解对脱脂牛乳粒度分布(A)、平均粒径及PDI(B)的影响Fig. 13 Effects of one-step hydrolysis on the particle size distribution (A),average particle size and PDI (B) of skimmed milk
2.5 双酶水解脱脂牛乳蛋白对过敏患者血清IgE结合能力的影响
由图14可知,双酶一步酶解脱脂牛乳蛋白80 min后,IgE结合能力显著降低23.53%(P<0.05),大多数的牛乳过敏反应是由IgE介导的Ⅰ型超敏反应,因此脱脂牛乳IgE结合能力的降低表明双酶混合酶解可以有效降低脱脂牛乳致敏性。

图14 双酶水解脱脂牛乳蛋白对过敏患者血清IgE结合能力的影响Fig. 14 Effects of one-step hydrolysis on binding capacity of skimmed milk proteins to serum IgE from patients with milk allergy
3 结 论
本研究以酶解产物水解度、分子质量分布、与IgG及患者血清IgE结合能力为考察指标,研究双酶复合处理中酶添加量、酶配比、酶解方式对脱脂牛乳水解效果的影响,确定双酶一步水解E/S为3 000 U/g、碱性蛋白酶与风味蛋白酶配比为3∶1、水解80 min的条件下脱脂牛乳中主要致敏乳蛋白CN、α-La、β-Lg的IgG结合能力分别下降74.93%、97.24%、93.46%(P<0.05),酶解破坏脱脂牛乳蛋白高级结构,α-螺旋、β-转角结构增加,β-折叠结构减少,游离巯基含量显著增加至14.29 μmol/g(P<0.05),表面疏水性增强,结构趋于松散;脱脂牛乳体系中粒子发生聚集,平均粒径显著增加至346.9 nm(P<0.05),稳定性降低;酶解产物对牛乳过敏患者血清IgE结合能力显著降低(P<0.05),降低率达23.53%,脱脂牛乳蛋白整体致敏性显著降低69.6%(P<0.05)。与其他降低脱脂牛乳蛋白致敏性方法相比,双酶法具有作用条件温和、对致敏蛋白降解率高等优势,本研究为开发低致敏牛乳制品提供了参考。
