市售婴幼儿乳粉中乳清蛋白的胃肠消化稳定性及其抗原性评估
2022-09-08傅斯琪陈红兵
周 启,杨 帆,傅斯琪,邱 毓,李 欣,3,*,陈红兵
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学 江西省食物过敏重点实验室,江西 南昌 330047;4.南昌大学 中德联合研究院,江西 南昌 330047)
牛乳富含蛋白质,是婴幼儿成长发育的重要营养来源之一[1]。然而,牛乳又是联合国粮农组织和世界卫生组织公论的“八大过敏食物”之一。在全世界范围内,儿童牛乳过敏患病率为1.0%~7.5%,成人牛乳过敏患病率为0.1%~0.5%[2]。在中国,婴儿牛乳过敏的患病率高达2.69%[3],婴幼儿牛乳过敏现象越来越严重,症状越来越多样,严重影响了婴幼儿健康和生长发育。
引起牛乳过敏的蛋白质主要是酪蛋白和乳清蛋白,其中乳清蛋白中α-乳白蛋白(α-lactalbumin,ALA)和β-乳球蛋白(β-lactoglobulin,BLG)为主要过敏原[4]。ALA占总牛乳蛋白的5%,占乳清蛋白的25%,其分子质量约为14.4 kDa。BLG占牛乳乳清蛋白总量的50%以上,分子质量约为18.3 kDa,普通牛乳中主要有2 种变异体,呈水溶性,且据统计,约82%的牛乳过敏患者对BLG过敏[5-6]。
过敏反应的免疫学基础是抗体对抗原的过激性免疫应答反应。蛋白质的表位决定了蛋白质的免疫应答特性[7]。根据表位的结构可将表位分为线性表位和构象性表位[8]。线性表位的活性依赖于氨基酸序列的一级结构,构象表位的活性则依赖于空间构象[9]。在消化过程中,表位是否被消化降解也是评估蛋白质抗原性变化的重要指标。
目前,国外对低致敏配方乳粉研究深入而且已工业化生产,我国起步较晚。国外低致敏乳粉品牌几乎占据全部市场份额[10],但它们的致敏性差异不详。因此,本研究随机选取市场上5 种乳粉进行体外静态模拟胃肠消化,通过电泳、水解度测定和间接竞争酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)实验评估乳粉中乳清蛋白的抗原性变化,为科学评价不同品牌乳粉的稳定性和致敏性提供依据。
1 材料与方法
1.1 材料与试剂
实验所用婴幼儿配方乳粉均采购于市场,样品信息见表1。
N-三(羟甲基)甲基甘氨酸(Tricine)、三(羟甲基)氨基甲烷(Tris)、丝氨酸、四甲基乙二胺 生工生物工程(上海)股份有限公司、40 g/100 mL丙烯酰胺-甲叉双丙烯酰胺溶液(丙烯酰胺、甲叉双丙烯酰胺质量比19∶1) 北京索莱宝科技有限公司;预染大分子蛋白质Marker 美国Thermo公司;低分子质量蛋白Marker立陶宛Thermo公司;ALA、BLG 本实验室;胃蛋白酶、甘氨脱氧胆酸钠、牛磺胆酸钠、胰酵素、明胶、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔免疫球蛋白G(immunoglobulin G,IgG)美国Sigma公司;四甲基联苯胺(tetramethyl benzidine,TMB)显色试剂盒 北京欣博盛生物科技有限公司;其他常规试剂均为分析纯。
1.2 仪器与设备
LK-120A电子天平 日本A&D公司;Model 860酶联免疫检测仪、迷你型蛋白电泳仪、GS-800凝胶成像系统 美国Bio-Rad公司;96 孔酶标板 深圳金灿华实业有限公司;ZHWY-103B恒温培养振荡器 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 体外模拟婴幼儿胃肠消化
参考杨帆[11]、Ménard[12]等建立的婴幼儿体外静态消化方法,并稍作修改。模拟胃液和消化液按照杨帆[11]的实验方法进行配制。
模拟胃部消化:将配制的10 mL总蛋白质量浓度为20 mg/mL的乳粉样液与8 mL模拟胃液和5 μL 0.3 mol/L CaCl2溶液混合,用1 mol/L HCl调节pH值为5.3,并加入水至溶液总体积18.4 mL,于37 ℃摇床上温育10 min后加入1.6 mL胃蛋白酶溶液(3 125 U/mL),放置于37 ℃摇床上温育。每个离心管分别控制温育时间0(G0)、30(G30)、60(G60)、120 min(G120),分别取样1 mL,加入适量1 mol/L NaHCO3溶液调节pH值为7.0,并置于冰上以停止反应。
模拟肠道消化:取上述胃部消化60 min终止消化的溶液10 mL,加入到等体积温育的pH 7模拟肠道消化液中,在37 ℃摇床中温育。每个离心管分别控制温育时间0(I0)、30(I30)、60(I60)、120 min(I120),分别取样1 mL,加入10 μL终浓度为4 mmol/L的4-(2-氨乙基)苯磺酰氟盐酸盐,并置于冰上以停止反应。最后将所有收集的消化溶液置于-20 ℃冰箱保存,用于后续实验。
1.3.2 Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis,Tricine-SDS-PAGE)
采用Tricine-SDS-PAGE方法对乳粉体外消化后的产物分子质量进行鉴定。致密胶、夹层胶和浓缩胶浓度分别为16.5%、10%和4%,每孔上样量为15 μL,在30 V、1 h和100 V、约3 h的电泳条件下电泳。电泳结束后,凝胶分别用固定液和考马斯亮蓝染液固定15 min、染色10 min,之后进行脱色处理,直至条带清晰为止;最后进行凝胶成像。
1.3.3 水解度的测定
参考Nehir Ei等[13]采用的邻苯二甲醛(o-phthalaldehyde,OPA)法测定经体外消化后的蛋白质水解度,并稍作修改和调整。
OPA溶液配制:将3.81 g硼砂(十水合四硼酸钠)和100 mg SDS溶于60 mL去离子水中至完全溶解;将80 mg OPA溶于2 mL无水乙醇中,溶解完全后转移至先前制备的溶液中,再加入88 mg二硫苏糖醇,最后用去离子水将溶液定容至100 mL,上述2 步制备过程避光操作。
丝氨酸标准溶液制备:50 mgL-丝氨酸用去离子水溶解、定容至500 mL。
取3 mL制备的OPA溶液与400 µL 0.075 mg/mL胃消化和胃肠消化后的溶液混匀5 s,避光反应2 min后用酶标仪在340 nm波长处测定光密度(OD340nm),做3 次平行实验。以溶液浓度(mmol/L)为横坐标,OD340nm为纵坐标制作标准曲线。水解度按式(1)~(3)计算。
式中:W为水解过程中每克蛋白被断裂肽键数目/(mmol/g);c为样品中所含L-丝氨酸当量/(mmol/L),可由标准曲线求得;V为样品体积/L;n为样品稀释倍数;m为样品质量/g;ω为样品中蛋白质质量分数/%;h为修正后的水解过程中每克蛋白被断裂肽键数目/(mmol/g);htot为每克纯蛋白中肽键数,为8.2 mmol/g;α、β均为修正因子,分别视为常数1.039和0.383。
1.3.4 间接竞争ELISA
采用间接竞争ELISA法评估体外消化后的乳粉中ALA和BLG的IgG结合能力和抗原性变化。具体步骤参考孟轩夷[14]的方法,稍作修改。ALA稀释质量浓度梯度为0.5、1.0、2.0、5.0、10.0、20.0 μg/mL,BLG稀释质量浓度梯度为0.5、2.5、5.0、10.0、25.0、50.0 μg/mL。
每孔用包被液包被100 μL未处理的ALA(3 μg/mL)或BLG(3 μg/mL),置于4 ℃过夜。次日倾去包被液,用PBST(含0.05%吐温-20的PBS)洗涤3 次,5 min/次。加入3 g/100 mL明胶进行封阻(250 μL/孔),37 ℃孵育1 h。倾去封阻液,以PBST洗涤并拍干3 次。取另一块酶标板以同样的方式进行封阻,洗板3 次后,分别加入60 μL样品(竞争抗原)和等体积的稀释(1∶160 000)后兔抗ALA或兔抗BLG多克隆抗体,于37 ℃孵育1 h。反应结束后,每孔吸取100 μL混合物移至第1块板内进行竞争,继续37 ℃孵育1 h,PBST洗涤3 次。每孔加入100 μL HRP标记的羊抗兔IgG(1∶5 000稀释),37 ℃继续孵育1 h,PBST洗涤3 次。二抗反应结束后,洗板3 次,加入100 μL TMB,37 ℃避光反应15 min。每孔加入50 μL 2 mol/L H2SO4以终止反应。利用酶标仪在450 nm波长处测定光密度(OD450nm),做3 次平行实验。
根据得到的OD450nm,绘制5 种配方乳粉消化不同时间后ALA或BLG的竞争抑制性曲线,计算出半抑制质量浓度(IC50),用于表征消化产物中ALA和BLG的IgG结合能力变化。抑制率按式(4)计算。

式中:B0为无竞争抗原时的OD450nm;B为消化产物中竞争抗原对应的OD450nm。
1.4 数据处理
每组实验进行3 次平行实验,结果取平均值,利用Origin 2021软件和GraphPad Prism 8软件统计分析数据并绘图,用Excel软件绘制表格,数据以平均值±标准差表示。
2 结果与分析
2.1 乳粉中主要过敏原蛋白的胃肠消化稳定性
由图1可知,随胃肠道消化时间的延长,蛋白质电泳条带的颜色逐渐变浅,扩散带逐渐消失,表明在消化过程中乳粉中的蛋白质逐渐被降解为小分子肽段[15]。5 种配方乳粉中的酪蛋白经胃消化60 min、肠消化30 min后几乎全部被降解为小分子肽段,但BLG和ALA在5 种配方乳粉中几乎不受胃消化的影响,在肠消化过程均逐渐降解,并且BLG在肠消化120 min后几乎全部被降解为小分子肽段,ALA在肠消化120 min后虽然降解程度很大,但未被完全降解为小分子肽段,稳定性相对较高。水解过程中,条带的差异可能由乳粉配方不同导致,由于蛋白质本身的结构特性及电荷属性,乳粉中特殊的配方成分与蛋白质结合,从而屏蔽、遮掩了水解位点,导致条带差异明显[16]。
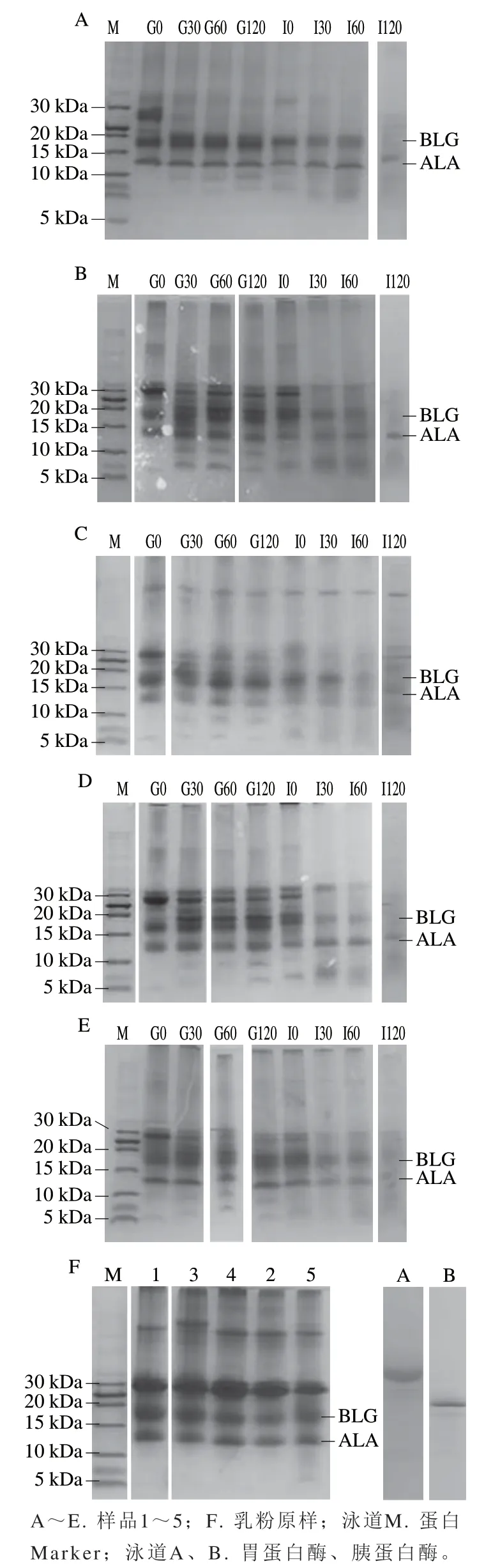
图1 模拟婴幼儿体外消化前后5 种婴幼儿配方乳粉的Tricine-SDS-PAGE图Fig. 1 Tricine-SDS-PAGE profiles of the five infant formulas digested in simulated gastrointestinal fluid
2.2 乳粉中主要过敏原蛋白胃肠消化产物的水解度
水解度是评估蛋白质体外消化的重要指标之一,表示消化过程中蛋白质的肽键断裂程度[17]。由图2可知,随着消化时间的延长,乳粉中蛋白质的水解度整体呈上升趋势,且在肠消化过程上升幅度较大,表明与胃蛋白酶相比,胰蛋白酶水解蛋白质速率更快。且与对照组(G0)相比,肠消化组水解度存在极显著差异(P<0.01),大部分乳粉的胃消化水解度与对照组存在极显著差异(P<0.01),但部分乳粉的胃消化水解度与对照组只存在显著差异(P<0.05)。可能是由于胃蛋白酶属于内切型蛋白酶,其酶切位点较特异,因此通常其水解肽键程度较低;而胰蛋白酶具有更多酶切位点,能更快水解蛋白质,使其变成肽段和游离氨基酸,从而使其水解度增大[18]。然而,在胃肠道水解蛋白质过程中,短肽间可能会形成聚集体,增加空间位阻、改变酶的结合位点,从而影响部分蛋白的水解程度。但结果显示,蛋白质水解度整体不超过18%,水解度较低,消化稳定性较好,与婴幼儿的消化系统尚未发育成熟、消化功能较弱事实相符。

图2 5 种乳粉体外消化后的蛋白质水解度Fig. 2 Degree of hydrolysis of proteins in digested milk formulas in simulated infant gastrointestinal fluid
值得注意的是,结合电泳条带和水解度来看,乳粉样品5中的主要过敏原BLG和ALA在胃肠消化过程中降解程度最大,消化稳定性最差,且在肠消化60 min时几乎全部降解,说明乳粉样品5更容易被婴幼儿的胃肠道消化。
2.3 乳粉胃肠消化产物中ALA和BLG的抗原性
在间接竞争ELISA实验中,一般用IC50表示抗原-抗体结合能力,二者呈负相关,即当竞争抗原的IC50越大,则说明达到半抑制率所需的竞争抗原量越多,也就是竞争抗原与抗体的结合能力越弱[14]。由图3和表2可知,随着消化时间的延长,各乳粉中乳清蛋白与IgG的结合能力变化不同。乳粉1和4中ALA与IgG的结合能力随着消化时间的延长呈现先上升后下降再上升的趋势,乳粉2和3中ALA与IgG的结合能力随着消化时间的延长呈现先上升后下降的趋势,乳粉5中ALA与IgG的结合能力随着消化时间的延长呈现上升的趋势。此外,乳粉1和5中BLG与IgG的结合能力随着消化时间的延长呈现先上升后下降的趋势;乳粉3和4中BLG与IgG的结合能力随着消化时间的延长呈现先下降后上升再下降的趋势;乳粉2中BLG与IgG的结合能力随着消化时间的延长呈现先上升后下降再上升的趋势。
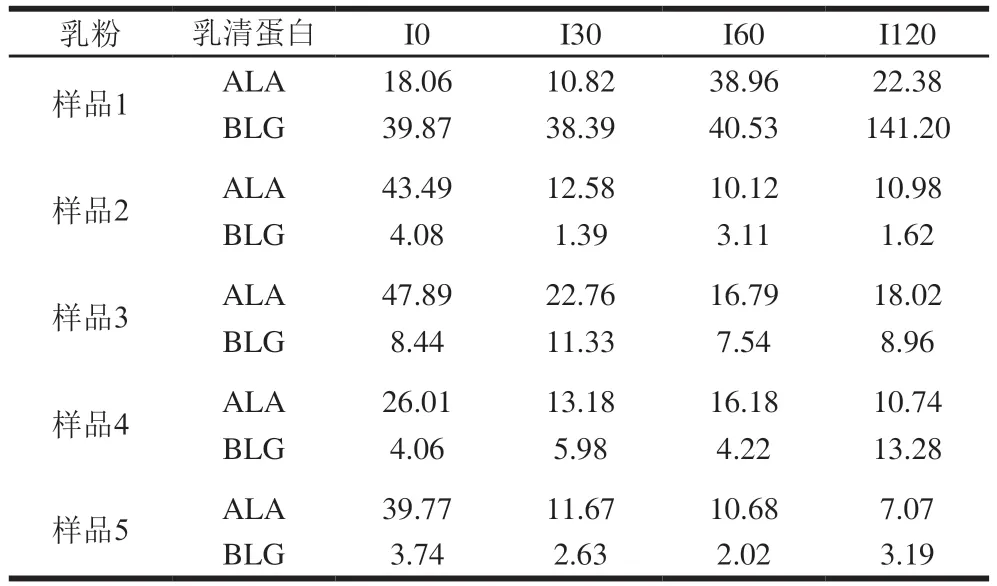
表2 5 种乳粉胃肠消化产物对IgG的IC50Table 2 IC50 for IgG of gastrointestinal digestive products of five milk powders μg/mL

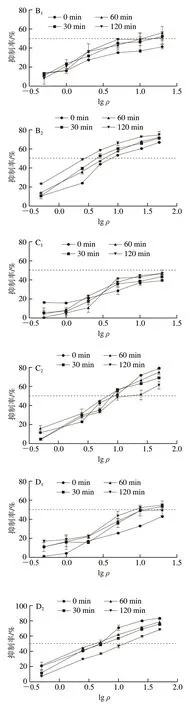

图3 乳粉中乳清蛋白体外消化后对IgG的抑制率Fig. 3 Inhibition rates of whey protein in milk powder subjected to in vitro digestion toward IgG
分析各乳粉的抗原性变化发现,大部分乳粉经过消化之后,乳清蛋白与IgG结合能力比消化前更低,可能是由于消化水解破坏了部分过敏原蛋白质原有的表位和空间结构,Tricine-SDS-PAGE条带与水解度的测定结果表明,大分子蛋白经体外消化后降解为更多的小分子蛋白,甚至是短肽、氨基酸,这能够间接证明蛋白质表位受到一定程度的破坏,进而降低乳粉消化产物的抗原性。同时,蛋白质经过水解后会产生游离氨基酸残基,水解酶对过敏原蛋白的修饰会导致线性和构象表位丢失。
然而,随着消化的进行,部分乳粉的蛋白质消化过程中,乳清蛋白与IgG结合能力上升,这可能是由于在蛋白质消化过程中,乳粉中蛋白质与不同物质形成新聚集体复合物,特殊的聚集体复合物结构增大了空间位阻,难以与水解酶结合,甚至在此过程中可能产生了新的过敏表位。乳粉3和4中BLG与IgG的结合能力随着消化时间的延长呈现先下降后上升再下降的趋势,可能是由于蛋白酶水解消化破坏蛋白质原有的空间结构和表位时,隐藏在蛋白质内的更多线性或构象表位暴露[19],但随着蛋白酶进一步水解,新暴露的表位被破坏,IgG结合能力又下降至低于未水解的乳清蛋白结合能力。乳粉2和5经过120 min肠消化后,其水解产物的IgG结合能力比未经肠消化更高,但从SDS-PAGE及水解度的结果发现,大分子蛋白基本被降解,水解度却较消化90 min有一定降低,这可能是因为游离的氨基酸、短肽之间相互结合形成了新的表位序列,或者总体比较,在蛋白酶水解消化破坏蛋白质原有的空间结构和表位时,隐藏在蛋白质内的线性或构象表位被暴露更多[19],从而使消化后乳粉的抗原性增加。
从实验结果来看,体外消化对不同乳粉水解度和抗原性变化的影响不同。首先,可能是由于乳粉的配方不同,乳粉中蛋白质与不同物质形成的新聚集体复合物不同,聚集体结构增大产物的空间位阻大小不一;其次,也可能是由于乳粉的不同加工处理方式,乳粉加工过程的热处理可能会引起蛋白质的结构改变,使蛋白质暴露的过敏表位不同;再者,经过体外消化处理,不同乳粉中的蛋白质水解位点存在差异,导致水解度不一致。除此之外,如今国际标准的配方乳粉一般由40%酪蛋白和60%乳清蛋白及特定的氨基酸序列配方组成,但不同乳粉的配方有一定差异,由于不同乳粉配方选择不同氨基酸,可能会形成不同蛋白质致敏性表位,同时不同类型的蛋白质经消化后,产物结构的特殊性、致敏性表位位点可能被屏蔽、覆盖,甚至暴露、破坏,这都会导致消化后乳粉中乳清蛋白的抗原性变化[20]。
3 结 论
本实验通过建立体外消化模型,对市场上选取的5 种乳粉进行体外消化,再采用Tricine-SDS-PAGE、水解度测定和间接竞争ELISA评估乳粉中乳清蛋白消化稳定性和抗原性的变化。结果表明,不同乳粉的消化稳定性有所差异,且消化对乳粉中乳清蛋白抗原性影响较大,部分乳粉中乳清蛋白与抗体结合能力降低,部分有所增加。不同乳粉中乳清蛋白的抗原性随着消化时间延长发生了不同的变化,这可能是由于体外动态消化更能模拟牛乳蛋白在体内胃肠消化的消化特性和抗原性的变化,而静态消化的模拟效果相对较差。总体而言,体外消化有利于降低乳粉中乳清蛋白消化稳定性和抗原性,因此,乳粉配方或可使用经体外消化中的胃蛋白酶和胰蛋白酶酶解的乳清蛋白,即以酶水解蛋白质的过敏表位,降低乳粉潜在致敏风险。总之,本研究为客观评价不同品牌乳粉的致敏性提供了部分科学依据,有助于乳过敏患者的安全膳食管理。
