消减牛乳酪蛋白致敏性蛋白酶的筛选
2022-09-08谭宏凯程剑锋熊子奕陈红兵
谭宏凯,程剑锋,熊子奕,胡 巍,李 欣,3,*,陈红兵
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学 江西省食物过敏重点实验室,江西 南昌 330047;4.南昌大学 中德联合研究院,江西 南昌 330047)
牛乳及乳制品因其高营养价值而深受消费者喜爱,然而,牛乳过敏严重影响过敏人群的食用安全。牛乳及乳制品被世界卫生组织/联合国粮农组织确定为8 种主要过敏食物类别之一[1]。牛乳过敏的临床症状包括湿疹、呼吸困难、腹痛、呕吐等[2],严重者甚至会导致患者休克和死亡。牛乳过敏是生命早期的常见疾病,患病率为2%~7%,且呈上升趋势[3]。在最近对6 768 名1 岁以下中国婴儿的调查中,发现牛乳过敏的患病率为2.69%[4]。酪蛋白约占牛乳蛋白的80%,是牛乳中含量最丰富且最容易引起牛乳过敏的蛋白质[5-6]。酪蛋白具有很高的营养价值和特殊的结构和理化性质,已广泛应用于功能性食品工业[7-9]。研究如何降低酪蛋白致敏性至关重要。已经有许多加工技术可用于降低牛乳蛋白的致敏性,包括热处理、糖基化和酶解[10-12]。其中,酶解是一种温和、安全、有效的降低乳蛋白致敏性的加工技术,已被广泛用于生产低致敏性蛋白水解物[13-16]。
酶解能够破坏乳蛋白的非线性表位与线性表位,抗原表位是否保留很大程度上取决于乳蛋白水解度及酶解使用的酶种类[17]。当蛋白酶水解度合适时,可以破坏乳清蛋白的抗原线性表位,降低其致敏性[18-19]。通过筛选蛋白酶,切断酪蛋白的表位,能够从根本上解决蛋白质致敏问题,对保障牛乳过敏人群的安全消费具有重要意义。此外,酶解可以产生多种新肽,保持乳蛋白的营养价值,并为婴幼儿提供许多生理益处[20-21]。
本研究以酪蛋白为酶解底物,选取7 种食品级蛋白酶酶解酪蛋白,降低其致敏性。以蛋白酶酶解后酪蛋白残留致敏原性、水解产物的分子质量分布、水解度为主要指标,筛选出消减酪蛋白致敏原性效果最佳的蛋白酶,为制备低致敏酪蛋白产品提供理论基础。
1 材料与方法
1.1 材料与试剂
酪蛋白、菠萝蛋白酶(600 U/mg)、木瓜蛋白酶(800 U/mg) 北京索莱宝科技有限公司;邻苯二甲醛(o-phthalaldehyde,OPA)、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔免疫球蛋白G(immunoglobulin G,IgG)、生物素标记羊抗人IgE、抗酪蛋白抗体 美国Sigma公司;胰凝乳蛋白酶(45 U/mg) 北京迈瑞达科技有限公司;碱性蛋白酶(200 U/mg) 上海源叶生物科技有限公司;中性蛋白酶(50 U/mg)、复合风味蛋白酶(100 U/mg)、胰蛋白酶(300 U/mg) 丹麦诺维信公司;其他常规试剂均为国产分析纯。
1.2 仪器与设备
DK-S22电热恒温水浴锅 上海精宏实验设备有限公司;Vortex Genius 3漩涡混合器 德国IKA公司;LK-120A电子天平 日本A&D公司;超纯水系统德国Milipore公司;Varioskan LUX多功能微孔板读数仪、Sorvall ST 16R高速冷冻离心机 立陶宛Thermo公司;PB-10 pH计 德国Sartorius公司;SRT-202滚轴式混合器 江苏海门麒麟医用仪器厂。
1.3 方法
1.3.1 酪蛋白水解
选取市面上7 种食品级蛋白酶,以一定的条件酶解酪蛋白。取酪蛋白固体粉末溶解于超纯水中配制成24 mg/mL的酪蛋白溶液,吸取20 mL于50 mL离心管中,在设定温度下预热后,加入设定比例的不同蛋白酶进行水解,水解过程中不断搅拌,水解完成后99 ℃水浴处理15 min灭酶,冷却后300×g离心5 min取上清,分装保存。酶解条件如表1所示。

表1 酪蛋白酶解条件[22-25]Table 1 Enzymatic hydrolysis conditions of casein[22-25]
1.3.2 酪蛋白酶解产物分子质量变化
采用三(羟甲基)甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis,Tricine-SDS-PAGE)分析酪蛋白酶解产物分子质量变化。参考熊鼎[25]的配方,依次制备16.5%分离胶、10%夹层胶和4%浓缩胶。设定电泳程序,恒压30 V运行1 h,100 V电压运行3 h,当溴酚蓝指示剂接近凝胶底部时停止电泳。以低分子质量Marker标准为参比,得到所需蛋白条带。样品上样量均为15 μL。用凝胶成像系统对凝胶进行扫描成像。
1.3.3 Western blotting分析
采用免疫印迹法(Western blotting)测定血清IgG与酪蛋白组分的结合特点[26]。按照1.3.2节步骤,将酪蛋白及酶解样品进行Tricine-SDS-PAGE,电泳结束后取出凝胶,用蒸馏水漂洗3 次,每次5 min,然后置于转运缓冲液中浸泡。准备硝酸纤维素(nitrocellulose membrane,NC)膜与滤纸,以凝胶大小裁剪,浸泡于转运缓冲液中。按照“滤纸-凝胶-NC膜-滤纸”的顺序组装,组装过程排除气泡。将装好的转膜装置放入蛋白转印仪中,加入转运缓冲液,以100 V、2 h的程序开始电转。电转结束后将膜取出用洗脱液漂洗3 次,每次5 min,用封阻液于37 ℃摇床中封阻1 h。封阻结束,再次漂洗,加入一抗兔血清(使用含体积分数0.1%吐温-20的Tris缓冲液,以1∶5 000稀释),置于4 ℃孵育过夜,次日取出漂洗。加入HRP标记的羊抗兔IgG(使用含体积分数0.1%吐温-20的Tris缓冲液,以1∶5 000稀释),于37 ℃摇床中孵育1 h,用洗脱液漂洗,最后用显色液显色、成像。
1.3.4 酪蛋白酶解产物水解度测定
水解度能够评价水解过程中蛋白降解程度[27]。水解度测定采用OPA法,具体操作如下:准确吸取400 μL样品加入到含有3 mL OPA溶液的离心管中,混匀后避光反应2 min,用紫外分光光度计在340 nm波长处测定不同样品吸光度。配制不同浓度的精氨酸稀释液,以精氨酸浓度(mmol/g)为横坐标,吸光度为纵坐标绘制标准曲线,结合标准曲线,按式(1)计算水解度。
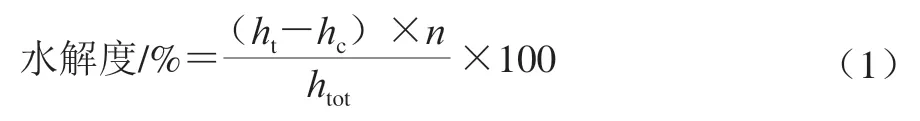
式中:n为样品的稀释倍数;ht为待测样品吸光度在标准曲线上对应的浓度(mmol/g);hc为未水解蛋白吸光度在标准曲线上对应的浓度(mmol/g);htot为常量,指每克原蛋白质中肽键的物质的量,酪蛋白htot=8.20 mmol/g。
1.3.5 反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)法检测酪蛋白酶解产物中肽段
参考Picariello等[28]的实验方法,利用RP-HPLC法分析酪蛋白酶解产物中的肽段。流动相A:2 mL三氟乙酸加入1 998 mL超纯水中,混匀,真空泵抽滤,过0.22 μm孔径的水系滤膜;流动相B:2 mL三氟乙酸加入1 998 mL乙腈中,混匀,真空泵抽滤,过0.22 μm孔径的有机滤膜。以上2 种溶液均需超声30 min以上以充分除气。酶解后样品稀释至2 mg/mL后用0.22 μm水系滤膜过滤。色谱柱为C18柱(4.6 mm×250 mm,5 μm),进样量20 μL,流速1 mL/min,柱温45 ℃,70 min内使用流动相B体积分数从5%增加至60%对肽段进行分离,紫外检测波长为214 nm。
1.3.6 酪蛋白酶解产物IgG结合能力测定
采用间接竞争酶联免疫吸附法(indirect competitive enzyme linked immunosorbent assay,ic-ELISA)对酶解后酪蛋白的IgG结合能力进行评估[25]。1)包被抗原:在96 孔酶标板中包被0.5 μg/mL酪蛋白,100 μL/孔,4 ℃过夜;2)封阻:次日倾去包被液,用含体积分数0.05%吐温-20的磷酸盐缓冲液洗涤3 次,5 min/次;每孔加入250 μL 3 g/100 mL明胶溶液进行封阻,37 ℃孵育1 h;3)板外竞争:另取一块新的酶标板以同样的方式进行封阻,按相同条件洗板之后,每孔加入60 μL酪蛋白酶解液上清(竞争抗原)和等体积的兔抗酪蛋白血清(1∶8 000稀释),37 ℃孵育1 h后,每孔吸取100 μL转移至第1块板内进行竞争反应,继续37 ℃孵育1 h后洗板;4)二抗反应:每孔加入100 μL HRP标记的羊抗兔IgG(1∶5 000稀释),37 ℃反应1 h;5)显色:洗板后,每孔加入100 μL现配的3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液,37 ℃避光反应15 min;6)终止反应:显色反应结束后,每孔加入50 μL 2 mol/L H2SO4终止液终止反应。
用酶标仪在450 nm波长处测定光密度(OD450nm)。根据OD450nm绘制不同酶解样品的竞争抑制性曲线,计算出IC50,用于表征IgG结合能力的变化。抑制率按式(2)计算。

式中:B0为无竞争抗原时的OD450nm;B为有竞争抗原时对应的OD450nm。
1.3.7 酪蛋白酶解产物IgE结合能力测定
采用ic-ELISA检测IgE结合能力[25]。基本操作步骤同1.3.6节,其中包被抗原时,酪蛋白包被质量浓度变为1 μg/mL;板外竞争时,以牛乳过敏患者血清(1∶100稀释)作为一抗;二抗反应时,二抗使用生物素标记的羊抗人IgE(1∶5 000稀释),37 ℃反应1 h后,再加入100 μL/孔HRP标记的亲和素(1∶60稀释),37 ℃反应1 h;其余步骤不变。最后计算出IC50,用于表征IgE结合能力的变化。所用牛乳过敏患者的血清池是由10 位牛乳过敏患者的血清等体积混合制备而成,这10 位患者的血清符合对牛乳过敏呈阳性条件,即特异性IgE水平大于1.0 IU/mL。
1.3.8 酪蛋白T细胞表位预测
从NCBI检索到牛乳4 种酪蛋白氨基酸序列,然后通过NetMHC(Ⅱ)/pan(http://www.cbs.dtu.dk/services/NetMHCIIpan/)、SYFPEITHI(http://www.syfpeithi.de/)和IEDB(http://www.iedb.org/)预测4 种酪蛋白的T细胞表位,并对酪蛋白的T细胞表位信息进行汇总。
1.3.9 胰凝乳蛋白酶酶解产物中残留T细胞表位肽鉴定
对胰凝乳蛋白酶酶解产物使用液相色谱-质谱联用技术来鉴定肽段信息,以分析表位肽残留情况。样品采用液相系统进行分离。流动相A为体积分数0.1%甲酸水溶液,流动相B为体积分数84%乙腈水溶液(含体积分数0.1%甲酸)。色谱柱以95%流动相A平衡后,样品由自动进样器上样至Trap柱。多肽和多肽碎片的质荷比按照以下方法采集:每次全扫描(Full scan)后采集20 个碎片图谱(MS2scan)。质谱测试原始文件(Raw file)用Maxquant 1.5.5.1软件检索相应的数据库,最后得到鉴定的蛋白质结果。
1.4 数据处理
实验数据以平均值±标准差表示,每组实验重复3 次,使用GraphPad Prism 8软件进行数据分析处理并作图。
2 结果与分析
2.1 酪蛋白酶解产物分子质量变化
蛋白酶可以水解蛋白质肽链,破坏致敏蛋白的结构,将其水解为小分子蛋白、多肽甚至是氨基酸,从而显著降低蛋白质的致敏性[29]。由图1A可知,1号泳道为未酶解的酪蛋白,分子质量主要集中在20~30 kDa,3号和6号泳道分别为木瓜蛋白酶和菠萝蛋白酶酶解酪蛋白产生的酶解肽,在5~10 kDa处有大量肽段残留,其他组别未见明显肽段残留。Wroblewska等[30]发现,酶解酪蛋白的抗原性主要存在于分子质量大于10 kDa的肽段,随着分子质量的减小,抗原性逐渐降低。Nakamura等[31]研究表明,分子质量1 600~3 500 Da的酪蛋白水解肽段不能引起IgE介导的过敏反应。因此从酶解产物分子质量而言,复合风味蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶和胰凝乳蛋白酶水解酪蛋白较为彻底,无3.5 kDa以上分子质量的肽段残留,致敏风险较小。而木瓜蛋白酶和菠萝蛋白酶酶解产物则含有大量5~15 kDa肽段残留,存在较高的致敏风险。
由图1B可知,2、4、5、7、8泳道分别对应复合风味蛋白酶、碱性蛋白酶、中性蛋白酶、胰蛋白酶、胰凝乳蛋白酶处理,无条带出现,表明酪蛋白组分与血清IgG未发生结合,无致敏肽段残留。Tricine-SDS-PAGE结果显示,木瓜蛋白酶酶解产物分子质量为5~15 kDa,Western blotting结果显示其仅在10~15 kDa显示条带,而5~10 kDa未显示条带,表明木瓜蛋白酶酶解产物分子质量5~10 kDa时致敏性基本被消除,这与Wroblewska等[30]的研究结果相一致。泳道6对应的菠萝蛋白酶在5~15 kDa有大量致敏肽段残留,且分子质量分布范围较宽,其酶解降低致敏性效果最差。

图1 酪蛋白酶解产物的Tricine-SDS-PAGE图(A)和Western blotting结果(B)Fig. 1 Tricine-SDS-PAGE patterns (A) and Western blotting (B) of casein hydrolysates
2.2 酪蛋白酶解产物水解度
由图2可知,酶解4 h后,复合风味蛋白酶酶解产物的水解度最高,达到52.88%,表明酪蛋白上有较多的复合风味蛋白酶酶切位点。菠萝蛋白酶酶解产物水解度最低,只有3.19%,与叶挺等[32]研究结果相同。其他的酶解产物水解度由高到低分别为碱性蛋白酶25.36%、胰凝乳蛋白酶21.46%、中性蛋白酶19.69%、木瓜蛋白酶16.89%、胰蛋白酶8.67%。刘晓宇等[33]采用5 种酶对酪蛋白进行酶解,结果显示,经过6 h酶解后,复合风味蛋白酶酶解产物水解度最低(7.1%),而本研究中复合风味蛋白酶酶解产物水解度远高于其他各酶,分析原因可能在于蛋白酶来源差异,本研究选取的复合风味蛋白酶具有更好的酶解能力。

图2 酪蛋白酶解产物的水解度Fig. 2 Degree of hydrolysis of casein hydrolysates
2.3 酪蛋白酶解产物RP-HPLC检测分析
RP-HPLC是利用蛋白质的疏水特性差异进行分离,不同的梯度洗脱速率会影响蛋白质分离效果和出峰时间。陡峭的梯度使得洗脱峰尖锐,但分辨率降低;而浅平的梯度能得到相对平缓的峰,但分辨率升高[34]。为了更好分离不同肽段,本研究采用速率更缓、时间更长的梯度洗脱。由图3可知,酪蛋白原料的出峰时间在52~56 min。
复合风味蛋白酶、胰凝乳蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶酶解产物在50~60 min附近没有峰出现,说明酪蛋白被酶解得较彻底。通常来说,极性强、分子质量小的分子扩散快,出峰时间更短[35]。从色谱图中可以看出,复合风味蛋白酶酶解酪蛋白后的肽段出峰时间集中在20 min之前,中性蛋白酶酶解产物出峰时间集中在30 min之前,说明复合风味蛋白酶、中性蛋白酶酶解酪蛋白的程度高于其他几种酶,同时产生了更多亲水性多肽。不同蛋白酶酶解产物的分子质量分布差异很明显,这是因为不同蛋白酶对酪蛋白的作用位点不同[36]。复合风味蛋白酶在0~20 min出现多个显著尖峰,表明其产生大量特定分子质量的小分子肽,其酶解特异性高于中性蛋白酶。碱性蛋白酶、木瓜蛋白酶、胰凝乳蛋白酶均有不同程度的酶解效果,根据峰型推断其酶解特异性存在显著差异,其中木瓜蛋白酶峰型连续、平缓,酶解特异性最差。菠萝蛋白酶和胰蛋白酶酶解产物在52~56 min依然有很明显的峰出现,可以判断出菠萝蛋白酶和胰蛋白酶对于酪蛋白的酶解效果不佳,酪蛋白残留较为明显。其中胰蛋白酶酶解后峰形较尖,且有多个峰,表明其酶解特异性优于菠萝蛋白酶。综合HPLC出峰时间和峰型分布得出,酶解效果最佳的为复合风味蛋白酶、中性蛋白酶,其次为碱性蛋白酶、木瓜蛋白酶、胰凝乳蛋白酶,胰蛋白酶和菠萝蛋白酶解效果最差。
2.4 酪蛋白酶解产物与IgG和IgE结合能力的变化
在ic-ELISA中,常用半抑制质量浓度(IC50)来表征抗原-抗体结合能力的强弱,即当竞争抗原的IC50越大,则说明达到半抑制率所需的竞争抗原量越多,即其抗原性越弱。通过ic-ELISA对酪蛋白酶解肽进行与IgG和IgE结合能力的评估,结果如图4所示。通过对图4的结果进行拟合,得到酪蛋白酶解肽的IC50如表2所示。通过酶解,酪蛋白与IgG、IgE的结合能力发生明显变化。
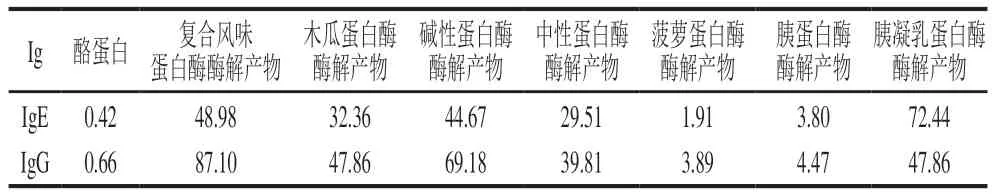
表2 酪蛋白酶解产物IC50Table 2 IC50 of casein hydrolysates μg/mL
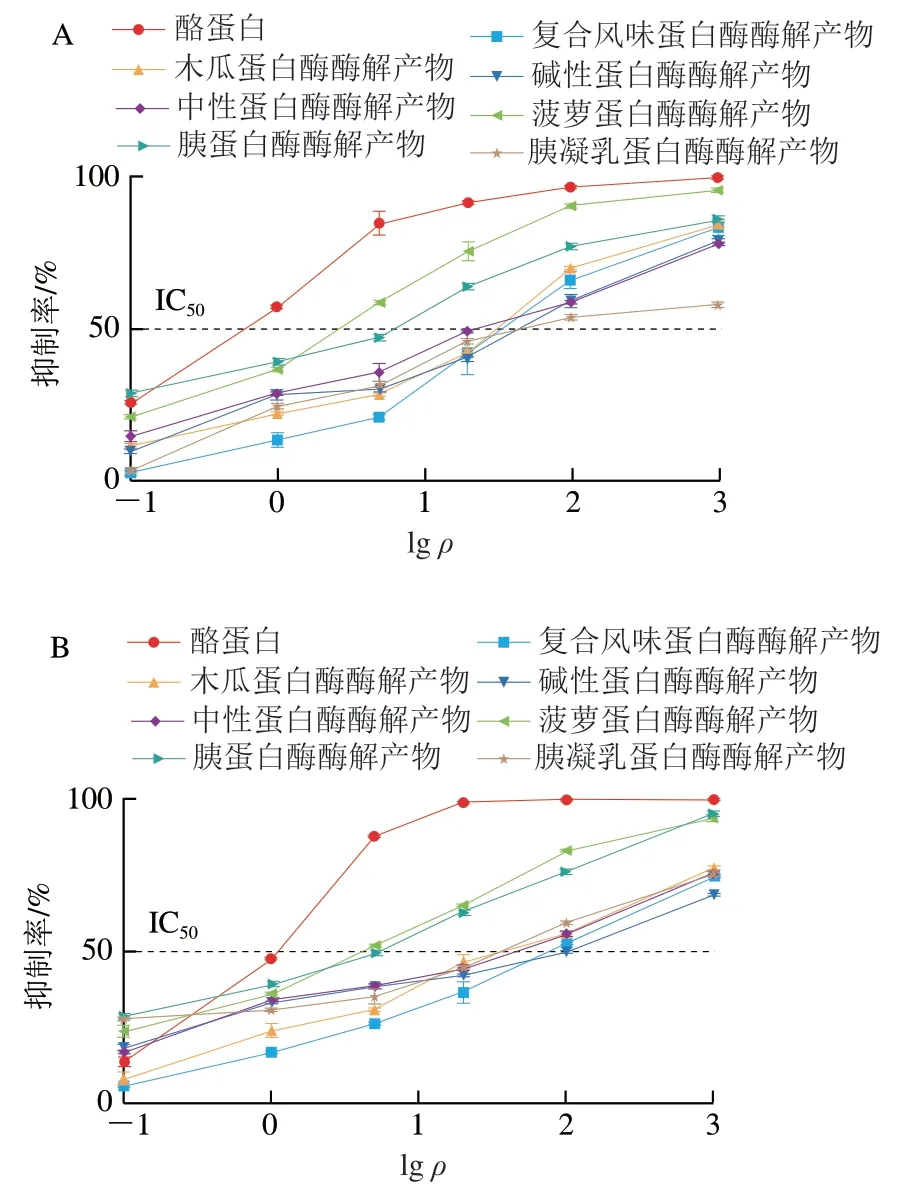
图4 酪蛋白酶解产物与IgE(A)和IgG(B)结合抑制率的变化Fig. 4 Changes in binding ability of casein hydrolysates to IgE (A) and IgG (B)
在与IgE的结合能力中,未水解酪蛋白IC50=0.42 μg/mL,经胰凝乳蛋白酶酶解酪蛋白肽的IC50=72.44 μg/mL,其IgE结合能力降低为未处理前的1/172,致敏性降低效果最显著;菠萝蛋白酶酶解酪蛋白肽的IC50=1.91 μg/mL,其IgE结合能力降低为未处理前的1/5,致敏性降低效果最弱。复合风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶及胰蛋白酶酶解产物与IgE的结合能力分别降低为未处理前的1/117、1/106、1/77、1/70、1/9,致敏性降低效果依次减弱。
在与IgG的结合能力中,未水解酪蛋白IC50=0.66 μg/mL,经复合风味蛋白酶酶解酪蛋白肽的IC50=87.10 μg/mL,与IgG的结合能力降低为未处理前的1/132,致敏性降低效果最显著;菠萝蛋白酶酶解酪蛋白肽的IC50=3.89 μg/mL,其IgG结合能力降低为未处理前的1/6,致敏性降低效果最弱。碱性蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、中性蛋白酶及胰蛋白酶酶解产物与IgG的结合能力分别降低为未处理前的1/105、1/73、1/73、1/60、1/7,致敏性降低效果依次减弱,这与Liang Xiaona等[37]的研究结果一致。
结合酪蛋白水解度和酶解产物与IgG和IgE结合能力的变化可以发现,水解度与IgG和IgE结合能力并无严格对应规律。不同蛋白酶水解酪蛋白时,水解度的高低并不能代表残留过敏原性的高低,二者没有呈现正向对应关系。Van Esch等[38]在评估乳清蛋白水解物致敏性时也获得了类似的结果。这主要与不同蛋白酶特异水解酪蛋白的位点有关,酶解位点的不同将会影响酶解酪蛋白抗原结合表位的效果。
2.5 酪蛋白T细胞表位预测结果
食物过敏发生历程中残留的特定肽段(T细胞表位)激活T淋巴细胞属于过敏反应的致敏阶段,这是缓解过敏反应的关键环节[39]。通过获得酪蛋白过敏原T细胞表位的基本信息,基于此优化精准破坏酪蛋白T细胞表位的酶解方案,可以阻断过敏反应的启动。通过软件预测,并将高度重合的序列进行整合,最终获得16 个酪蛋白T细胞表位,汇总结果如表3所示。分别获得4 个αs1-酪蛋白T细胞表位、6 个αs2-酪蛋白T细胞表位、4 个β-酪蛋白T细胞表位和2 个κ-酪蛋白T细胞表位。范安妮等[40]通过IEDB数据库预测αs1-酪蛋白的抗原区分别为肽链的16~29、45~50、52~54、56~70、74~75、77~86、94~104、142~152、173~179和185~210位,与本研究预测结果高度相似。通过序列的位置进行分析,发现不同软件的预测结果有重叠,其中IEDB和SYFPEITHI预测的结果与NetMHC(Ⅱ)/pan重复较多,且NetMHC(Ⅱ)/pan预测的结果更加完整。

表3 酪蛋白T细胞表位预测结果Table 3 Prediction results of casein T cell epitopes
2.6 胰凝乳蛋白酶酶解产物中残留表位肽分析
基于上述实验结果,进一步通过质谱实验对胰凝乳蛋白酶酶解酪蛋白后的肽段氨基酸序列进行分析,从中选取属于酪蛋白的肽段,并分析肽段中残留的T细胞表位情况,得到的结果如表4所示。有文献表明,CD4+T表位长度各异,但其核心结合残基只有9 个[41]。通过酶解后的氨基酸序列可知,酪蛋白经过胰凝乳蛋白酶酶解后的序列仅剩余1 条大于9 个氨基酸的T细胞表位肽段LHSMKEGIHAQQK,表明酶解消除酪蛋白致敏肽段效果突出。

表4 酪蛋白酶解肽的氨基酸序列信息Table 4 Amino acid sequence of casein hydrolysates
3 结 论
酶解可以有效降低牛乳酪蛋白致敏性,其中胰凝乳蛋白酶、复合风味蛋白酶降低酪蛋白致敏原性效果最显著,而菠萝蛋白酶和胰蛋白酶降低致敏性效果较弱。分析水解度与致敏性数据,没有发现正向对应关系。酪蛋白经过胰凝乳蛋白酶酶解后,仅剩余1 条大于9 个氨基酸的T细胞表位肽段LHSMKEGIHAQQK。胰凝乳蛋白酶和复合风味蛋白酶具备用于制备低致敏酪蛋白产品的潜力,可作为进一步复合酶解的备选酶种,2 种酶解产物的肽段分子特征及理化特性有待进一步深入研究。
