前列地尔通过下调TRIM8表达激活Nrf2/ARE通路抑制心肌缺血再灌注损伤
2022-10-21郑伟民詹智晖吴钟伟刘超权陈运起李堪董
郑伟民,詹智晖,吴钟伟,刘超权,陈运起,李堪董
缺血性心脏病(ischemic heart disease,IHD)是世界范围内主要的死亡原因之一,每年死亡率为2%~3%[1]。目前的医学干预措施包括经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)或冠状动脉旁路移植术,可改善心脏的血液供应[2]。然而,心肌缺血/再灌注(ischemia/reperfusion,I/R)引起的不可逆性损伤,在充分的血运重建后,可能作为心绞痛的症状出现。超过50%的IHD病人在PCI治疗后心绞痛症状复发,大多数病人在冠状动脉旁路移植术后10~15年都有心绞痛复发[3]。因此,需要开发新的治疗药物抑制心肌I/R损伤,以改善IHD的临床治疗现状。三结构域8(tripartite motif 8,TRIM8)是TRIM蛋白家族的成员之一。研究表明,TRIM8参与脑I/R损伤的发生发展,敲除TRIM8通过抑制炎症反应和细胞凋亡,对脑I/R损伤具有神经保护作用[4]。NFE2L2基因编码的核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是氧化还原敏感的主要转录因子,对解毒和抗氧化酶基因的表达是必不可少的[5]。已有研究表明,激活Nrf2/抗氧化元件(anti-oxidant element,ARE)通路可抑制缺氧/复氧(hypoxia-reperfusion,H/R)诱导的心肌细胞凋亡和活性氧(ROS)的产生[6]。前列地尔也称为前列腺素E1(prostaglandin E1,PGE1),具有扩张血管、抑制血小板聚集的作用,可降低冠状动脉造影和PCI病人造影剂肾病的发生率[7]。已有研究表明,前列地尔在脂多糖诱导的心肌细胞损伤中发挥保护作用[8]。目前,关于前列地尔对心肌H/R损伤的作用机制尚不明确。本研究旨在探究前列地尔对心肌H/R损伤的作用及其对H/R损伤心肌细胞中TRIM8表达和Nrf2/ARE通路的影响,以期为明确前列地尔对心肌H/R损伤的作用机制及开发新的心肌H/R损伤治疗策略提供参考依据。
1 材料与方法
1.1 实验动物及材料 12只新生无特定病原体(SPF)级SD大鼠,1~3日龄,8~15 g,雌雄不限;5-BrdU购自美国MedChemExpress;前列地尔购自北京泰德制药股份有限公司;TRIM8过表达载体(oe-TRIM8)及其阴性对照(oe-NC)购自武汉金开瑞生物工程有限公司;LipofectamineTM2000购自赛默飞世尔科技(中国)有限公司;CCK-8检测试剂盒购自日本同仁化学研究所;ROS检测试剂盒购自北京索莱宝科技有限公司;D-Hank′s液和膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒购自武汉普诺赛生命科技有限公司;二喹啉甲酸(BCA)试剂盒购自北京康为世纪生物科技有限公司;α-actin、TRIM8和Nrf2抗体购自英国Abcam;醌氧化还原酶1(NQO-1)和3-磷酸甘油醛脱氢酶(GAPDH)抗体购自美国Santa Cruz Biotechnology。
1.2 原代心肌细胞的分离和培养 参考文献[9]进行原代心肌细胞的分离和培养。乳鼠颈部脱臼致死,开胸取心脏。剔除周围结缔组织,D-Hank′s液漂洗心脏,将心脏剪碎后,加入0.25%胰酶液于37 ℃培养箱中消化心脏组织,每次消化5 min,共消化8次。每次消化后取上清液,加入等量含10% 胎牛血清(FBS)的DMEM培养基终止消化。细胞过200目细胞筛,800 r/min离心5 min收集细胞沉淀。含10% FBS的DMEM培养基重悬细胞,将细胞悬液接种至培养皿中,细胞置于37 ℃、5%CO2培养箱中40 min,差速贴壁分离心肌细胞,去除成纤维细胞,重复该步骤1次。吸取未贴壁的细胞,接种于6孔板,加入0.1 mmol/L的5-BrdU抑制成纤维细胞生长,细胞置于37 ℃、5%CO2培养箱中培养48 h。第3天去除5-BrdU继续培养,细胞每2 d更换1次新鲜培养基。
1.3 台盼蓝染色法检测心肌细胞存活率 差速贴壁分离心肌细胞后,用含10%FBS的DMEM培养基重悬细胞,调整细胞密度至1×106个/mL,细胞悬液和台盼蓝溶液以9∶1比例混合均匀,细胞计数仪进行细胞计数。死细胞呈蓝色着染,活细胞无染色。细胞存活率=活细胞数/细胞总数×100%。
1.4 间接免疫荧光检测心肌细胞标志物α-actin表达 弃去心肌细胞旧培养基,磷酸盐缓冲液(PBS)清洗细胞,加入4%多聚甲醛室温固定细胞10 min。PBS清洗细胞,加入0.1%TritonX-100穿透15 min;PBS清洗细胞,5%牛血清白蛋白(BSA)室温封闭30 min。加入α-actin抗体(1∶200)4 ℃条件下孵育过夜;PBS清洗细胞,加入荧光二抗(1∶500)室温孵育1 h;PBS清洗细胞,4′-6-二胱基-2-苯基吲哚(DAPI)染核10 min;PBS清洗细胞,荧光显微镜观察。α-actin阳性呈绿色荧光,DAPI染核呈蓝色荧光。
1.5 流式细胞术检测心肌细胞标志物α-actin阳性表达率 收集心肌细胞,PBS清洗细胞后,加入4%多聚甲醛室温固定细胞10 min。PBS清洗细胞,加入0.1% TritonX-100穿透15 min;PBS清洗细胞,5%BSA室温封闭30 min。加入α-actin抗体(1∶200)4 ℃条件下孵育2 h;PBS清洗细胞,加入荧光二抗(1∶500)4 ℃条件下孵育30 min;PBS清洗并重悬细胞,上流式细胞仪检测。
1.6 心肌细胞分组给药及H/R处理 将对数期生长的心肌细胞接种于6孔板,每孔细胞量为5×105个。细胞置于37 ℃、5%CO2和95%O2培养箱中培养24 h后,将其随机分为对照组、H/R组、前列地尔组(加入40 μg/L前列地尔)、前列地尔+oe-NC组(加入40 μg/L前列地尔和转染oe-NC)和前列地尔+oe-TRIM8组(加入40 μg/L前列地尔和转染oe-TRIM8)。根据分组,按照LipofectamineTM2000说明书所示,进行oe-NC和oe-TRIM8的转染。细胞继续培养48 h后,按照分组向细胞中添加前列地尔,细胞继续培养24 h。除对照组外,其余组根据参考文献[10]所示,进行H/R处理。将细胞培养基更换为无血清和无糖的DMEM培养基,在37 ℃、94%N2、5%CO2和1%O2培养箱中培养4 h后,将细胞培养基更换为含10% FBS的DMEM培养基,细胞置于37 ℃、5%CO2和95%O2培养箱中培养6 h后,进行后续实验操作。
1.7 CCK-8检测细胞增殖
1.7.1 前列地尔给药浓度测定 将对数期生长的心肌细胞接种于96孔中,每孔细胞数量为5×103个。细胞置于37 ℃、5%CO2和95%O2培养箱中培养24 h 后,将细胞随机分为0 μg/L组、5 μg/L组、10 μg/L组、20 μg/L组、40 μg/L组、80 μg/L组和160 μg/L组,按照分组,向细胞中添加不同浓度前列地尔,细胞继续培养24 h后,向每孔细胞中加入10 μL CCK-8溶液,将96孔板置于37 ℃培养箱中孵育4 h,用酶标仪测定各孔在450 nm处的光密度(OD)值。细胞增殖(%)=不同浓度给药组OD450/0 μg/L组OD450×100%。
1.7.2 各组细胞活力检测 将对数期生长的心肌细胞接种于96孔中,每孔细胞数量为5×103个。细胞置于37 ℃、5%CO2和95%O2培养箱中培养24 h 后,参照方法1.6对心肌细胞进行处理。向每孔细胞中加入10 μL CCK-8溶液,将96孔板置于37 ℃培养箱中孵育4 h,用酶标仪测定各孔在450 nm处的光密度(OD)值。细胞增殖(%)=处理组OD450/对照组OD450×100%,或者是细胞增殖(%)=处理组OD450/H/R组OD450×100%。
1.8 流式细胞术检测细胞凋亡 按照方法1.6所示,对心肌细胞进行分组给药及H/R处理。收集心肌细胞,预冷PBS清洗细胞。向细胞沉淀中加入1×Binding buffer工作液,重悬细胞,调整细胞浓度至1×106个/mL。取100 μL细胞悬液,加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀后,室温避光孵育15 min。随后,加入400 μL 1×Binding buffer工作液,混匀后,立即用流式细胞仪检测。
1.9 流式细胞术检测ROS产生 按照方法1.6所示,对心肌细胞进行分组处理。收集心肌细胞,加入1 mL 10 μmol/L的DCFH-DA重悬细胞。细胞悬液置于37 ℃培养箱内孵育20 min。用无血清DMEM培养基清洗细胞后,加入PBS重悬细胞,上流式细胞仪检测。
1.10 蛋白质印迹法(Western Blot)检测TRIM8、Nrf2和NQO-1蛋白表达 按照方法1.6所示,对心肌细胞进行分组处理。收集心肌细胞,加入蛋白裂解液冰上裂解细胞30 min。4 ℃、12 000 r/min离心30 min,收集上清液。按照BCA试剂盒说明书所示进行上清液蛋白浓度的检测。取30 μg蛋白加入凝胶中,进行电泳操作。电泳结束后,应用湿转法将凝胶中的蛋白质转印至PVDF膜上。5%BSA室温下封闭PVDF膜3 h。随后加入TRIM8抗体(1∶2 000)、Nrf2抗体(1∶2 000)、NQO-1抗体(1∶1 000)和GAPDH抗体(1∶5 000),4 ℃条件下孵育过夜。特异性二抗(1∶5 000)室温孵育1 h。向PVDF膜均匀滴加电化学发光(ECL)试剂,暗室曝光。Image J软件进行蛋白条带的灰度分析。
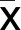
2 结 果
2.1 原代乳鼠心肌细胞的鉴定 台盼蓝染色结果显示,心肌细胞存活率为(95.67±2.13)%。间接免疫荧光和流式细胞术结果显示,心肌细胞中α-actin呈阳性表达。详见图1。
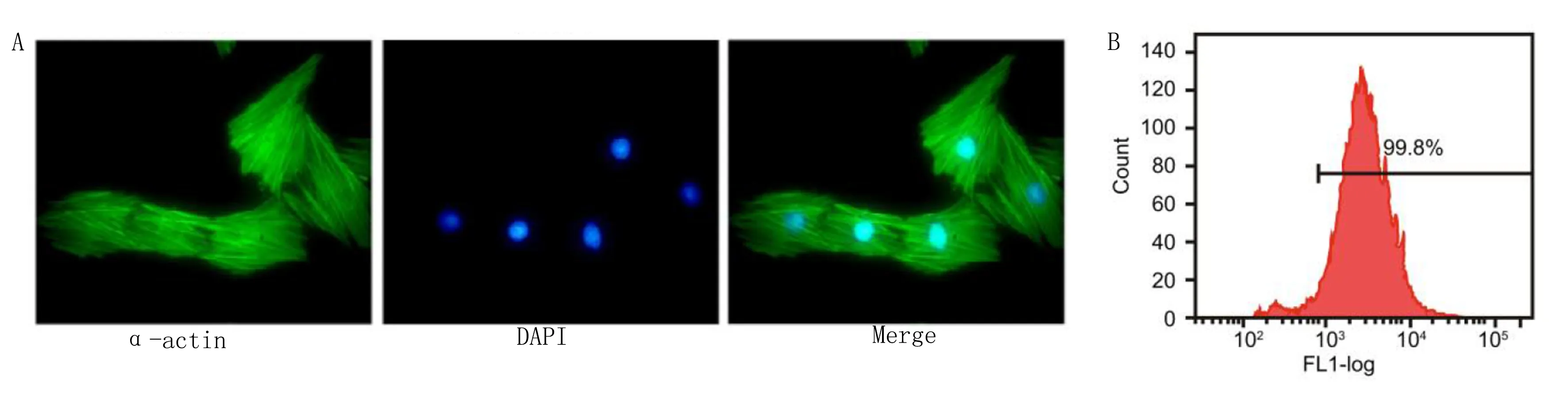
图1 原代乳鼠心肌细胞的鉴定
2.2 前列地尔对H/R心肌细胞增殖和凋亡的影响 CCK-8检测前列地尔对心肌细胞的安全浓度,结果显示,前列地尔在80 μg/L和160 μg/L浓度下可显著抑制心肌细胞增殖(P<0.05),因此,后续实验中,前列地尔使用浓度为40 μg/L。CCK-8检测前列地尔对H/R心肌细胞增殖的影响,结果显示,与对照组相比,H/R组心肌细胞增殖能力明显降低(P<0.05);与H/R组相比,前列地尔组心肌细胞增殖能力明显升高(P<0.05)。流式细胞术检测心肌细胞凋亡结果显示,与对照组相比,H/R组心肌细胞凋亡率明显升高(P<0.05);与H/R组相比,前列地尔组心肌细胞凋亡率明显降低(P<0.05)。详见图2。
与0 μg/L组比较,*P<0.05;与对照组比较,#P<0.05;与H/R组比较,&P<0.05。
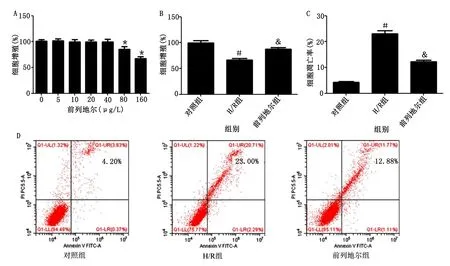
2.3 前列地尔对H/R心肌细胞ROS产生的影响 流式细胞术检测前列地尔对H/R心肌细胞ROS产生的影响,结果显示,与对照组相比,H/R组心肌细胞中ROS+细胞率明显升高(P<0.05);与H/R组相比,前列地尔组心肌细胞中ROS+细胞率明显降低(P<0.05)。详见图3。
与对照组比较,*P<0.05;与H/R组比较,#P<0.05。
2.4 前列地尔对TRIM8表达和Nrf2/ARE通路的影响 Western Blot检测前列地尔对TRIM8表达和Nrf2/ARE通路的影响,结果显示,与对照组相比,H/R组心肌细胞中TRIM8、Nrf2和NQO-1蛋白表达明显升高(P<0.05);与H/R组相比,前列地尔组心肌细胞中TRIM8蛋白表达明显降低,Nrf2和NQO-1蛋白表达明显升高(P<0.05)。详见图4。

与对照组比较,*P<0.05;与H/R组比较,#P<0.05。
2.5 过表达TRIM8部分逆转前列地尔对H/R心肌细胞增殖和凋亡的影响 Western Blot检测心肌细胞TRIM8的表达,结果显示,与H/R组相比,前列地尔组心肌细胞中TRIM8蛋白表达明显降低(P<0.05);前列地尔组和前列地尔+oe-NC组心肌细胞中TRIM8蛋白表达差异无统计学意义(P>0.05);与前列地尔+oe-NC组相比,前列地尔+oe-TRIM8组心肌细胞中TRIM8蛋白表达明显升高(P<0.05)。详见图5。
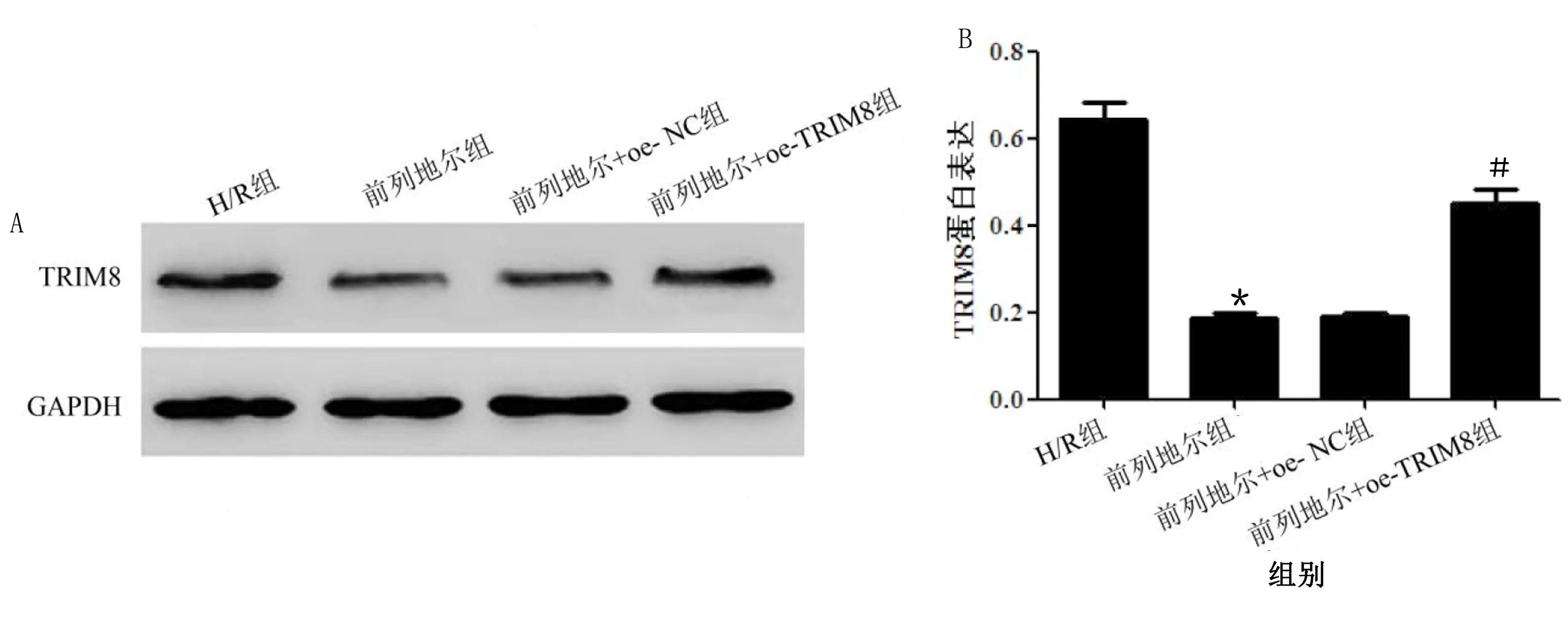
与H/R组比较,*P<0.05;与前列地尔+oe-NC组比较,#P<0.05。
CCK-8检测细胞增殖,流式细胞术检测细胞凋亡,结果显示,与H/R组相比,前列地尔组心肌细胞增殖能力明显升高(P<0.05),细胞凋亡率明显降低(P<0.05);前列地尔组和前列地尔+oe-NC组心肌细胞增殖和凋亡率差异无统计学意义(P>0.05);与前列地尔+oe-NC组相比,前列地尔+oe-TRIM8组心肌细胞增殖能力明显降低(P<0.05),细胞凋亡率明显升高(P<0.05)。详见图6。
2.6 过表达TRIM8部分逆转前列地尔对H/R心肌细胞ROS产生的影响 流式细胞术检测心肌细胞ROS的产生,结果显示,与H/R组相比,前列地尔组心肌细胞中ROS+细胞率明显降低(P<0.05);前列地尔组和前列地尔+oe-NC组ROS+细胞率比较差异无统计学意义(P>0.05);与前列地尔+oe-NC组相比,前列地尔+oe-TRIM8组心肌细胞中ROS+细胞率明显升高(P<0.05)。详见图7。
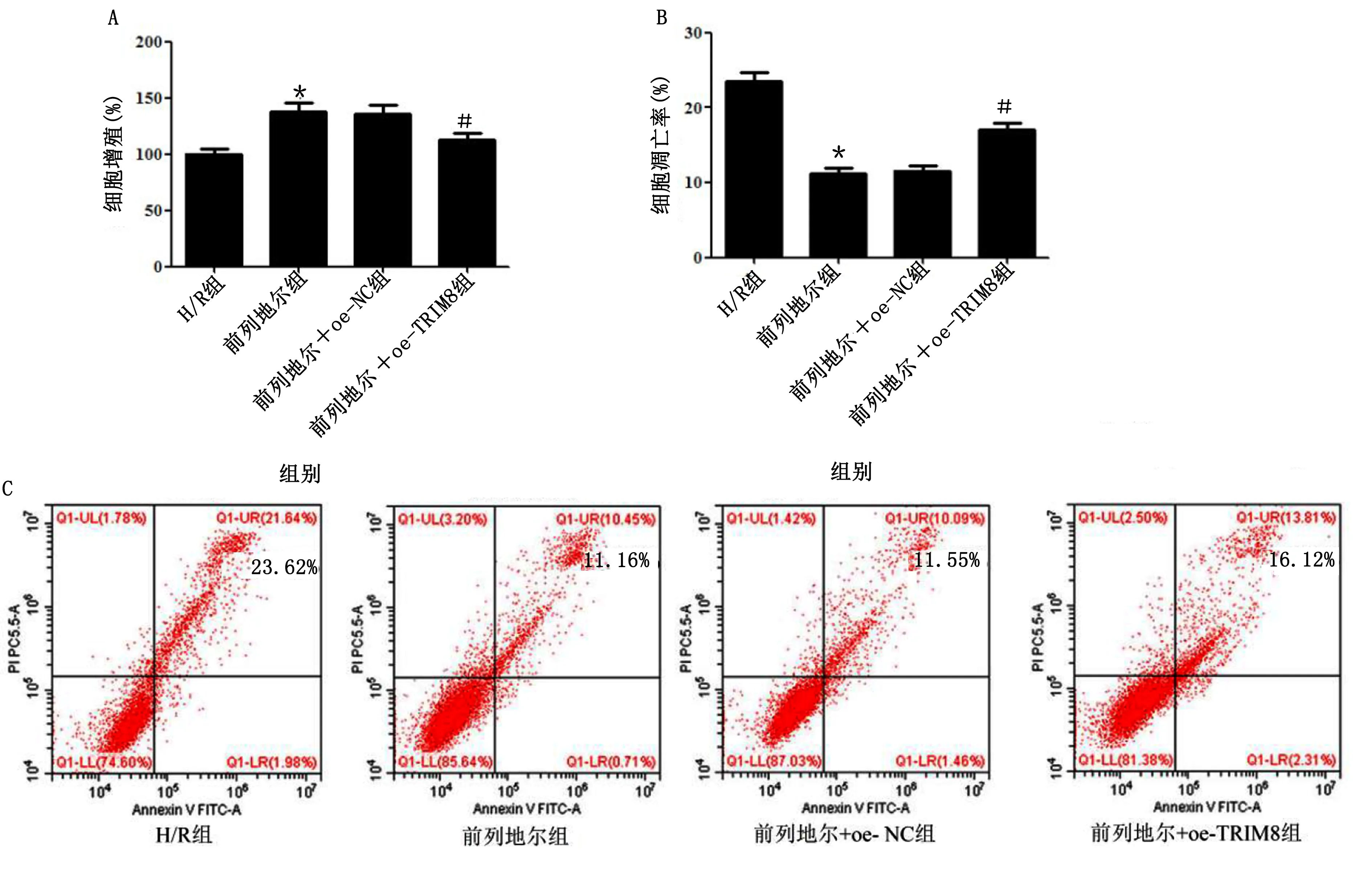
与H/R组比较,*P<0.05;与前列地尔+oe-NC组比较,#P<0.05。
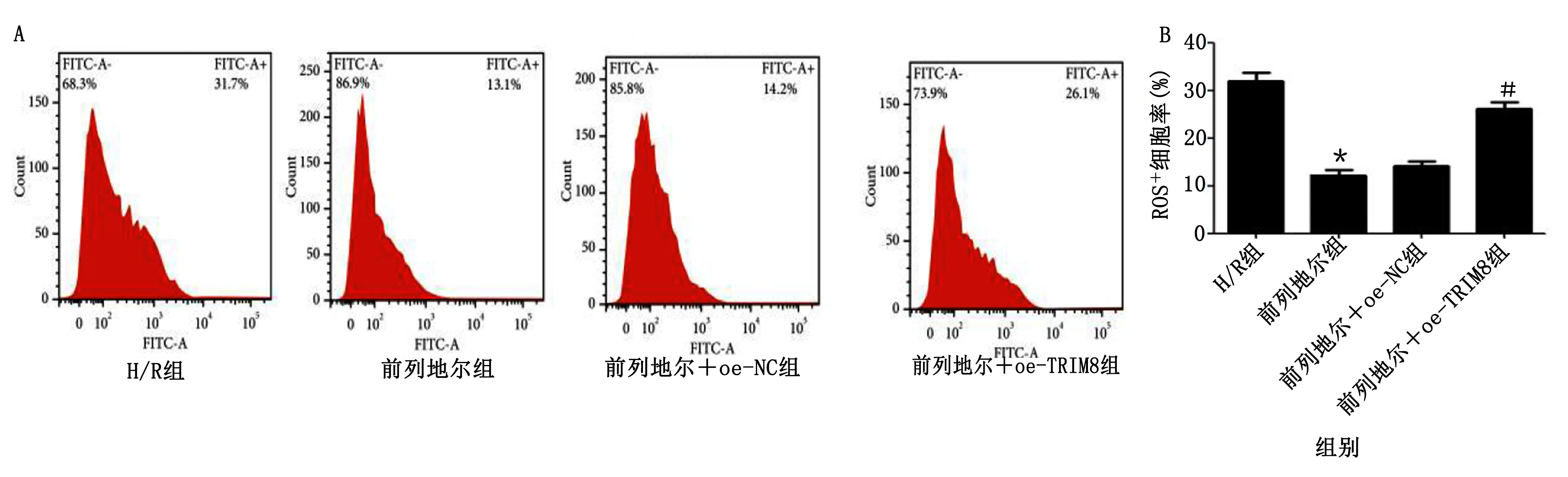
与H/R组比较,*P<0.05;与前列地尔+oe-NC组比较,#P<0.05。
2.7 过表达TRIM8部分逆转前列地尔对H/R心肌细胞Nrf2/ARE通路的影响 Western Blot检测心肌细胞中Nrf2和NQO-1的表达,结果显示,与H/R组相比,前列地尔组心肌细胞中Nrf2和NQO-1蛋白表达比较明显升高(P<0.05);前列地尔组和前列地尔+oe-NC组心肌细胞中Nrf2和NQO-1蛋白表达比较,差异均无统计学意义(P>0.05);与前列地尔+oe-NC组相比,前列地尔+oe-TRIM8组心肌细胞中Nrf2和NQO-1蛋白表达明显降低(P<0.05)。详见图8。
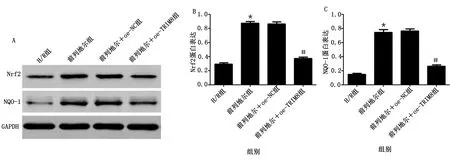
与H/R组比较,*P<0.05;与前列地尔+oe-NC组比较,#P<0.05。
3 讨 论
H/R是许多病理生理过程中细胞损伤和组织损伤的重要原因,包括缺血综合征、I/R和脑卒中[11]。早期再灌注治疗是目前急性心肌梗死病人的标准治疗方法。然而,心肌I/R会进一步加剧心肌细胞损伤,从而导致心脏疾病[12]。因此,如何减轻心肌I/R损伤是IHD治疗的关键。
心肌I/R损伤是一个非常复杂的病理生理过程,包括离子蓄积、线粒体功能障碍、ROS形成、氧化应激和炎症的激活以及细胞凋亡等[13]。靶向抑制心肌细胞凋亡和ROS的产生,对再灌注损伤具有保护作用[14]。前列地尔是广泛存在于生物体内的生物活性物质,具有改善血流动力学和血液流变学、降低血脂和血黏度、改善微循环,等作用[14]。已有证据表明,前列地尔可改善自主循环,恢复大鼠肾微血管内皮细胞H/R损伤,抑制炎症反应[15]。此外,在肝脏I/R损伤的相关研究中,前列地尔也发挥着保护作用。前列地尔通过改善肝脏微循环,减少氧化应激损伤,减少肝内中性粒细胞浸润和肝细胞凋亡,保护肝脏免受I/R损伤[16]。目前,已有相关的研究证明,前列地尔可明显抑制H/R损伤诱导的心肌细胞毒作用和细胞凋亡,在心肌细胞H/R损伤中发挥保护作用[17]。本研究以原代乳鼠心肌细胞为研究对象,探讨前列地尔对H/R处理的心肌细胞的影响,结果显示,H/R可诱导心肌细胞凋亡和ROS产生,抑制细胞增殖。而前列地尔给药处理可明显抑制H/R处理的心肌细胞凋亡和ROS产生,促进细胞增殖。本研究结果表明,前列地尔在心肌H/R损伤中发挥保护作用。
TRIM8基因位于染色体10q24.3上,广泛表达于肺、肠、肾、脑和胎盘等多种组织中。TRIM8参与细胞存活、分化、炎症、先天免疫反应、细胞凋亡等多种生物学过程[18]。已有研究表明,TRIM8参与多种组织I/R损伤过程,例如,肝脏I/R损伤后,TRIM8在肝脏中的表达上调。TRIM8基因敲除可减轻I/R引起的肝细胞损伤,抑制肝脏炎症反应和细胞凋亡[19]。TRIM8可促进心肌I/R损伤。在H/R处理的心肌细胞中,TRIM8表达上调。TRIM8基因敲除可以提高H/R刺激的心肌细胞的存活率。此外,TRIM8基因敲除抑制了ROS的产生,提高了超氧化物歧化酶和谷胱甘肽过氧化物酶的水平,抑制了心肌细胞凋亡[20]。本研究结果显示,H/R可诱导心肌细胞中TRIM8蛋白表达,而前列地尔给药处理可抑制H/R损伤心肌细胞中TRIM8蛋白表达。进一步实验结果表明,过表达TRIM8可部分逆转前列地尔对H/R损伤心肌细胞的保护作用,促进细胞凋亡和ROS产生,抑制细胞增殖。本研究结果表明,前列地尔通过上调TRIM8表达,在心肌H/R损伤中发挥保护作用。
Nrf2是保护哺乳动物细胞免受氧化和亲电应激的最重要的转录因子之一。在氧化应激条件下,Nrf2从Kelch样环氧氯丙烷相关蛋白-1(Kelch sample related protein-1,Keap1)复合体中释放出来,转移到细胞核,诱导一系列抗氧化和解毒基因的转录,最终导致防御系统的激活[21]。研究表明,H/R可诱导肝细胞中Nrf2/ARE信号通路的激活,而灯盏乙素通过进一步激活Nrf2/ARE信号通路抑制细胞凋亡和氧化应激,减轻肝细胞H/R损伤[22]。目前的证据显示,在缺氧-葡萄糖剥夺/复氧(oxygen-glucose deprivation/re-oxygenation,OGD/R)处理的神经元中,TRIM8的表达上调,Nrf2/ARE通路被激活。敲除TRIM8可以提高OGD/R暴露的神经元的存活率,减少细胞的凋亡和ROS的产生。此外,敲除TRIM8还进一步激活了Nrf2/ARE通路,沉默Nrf2明显减弱了敲低TRIM8介导的神经保护作用[23]。此外,已有相关研究证明,前列地尔通过激活Nrf2信号通路,抑制氧化应激,减轻心肌细胞凋亡,在冠状动脉微栓塞术所致心肌损伤中发挥保护作用[24]。本研究结果显示,H/R可诱导心肌细胞中Nrf2和通路下游因子NQO-1的表达上调,而前列地尔可进一步上调H/R处理的心肌细胞中Nrf2和NQO-1的表达蛋白。此外,过表达TRIM8可部分逆转前列地尔对H/R处理的心肌细胞Nrf2/ARE通路的影响,下调Nrf2和NQO-1蛋白表达。本研究结果表明,前列地尔可能通过下调TRIM8的表达激活Nrf2/ARE通路,在心肌H/R损伤中发挥保护作用。
综上所述,前列地尔可能通过下调TRIM8的表达激活Nrf2/ARE通路,抑制H/R诱导的心肌细胞凋亡和ROS产生,促进心肌细胞增殖,从而在心肌H/R损伤中发挥保护作用。本研究为明确前列地尔对心肌I/R损伤的作用机制及开发新的心肌I/R损伤治疗策略提供了新的依据。
