经导管二尖瓣瓣中瓣植入术治疗二尖瓣生物瓣毁损1例
2022-09-05薛伟浩赵琦峰张新民吴道珠陈延茹吴连拼
薛伟浩,赵琦峰,张新民,吴道珠,陈延茹,吴连拼
温州医科大学附属第二医院,浙江 温州 325027,1.心内科;2.心胸外科;3.超声科;4.DSA中心
心脏瓣膜病(valvular heart disease, VHD)是多种原因引起心脏瓣膜狭窄或关闭不全所致的心脏病,二尖瓣疾病是最常见的老年心脏瓣膜病。我国初步流行病学调查显示,60岁以上人群患病率高达13.4%,每年约有7万人接受人工瓣膜置换术[1]。由于机械瓣需要终身服用抗凝药物,出血和血栓风险大,越来越多的患者更倾向于生物瓣。而生物瓣的使用寿命不如机械瓣,存在钙化、退变的情况,最终导致毁损,表现为生物瓣僵硬、瓣膜狭窄或反流[2]。有研究[3]表明,在二尖瓣位生物瓣置换术后的10~15年的时间里,约有30%的患者会发生人工瓣的结构性瓣膜毁损。而这类患者往往一般情况较差,再次开胸手术死亡率和并发症的发生率远高于初次开胸手术[4],多数只能保守治疗。2018年,加拿大的YE等[5]首次报道了利用瓣中瓣(valve-invalve, VIV)技术,将J-Valve反向安装后经心尖植入到了一位冠脉梗阻高风险患者衰败的爱德华生物瓣中,患者术后恢复良好,认为J-Valve VIV植入技术是治疗高危生物瓣衰败患者的新方法。现报告1例使用J-Valve瓣膜经心尖VIV植入技术治疗二尖瓣生物瓣毁损的患者并总结经验。
1 病例资料
1.1 一般资料 患者,男,70岁,1个月前无明显诱因下出现活动后胸闷,步行100 m后出现气促伴双下肢乏力,无胸痛心悸,无咳嗽咯血等。既往史:7年前行二尖瓣生物瓣置换术(Edwards Perimount 27#)。术前心脏超声提示:二尖瓣生物瓣置换术后生物瓣重度狭窄[有效瓣口面积0.58 cm2,平均跨瓣压差(mean pressure gradient, MPG)=12 mmHg(1 mmHg=0.133 kPa)];左室增大(舒张末前后径73 mm),左室收缩功能明显减低(射血分数=29%);轻度肺动脉高压。主诊断为:二尖瓣置换术后人工瓣膜重度狭窄,心功能不全。该患者术前二尖瓣手术风险评估为中高危,STS评分>6 分,经过医院新技术立项并通过医院伦理委员会批准,在患者和家属知情同意后行经导管二尖瓣瓣中瓣植入术(transcathether mitral valve-in-valve implantation, TMVIV)治疗。
1.2 术前CT评估 患者生物瓣金属环内径23.5 mm,外径29.5 mm;患者AV-MV double S curve:RAO 60°/CAU 46°,此角度为二尖瓣主动脉瓣最佳观察位;患者左心室和二尖瓣轴线角度:145°;主动脉和二尖瓣轴补角:104°;术中最佳投射角度:RAO 48°/CAU 12°;左室大小:76.6 mm/65.8 mm/71.1 mm。
1.3 手术过程 手术在杂交手术室进行,患者行全麻插管,取仰卧位,透视下定位心尖部,在左侧第5 肋间腋中线做5 cm长的切口,进入胸腔悬吊心包。在心尖区缝制荷包,全身肝素化0.8~
1.0 mg/kg,激活全血凝固时间维持250~300 s。在双层荷包中央进行穿刺,置入Cordis导丝通过二尖瓣生物瓣进入左心房,见图1A。置入6F猪尾导管,交换预先塑形Lunderquist超硬支撑导丝,在心尖和左心房跨二尖瓣生物瓣形成支撑轨道,采用24F大鞘扩张心尖穿刺点后退出,见图1B、图1C、图1D。在冰水中反向安装25 mm J-Valve瓣膜,通过超硬导丝置入装有瓣膜的输送器(27F),调整输送鞘和原生物瓣膜的同轴性,在左心室内展开定位件后向左心房方向推送,使3个定位件分别落座于生物瓣3个瓣脚之间。调整输送器进入左心房的合适深度(一般为介入瓣膜支架最大高度的10%~20%),使介入瓣膜最高点超过生物瓣瓣环平面半个菱形格左右。定位后在快速起搏下使介入瓣膜平稳展开,见图1E、图1F。确定位置正常后释放瓣膜,逐步退出输送器。经食管超声心动图(trans esophageal echocardiography, TEE)和左心室造影检查,确定瓣膜位置、功能正常,有少量瓣周漏。置入微创球囊(26 mm)至原生物瓣瓣环水平进行后扩,瓣周漏消失,撤出导丝,打结止血并放置胸腔引流管,逐层缝合胸壁切口。
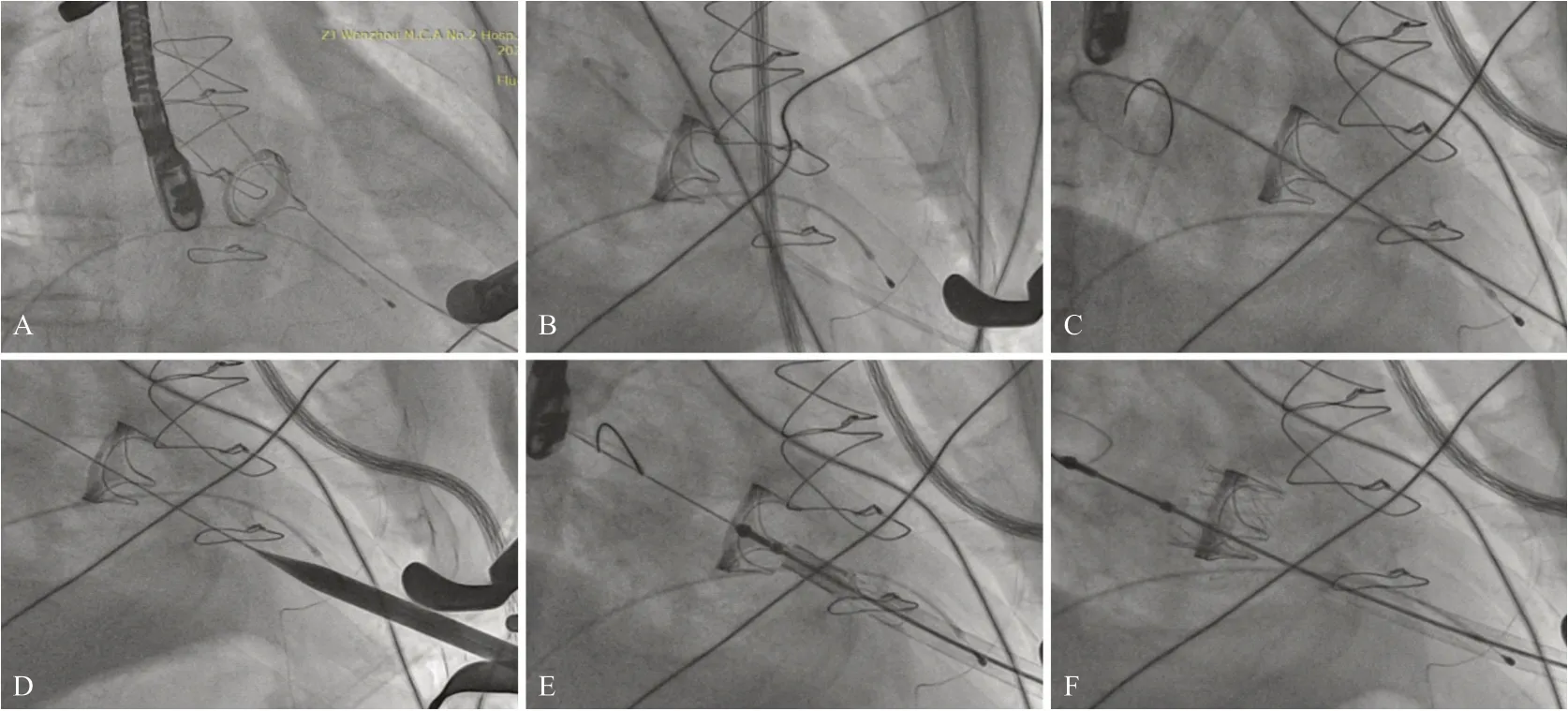
图1 TMVIV术操作过程
TEE显示J-Valve瓣架位置良好,瓣叶开放活动度正常,左房内压力为16 mmHg,较术前(44 mmHg)明显下降;TEE示舒张期前向流通畅,峰值流速及平均压差较术前明显降低,未见瓣周漏,见图2;次日复查TTE:MPG=4 mmHg(术前10 mmHg),患者临床症状缓解,复查胸片较术前改善。
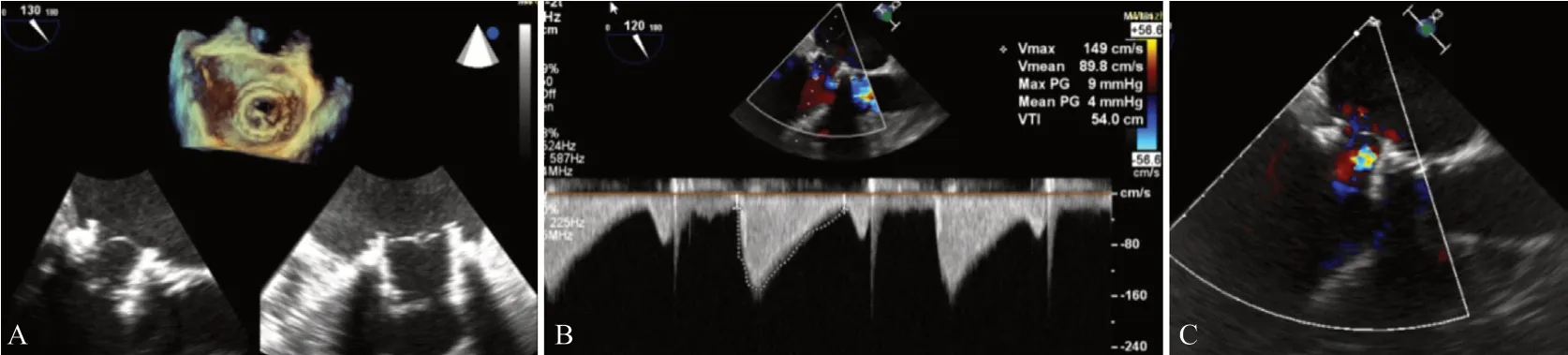
图2 TMVIV术后TEE检查结果
2 讨论
自法国CRIBIER等[6]于2002 年完成世界首例经导管主动脉瓣膜置换术(transcatheter aortic valve replacement, TAVR)以来,瓣膜病介入治疗迅速发展。德国的WENAWESER等[7]于2007年报道第1 例经导管主动脉瓣VIV手术,开启了治疗生物瓣衰败的VIV技术的新时代。2009年加拿大的CHEUNG等[8]报道了世界首例成功的TMVIV;2019年,中国首都医科大学附属北京安贞医院张海波等[2]专家完成首例TMVIV,成为国内二尖瓣VIV治疗的开端,该中心报道9例应用经导管J-Valve TMVIV临床效果,成功率100%,术后均无严重并发症,平均跨瓣压差(8±2)mmHg,可以认为J-Valve VIV技术在治疗二尖瓣生物瓣衰败中临床效果良好,值得进一步研究和推广。
经心尖途径(trans-apical approach, TA)和经房间隔途径(trans-septal approach, TS)是TMVIV的主要途径,TS从股静脉路入,创伤小,可在局麻条件下手术,缺点是路径相对更长,操作增加,同轴性不好,且造成房间隔缺损,部分患者因此需要行房间隔缺损封堵术[9]。与TS相比,TA路径短,左室心尖与二尖瓣环平面更近些,输送器能以较好的同轴性插入到瓣环平面内,无需过多操作,比如调弯。因此,术者利用距离的优势可以更好地调节介入瓣放置的位置和深度,使发生介入瓣移位和左室流出道梗阻等并发症的概率大大减低[10]。
合适大小的支架瓣膜非常重要。若尺寸过大,会造成瓣叶挤压变形、膨胀不全,从而影响功能和寿命甚至早期血栓形成;若尺寸太小,可能导致定位不良出现瓣膜移位以及瓣周漏[11]。由于衰败的生物瓣瓣叶多有钙化和血管翳的影响,会使实际内径偏小。而猪瓣和牛瓣的衰败模式不同,猪瓣多表现为钙化而牛瓣多是硬化导致狭窄[12]。本例患者生物瓣型号为Edwards 27#,但具体是猪瓣还是牛瓣并不清楚(前者真实内径为23 mm,后者真实内径25 mm)。术前CT测量的内径为23.5 mm,文献推荐介入瓣膜大小应比原生物瓣膜内径大10%[13],但国内TMVIV经验较为丰富的专家认为,在使用J-Valve时无需按此要求,选择等大或者略大J-Valve就可以了[14]。其根本原因就是定位件的存在,三个定位件牢固地卡在生物瓣瓣脚之间,因此不必担心收缩期介入瓣膜向左房发生移位的风险。最终我们选择25 mm的J-Valve瓣膜(比原生物瓣内径大6.4%)。
另外,在透视下清晰的生物瓣缝合环的标志对于术中介入瓣理想的释放位置也格外重要,理想位置可以保证介入瓣膜的安全和最佳的血流动力学表现[15]。但某些生物瓣仅框架或瓣脚标志可见,这时识别瓣环就比较困难,需要了解生物瓣框架/瓣脚与缝合环的关系。本例患者的生物瓣缝合环/瓣脚在透视下显影较为清楚,在最佳投照角度下,利用J-Valve展开的三个定位件插入到三个瓣脚之间,同时在透视和TEE的监护下将介入瓣瓣架放置于过缝合环上半个菱形格左右的高度即为理想位置。术后3D TEE也证明其突出于左房面的高度大致为瓣架总高度的10%~20%,血流动力学良好,后扩后无明显瓣周漏。
左室流出道梗阻(left ventricular outflow tract obstruction, LVOTO)和支架瓣膜移位是手术的主要风险。由于左心室压力远高于左心房,部分瓣膜定位后出现左心房侧移位,而本例选用J-Valve瓣膜,其短支架和定位件经过二尖瓣生物瓣瓣脚的交叉结合,可预防支架瓣膜移位,其独有的特性极大减少了该并发症的发生。另一方面,介入瓣展开后会推挤原生物瓣瓣叶或自体瓣叶,这就有可能造成LVOTO;同时,介入瓣瓣架网口被衰败生物瓣瓣叶部分或全部遮盖,血液将无法通过网孔进入左心室,因此心包瓣膜(瓣叶长)发生LVOTO的风险高于猪瓣(瓣叶短)[16]。本例应用的J-Valve瓣膜左室面的瓣架高度并不唯一,在三个定位件连接处头端有三个凹槽,其中之一正朝向左室流出道;同时类似于在TAVR中的保护冠脉作用,定位件可以将衰败的生物瓣瓣叶夹持在其与J-Valve瓣架之间,进一步降低了LVOTO的风险。
该病例为高龄、高危的二尖瓣生物瓣衰败患者,再次行开胸换瓣的手术风险极高,该患者在经心尖J-Valve介入瓣膜VIV治疗后获得良好的临床效果,因此J-Valve的TMVIV技术为二尖瓣生物瓣衰败患者提供了一个新的治疗手段。
