多线靶向治疗联合减瘤术、介入疗法治疗晚期胃肠外间质瘤1例
2022-09-05陈珊蔡一奇张琳烨张晓珂宋文品王鹏飞
陈珊,蔡一奇,张琳烨,张晓珂,宋文品,王鹏飞
1.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035;2.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;3.温州医科大学 第二临床医学院,浙江 温州 325035
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是最常见的消化道间叶源性肿瘤,主要发生于消化道,仅少部分发生于肝、肠系膜、腹膜、腹膜后等其他部位[1],称为胃肠外间质瘤(extragastrointestinal stromal tumor, EGIST),恶性程度较高。根治性手术切除联合化疗是其主要治疗手段,但部分患者仍会出现复发及转移[2]。现笔者报告晚期子宫直肠间隙内GIST 1例,根治性手术后采用多线靶向药物,联合多次减瘤术、介入术治疗,肿瘤控制较好,并结合该病例复习国内外文献如下。
1 病例资料
患者,女,48岁,因“确诊胃肠间质瘤11年,复发9年,加重1个月”入院。就诊经过见图1。既往11年前因“下腹坠胀3个月余,排便习惯改变近1个月”至上海瑞金医院就诊,PET-CT提示:子宫直肠间隙内见巨大软组织密度灶,与子宫颈关系紧密,直径7.8 cm×7.6 cm×7.4 cm,代谢异常增高,考虑恶性可能大。经妇科、外科会诊后,行细针穿刺病理学检查结果示GIST,梭形细胞型,高危度,瘤细胞免疫组化结果:CD117(+)、DOG1(+)、Ki67 (20%+)。遂予伊马替尼术前新辅助治疗至肿块缩小至5 cm后,于2010年10月行“盆腔肿物切除+部分阴道后壁切除+末端回肠造口术”,术后予伊马替尼300 mg/d治疗。2012年10月复查PET-CT:子宫后方与直肠间多发软组织肿块影,代谢增高,考虑恶性病变可能大。再次行肿块穿刺病理示:GIST,考虑复发。遂伊马替尼增量至400 mg po qd治疗至2015年12月,持续5年余。2016年1月复查肿瘤进展,盆腔肿瘤大小约3.8 cm×2.6 cm,改二线舒尼替尼37.5mg po qd新辅助化疗后于2月行“盆腔胃肠间质瘤减瘤术+Dixon术+末端回肠造口术”,术后继续舒尼替尼37.5 mg po qd治疗,定期评估肿瘤疾病稳定(stable disease, SD)。靶向治疗期间患者出现手足综合征、高血压病、白细胞减少、血小板减少、睡眠障碍等不良反应,对症治疗后好转。2017年5月复查MR提示:直肠右侧占位灶(新发),评估疾病进展(progressive disease, PD),6月行“经阴道盆腔肿瘤切除术”,术后继续舒尼替尼37.5 mg po qd治疗。2020年5月复查MR示:直肠周围间隙见团块状异常信号影,大小4.6 cm×4.0 cm,遂行“Miles+盆腔间质瘤切除+部分阴道切除+子宫肌瘤切除+右侧卵巢囊肿切除”,肿瘤体积明显减小,见图2。术后病理提示符合GIST转移,基因检测示ckit 11 exon 11 c.1648-1672del PK550fs,后予伊马替尼400 mg po qd治疗。9月复查PET-CT提示:子宫直肠间隙内GIST术后,盆腔多发结节伴代谢增高,考虑肿瘤复发转移,且病灶累及右侧肛提肌;肝脏多发高代谢结节,全身多发骨及肌肉高代谢结节,均考虑转移,见图3。12月CT引导下行“肝S6段病损微波消融术”,过程顺利,肝转移灶略有缩小,术后予加强保肝支持治疗,微波消融术前后对比见图4。
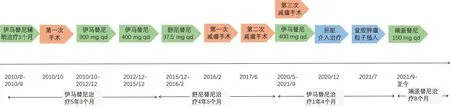
图1 患者就诊经过
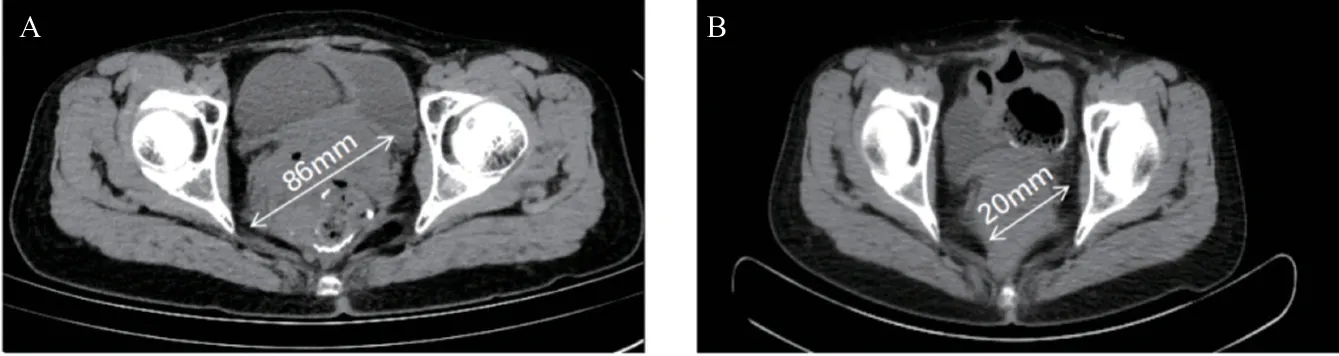
图2 第3次减瘤术前后盆腔CT图像对比
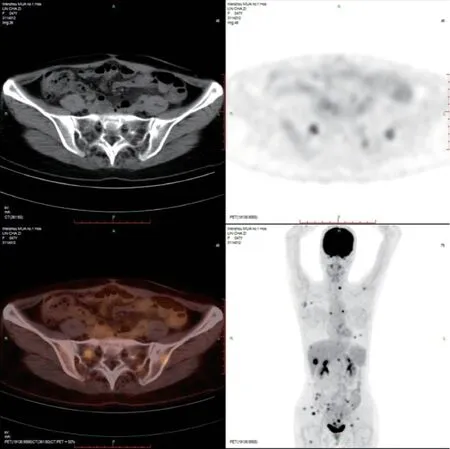
图3 全身PET-CT影像
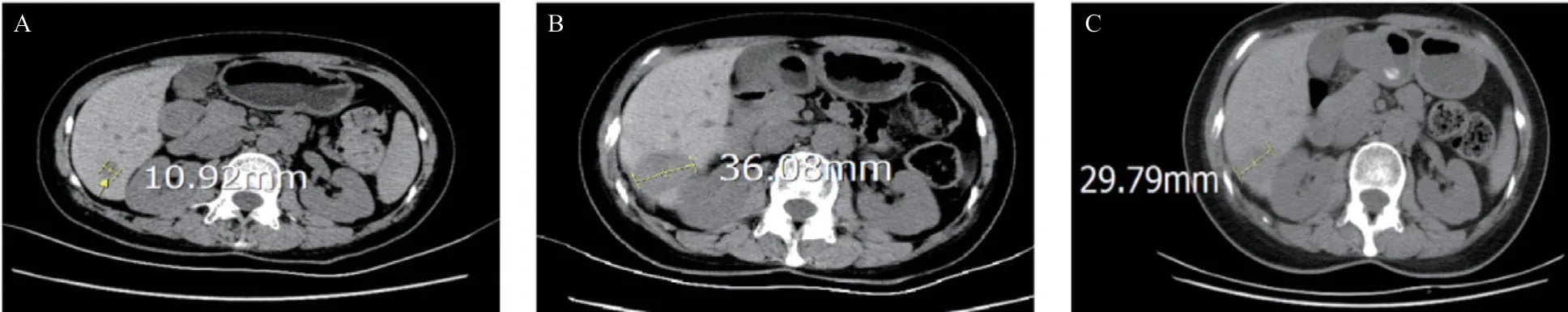
图4 肝脏微波消融术治疗前后腹部CT图像对比
患者1个月前盆腔MRI提示肿瘤体积较前增大,盆腔积液,骨盆多骨及股骨多发小结节。经医院多学科诊疗讨论会讨论后收治入院,拟诊断为“胃肠外间质细胞瘤术后、肝继发恶性肿瘤、盆腔继发恶性肿瘤”于2021年7月13日行“盆腔结节碘125粒子植入术”:局麻后用18 G穿刺入盆腔内病灶,扫描CT证实针尖到位后共植入碘125粒子5枚,过程顺利,患者无诉明显不适,术后1 d予以出院。粒子植入术前后对比见图5。2021年9月MRI提示:盆腔多发结节,大小2.3 cm×1.4 cm,宫颈多发小结节,股骨多发小结节,肿瘤恶性转移可能,ECOG评分4分,改用四线药物瑞派替尼150 mg po qd治疗至今。服药以来规律门诊复查,末次门诊日期2022年5月20日,体检示腹部正常,评估为瑞派替尼治疗后SD。
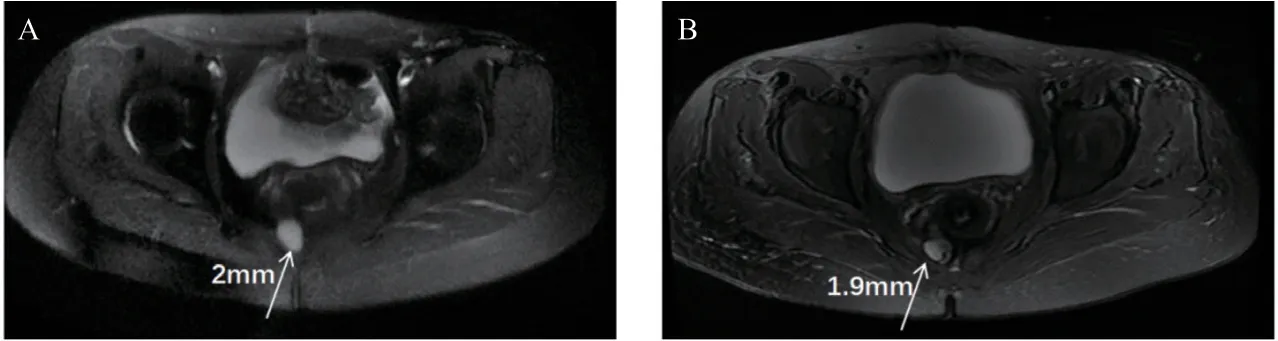
图5 植入粒子治疗前后盆腔MRI图像对比
2 讨论
GIST 是源于胃肠道肌间神经丛Cajal 细胞(interstitial cells of Cajal, ICC)或其干细胞的消化道间叶源性肿瘤[3],与KIT和PPDGFRA突变有关[4],其最常见的发病部位为胃(占51%),其次是小肠(占36%)。EGIST是起源于腹膜后、网膜等软组织的间质瘤,发病率仅为5%~10%,多见于中老年男性,中位发病年龄53岁[5]。直径小于5 cm的小间质瘤临床症状较为隐匿,而肿瘤直径大的间质瘤患者可出现肠梗阻、腹胀、腹痛[6],肿瘤破裂还可出现剧烈腹痛等急腹症表现[7],但消化道出血等典型的胃肠道症状较少[8]。其免疫表型与GIST类似,但其肿瘤直径、核分裂象、危险度分级均提示更高的恶性程度[9],伴有淋巴结浸润者预后较差[10]。本例患者间质瘤原发部位为直肠子宫间隙,属EGIST,相似报道较少。患者既往因下腹坠胀,排便习惯改变就诊,病理诊断GIST,排除溃疡性直肠炎、直肠癌、功能性肠病等消化道疾病,诊断明确。
根治性手术切除是治疗原发肿瘤的最有效手段,EGIST就诊时往往体积较大,手术应警惕瘤体破裂。淋巴结转移少见,故不常规行淋巴结清扫术[10]。术前肿瘤体积较大者可采用化疗药物新辅助治疗以提高手术成功率,术后根据基因分型采用特异性靶向药物治疗。复发转移的晚期肿瘤患者,靶向药物联合手术是最佳的治疗模式,尤其对特殊部位的肿瘤(如直肠),药物治疗可减少术中重要脏器损伤,提高获益率。根据靶向药物控制情况及肿瘤进展是否稳定决定手术方式。一般认为,靶向药物治疗后肿瘤可出现局部缓解、局部进展和广泛转移等几种形式。RAUT等[11]发现对于局部缓解的患者,积极手术治疗可获得较好临床获益。局部进展是否选用手术干预目前尚无定论,但对于广泛转移者,不建议手术治疗[12]。曾有文献报道原发性肝脏合并胰腺EGIST 1例,行胰腺粒子植入及肝脏微波消融联合伊马替尼治疗,患者获无进展生存期1年余,提示对无法采用手术治疗的患者,介入手术可减少肿瘤负荷,延缓疾病进展。本例患者2010年病理检查示高危EGIST,肿瘤体积大于5 cm,故采用伊马替尼术前新辅助治疗后行根治性肿瘤切除术,术后一线伊马替尼治疗,获2年无病生存期。此后患者多次盆腔肿瘤复发转移,予术前新辅助治疗后积极行数次减瘤术治疗,定期评估肿瘤SD。肿瘤全身多处转移后,不采取手术干预,予肝转移灶病损微波消融及盆腔粒子植入术等介入手段治疗,患者症状稍有改善,肿瘤体积稍有缩小。因此我们认为,对于晚期EGIST患者,靶向治疗后局部进展者,可积极联合减瘤术治疗,当无法手术时,可考虑介入疗法治疗以降低肿瘤负荷,增加药物治疗效果。
用药方面,由于EGIST发病率较低,目前尚无针对此类肿瘤的治疗方案,故EGIST的靶向药物主要参照GIST。根据NIH建议,伊马替尼为目前GIST治疗的一线用药[13],可阻断酪氨酸激酶通路,适用于术前新辅助治疗、术后辅助治疗及无法手术患者的姑息治疗。肝EGIST患者可获得2年无病生存期[14-15],但一项回顾性队列研究发现仍有32%的患者出现复发转移[16],可能与继发基因突变有关。舒尼替尼为一线用药治疗无效或出现复发转移后的首选药物[17],外显子11突变的患者中位无病生存期为5.6个月[18],但其不良反应较多,一项随机对照研究发现83%实验组患者出现药物相关不良反应,如贫血、白细胞减少、中性粒细胞减少等。瑞戈非尼为目前三线用药,但药物相关不良反应发生率高达98%。瑞派替尼是广谱KIT及PDGFR双开关控制抑制剂,适用于对上述三种药物耐药的晚期GIST患者,三期临床试验证实瑞派替尼四线用药中位无复发生存期为6.3个月[19]。2020版中国《CSCO胃肠间质瘤临床指南》将瑞派替尼作为晚期GIST的四线治疗方案的第一类推荐。此外,一期临床研究表明瑞派替尼在二线、三线治疗中使用的无进展生存期分别能达到10.7 个月和8.3个月,高于四线治疗所获得的5.5个月[20];另一项国际多中心III期INTRIGUE研究数据显示瑞派替尼对比舒尼替尼两者无进展生存期无显著差异,但在客观缓解率和安全性上更具优势[21],且瑞派替尼已被纳入2021版《中国临床肿瘤学会(CSCO)GIST诊疗指南》转移性GIST二线治疗的III级推荐,上述两项研究结果均提示瑞派替尼早期用药可使患者获益。本例患者使用伊马替尼获无病生存期2年,与文献报道相似,后因肿瘤进展增量治疗,持续5年余。患者改用舒尼替尼治疗4年余,期间出现较严重不良反应,与文献报道相似。考虑患者ECOG体力状况评分高达4分,故选择瑞派替尼作为三线用药,治疗期间患者整体情况较前好转,现已用药8个月余。我们希望未来积极开展更多瑞派替尼早期用药的临床研究,以增加晚期GIST患者无病进展期和总体生存期。
