吡非尼酮与仑伐替尼联合应用对人胆管癌细胞系HuCCT1的增殖克隆抑制作用及其机制
2022-09-02李丽萍蒲诗云任常谕周永杰周后凤
李丽萍,蒲诗云,任常谕,周永杰,周后凤
1 成都市第五人民医院药剂科,成都 611130;2 四川大学华西医院卫生部移植工程与移植免疫重点实验室病理研究室
胆管癌是一种原发性胆道恶性肿瘤,近年发 病率呈逐渐上升趋势,其发病隐匿,临床表现一般不明显,大多数患者发现时已进入晚期阶段,手术切除根治难度大[1]。放化疗成是胆管癌患者主要后期治疗手段,但临床上缺乏有效的化疗、靶向治疗策略。仑伐替尼(Len)是一种新型口服的多靶点酪氨酸激酶抑制剂。近年肝癌、胆管癌等难治性肿瘤的临床前期应用研究显示,Len 具有一定的肿瘤生长抑制能力[2]。吡非尼酮(PFD)是一种TGFβ 通路的靶向药,临床上主要用于治疗肺纤维化。本团队前期研究证实,PFD 对胆管癌细胞具有抑制作用[3]。药效增敏和克服耐药是提高肿瘤靶向治疗效果的主要策略之一,PFD 是否可以增敏Len 对胆管癌的抑制能力,目前还不清楚。2021 年3—9 月,我们观察了PFD 联合Len 对人胆管癌HuCCT1 细胞增殖、克隆形成的影响,并探讨其可能机制。
1 材料与方法
1.1 细胞系、主要试剂及仪器 人胆管癌细胞系HuCCT1 细胞购自中国科学院细胞库。PFD(批号HY-B0673)、Len(批号HY-10981)以及巴佛洛霉素A1(Baf.A1,批号HY-100558)均购自MCE生物公司,RPMI1640 细胞培养基和胎牛血清购自Hyclone 公司,细胞转染试剂Lipofectamine 2000 购自Thermo 公 司,CCK-8 检 测试剂 盒、DAPI 染 色液均购自上海碧云天生物技术有限公司,GAPDH抗体购自成都正能生物技术有限责任公司,p-AMPKα(Thr172)和p-S6(Ser235/236)抗体购自Cell Signaling Technology 公 司,AMPKα、p-mTOR(Ser2448)、mTOR 和RPS6/S6 抗体均购自武汉三鹰生物技术有限公司。CO2恒温培养箱为新加坡ESCO 公司,多功能酶标仪为美国BioTek 公司,胶成像系统为美国Bio-Rad 公司,倒置荧光显微镜(Eclipse 80i 荧光显微镜)为日本Nikon 公司,配备CCD 高清相机。
1.2 HuCCT1 细胞培养 HuCCT1细胞培养于含有10%胎牛血清的RPMI1640培养基中,置于37℃含5%CO2的细胞培养箱。细胞转染用Lipofectamine 2000转染试剂,转染过程严格按照说明书进行操作。
1.3 HuCCT1 细胞分组及PFD、Len 给予方法和细胞增殖活力测算 HuCCT1 细胞接种至96 孔板,每孔3 000 细胞,细胞培养24 h,后进行分组及药物处理。PFD 联合浓度梯度的Len 分组:对照组加入DMSO,PFD 为0.5 mmol/L 的PFD,PFD 联合Len 组分别为0.5 mmol/L 的PFD 联合不同浓度的Len(2、5、10、20µmol/L)。Len 联合浓度梯度的PFD 分组:对 照 组 加 入DMSO,Len 单 药 组 为10 µmol/L的Len,Len 联合PFD 组分别为10 µmol/L 的Len 联合不同浓度的PFD(0.1、0.25、0.5、1 mmol/L)。药物处理48 h,弃去培养基,加入CCK-8 稀释液,然后避光37 ℃孵育2 h,利用酶标仪检测反应液450 nm处的OD值。计算细胞增殖活力,细胞增殖活力(%)=(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD值)×100%。
1.4 HuCCT1 细胞分组及PFD、Len 给予方法和细胞克隆形成数目观察 HuCCT1 细胞接种至6 孔板中,每孔2 000 细胞,细胞培养24 h,后进行分组及药物处理。对照组加入DMSO,PFD 单药组为0.5 mmol/L 的PFD,Len 单 药 组 为2 µmol/L的Len,联 合 组 为0.25 mmol/L 的PFD 联 合2 µmol/L 的Len。培养7 d,弃去培养基,PBS 溶液清洗3 次,甲醇固定20 min,结晶紫染色液染色30 min,PBS 清洗至背景干净,然后拍照记录,并记录克隆形成数目。
1.5 HuCCT1 细胞分组及PFD、Len 给予方法和细胞自噬能力观察 HuCCT1 细胞接种至含有玻璃片的24孔板中。细胞过夜培养后,根据转染试剂说明书,转染GFP-LC3 表达质粒。转染24 h 后,后进行分组及药物处理。对照组加入DMSO,PFD 单药组为0.5 mmol/L 的PFD,Len 单 药 组 为10 µmol/L的Len,联合组为0.5 mmol/L的PFD 联合10µmol/L的Len。药物处理48 h 后,弃去培养基,PBS 清洗3次,4%多聚甲醛固定,然后利用DAPI 溶液染色5 min。将染色后的细胞培养玻片固定于载玻片。荧光显微镜观察细胞,并进行拍照记录。随机选取5 个细胞统计分析GFP-LC3 阳性自噬体数目,以此指示细胞自噬水平。
1.6 HuCCT1 细 胞 分 组 及PFD、Len 给 予 方 法和细胞p-AMPK、p-mTOR、p-S6、LC3B-Ⅱ蛋白检测 HuCCT1细胞接种至6孔板中,每孔1×105细胞,细胞培养24 h,后进行分组及药物处理。对照组加入DMSO,PFD 单药组为0.5 mmol/L 的PFD,Len 单药组为10 µmol/L 的Len,联合组为0.5 mmol/L 的PFD 联合10 µmol/L 的Len。细胞经药物处理48 h后,预冷PBS 清洗3 次,冰浴环境下细胞裂解液裂解30 min。在4 ℃环境下,以12 000 r/min 的转速离心15 min,收集上清液。BCA 法测定蛋白浓度后,SDSPAGE电泳,转膜。含有5%BSA的TBST溶液室温封闭1 h,4 ℃孵育一抗过夜。室温孵育二抗1 h。ECL显色试剂盒显影曝光。采用ImageJ 软件分析目的蛋白灰度值,以p-AMPK/AMPK、p-mTOR/mTOR、p-S6/S6的比值分别表示AMPK、mTOR、S6蛋白的磷酸化水平,以LC3-Ⅱ/LC3-Ⅰ的比值表示LC3-Ⅱ的表达水平,以Baf.A1处理时LC3-Ⅱ的表达水平评估细胞自噬水平。
1.7 统计学方法 采用GraphPad Prism 8.0统计软件。符合正态分布的计量资料以±s表示,两组间比较采用t检验,多组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖活力比较 0 µmol/L Len +0.5 mmol/L PFD、2µmol/L Len+ 0.5 mmol/L PFD、5 µmol/L Len + 0.5 mmol/L PFD、10 µmol/L Len +0.5 mmol/L PFD、20µmol/L Len+ 0.5 mmol/L PFD各处理组及空白对照组的细胞增殖活力分别为(95.30 ± 4.50)%、(61.18 ± 8.85)%、(40.79 ±8.12)% 、(25.05 ± 3.99)% 、(9.65 ± 4.08)% 、(100.00± 0)%,各联合组与Len 单药组比较,P均<0.05。 10 µmol/L Len + 0 mmol/L PFD、10µmol/L Len+ 0.1 mmol/L PFD、10µmol/L Len+0.25 mmol/L PFD、10 µmol/L Len + 0.5 mmol/L PFD、10µmol/L Len+1 mmol/L PFD 各处理组及空白对照组细胞增殖活力分别为(61.97 ± 4.91)%、(45.67 ± 2.71)%、(34.21 ± 4.10)%、(26.50 ±3.98)%、(12.48 ± 4.74)%、(100.00 ± 0)%,PFD 单药组与空白对照组比较,各联合组与PFD 单药组比较,P均<0.05。
2.2 各组细胞克隆形成数目比较 联合组、PFD单药组、Len 单药组、对照组细胞克隆形成数目分别为(43.00 ± 11.53)、(1 424.00 ± 50.21)、(870.00 ±76.54)、(1 488.66 ± 158.85)个,联合组与对照组、单药组比较,P均<0.05。
2.3 各组细胞自噬体数目及LC3B-Ⅱ蛋白相对表达量比较 联合组、PFD 单药组、Len 单药组、对照组自噬体数目分别为(52.60 ± 10.11)、(20.20 ±4.49)、(7.40 ± 3.21)、(7.00 ± 2.92)个,联合组与对照组、单药组比较,P均<0.05。细胞LC3B-Ⅱ蛋白相对表达量比较见表1。
表1 各组细胞LC3B-Ⅱ蛋白相对表达量比较(±s)

表1 各组细胞LC3B-Ⅱ蛋白相对表达量比较(±s)
注:与对照组比较,*P<0.05;与PFD 单药组比较,ΔP<0.05;与Len单药组比较,#P<0.05。
组别联合组PFD单药组Len单药组对照组Baf.A1(-)0.56±0.02*Δ#0.12±0.03 0.17±0.02 0.11±0.03 Baf.A1(+)0.94±0.03*Δ#0.76±0.06*0.57±0.04 0.57±0.05
2.4 各组细胞p-AMPK、p-mTOR、p-S6 蛋白相对表达量比较 细胞p-AMPK、p-mTOR、p-S6 蛋白相对表达量比较见表2。
表2 各组细胞p-AMPK、p-mTOR、p-S6蛋白相对表达量比较(±s)
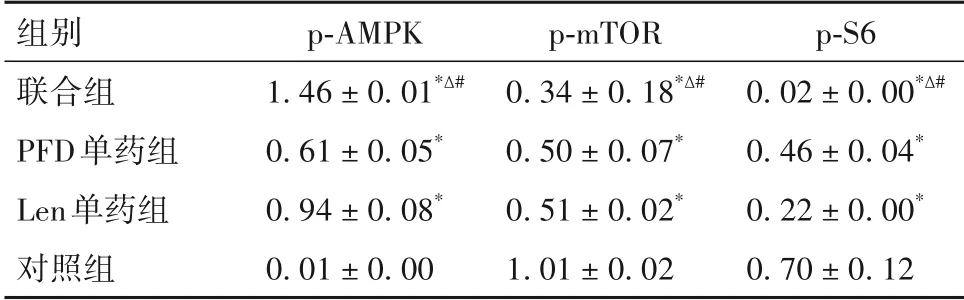
表2 各组细胞p-AMPK、p-mTOR、p-S6蛋白相对表达量比较(±s)
注:与对照组比较,*P<0.05;与PFD 单药组比较,ΔP<0.05;与Len单药组比较,#P<0.05。
组别联合组PFD单药组Len单药组对照组p-AMPK 1.46±0.01*Δ#0.61±0.05*0.94±0.08*0.01±0.00 p-mTOR 0.34±0.18*Δ#0.50±0.07*0.51±0.02*1.01±0.02 p-S6 0.02±0.00*Δ#0.46±0.04*0.22±0.00*0.70±0.12
3 讨论
胆管癌是肝胆系统中常见的恶性肿瘤,近年国内外的胆管癌发病率呈现逐渐上升的趋势。由于胆管癌发病隐匿,患者确诊往往处于晚期,所以手术根治的概率较低,目前患者5 年生存率不到5%[1]。除手术之外,基于小分子化合物的靶向治疗是另一种重要的治疗手段。但是,目前尚无有效的针对胆管癌的靶向药物。因此,寻找新型靶向药物和开发有效的药物治疗策略将有助于提高胆管癌的治疗效果。药效增敏是提高抗肿瘤药物抑癌能力的主要途径,其中不同作用靶点的药物间的联合用药是主要策略之一。
Len 是一种多靶点的酪氨酸激酶抑制剂,其于2018 年被美国食品药品监督管理局批准用于治疗分化型甲状腺癌。在肝细胞癌方面,Len 被证实具有一定的治疗效果,并被推荐用于不可切除肝细胞癌的一线治疗[4]。近期研究[5-6]报道,Len 能够使胆管癌患者获益。本研究发现,Len 对胆管癌HuCCT1细胞的生长增殖具有一定的抑制作用,但抑制率较低(48 hIC50在微摩尔级别)。PFD 作为肺纤维化治疗的特效药,被证实具有毒副作用小的特点。近年多项临床前实验研究揭示[7-9],PFD 具有抗肿瘤效果。我们的前期研究证实,PFD 可以抑制HuCCT1细胞的生长、增殖、侵袭及EMT 进程,但是其药物作用浓度较高,作用36 h的IC50高为1.36 mmol/L[3],这为临床应用带来一定的困难。本研究显示,与单药作用比较,低剂量的PFD 联合Len 将显著抑制HuCCT1 细胞的生长与增殖。自噬是细胞的一种重要的生理活动,细胞通过“自我吞噬”的方式降解清除坏损的细胞器、生物大分子等物质,进而完成物质能量的回收利用以及降低细胞损伤[10]。然而过度的细胞自噬将激活细胞的死亡程序(如细胞凋亡),促进细胞“自我毁灭”[11]。在肿瘤治疗中,靶向激活肿瘤细胞的过度自噬是一种有效的治疗策略[12-14]。本研究发现,PFD联合Len可显著提高HuCCT1细胞中自噬水平,提示PFD 联合Len 可能通过过度激活细胞自噬,降低细胞的活力和抑制细胞的增殖。
AMPK-mTOR 信号轴是肿瘤细胞生长的重要调控通路。AMPK 是细胞应答能量变化的中枢调控分子。当细胞中能量(如葡萄糖、氨基酸等)匮乏时,能量感知因子通过信号传递,激活AMPK,进而调控细胞中线粒体、核糖体、蛋白质等代谢活动,指导细胞维持基本的生命活动,或启动细胞 死 亡(如 凋 亡、坏 死、自 噬 等)[15-16]。 然而,mTOR 通过组装形成mTORC1 和mTORC2 复合体,激活或抑制下游信号传递,进而增强细胞的代谢活动及促进细胞的生长与增殖[17]。肿瘤细胞的生长依赖于高糖环境,AMPK-mTOR 信号轴表现为AMPK 抑制、mTOR 激活的状态[18-19]。所以,激活肿瘤细胞的AMPK、抑制mTOR 将有助于抑制肿瘤细胞的生长。另外,AMPK-mTOR 信号轴也是细胞自噬的重要调控通路。激活的AMPK一方面通过磷酸化自噬发生关键调控蛋白(如ULK1、Beclin1 等),促进细胞自噬的起始与发生;另一方面,AMPK 通过抑制细胞中mTOR 的信号通路,加剧自噬的发生及自噬流的进程,最终促进细胞自噬[20]。本研究发现,PFD 和Len 单药处理HuCCT1 细胞后,AMPK 的磷酸化水平上调,mTOR 及其下游分子S6 的磷酸化水平下调,提示两种单药处理都将不同程度的激活AMPK 和抑制mTOR。本研究还发现,与单药组比较,PFD和Len 联合用药将显著上调AMPK 的磷酸化水平,下调mTOR 和S6 的磷酸化水平,提示联合用药进一步的激活AMPK、抑制mTOR。此外多项Len 耐药相关研究指出,抑制mTOR 可以降低Len 的耐药,进而提高Len 对肿瘤细胞的杀伤效力[21-23]。这些研究结论提示,本研究所提出的药物联合方案也将为解决Len 治疗肿瘤过程中的耐药问题提供一种新的思路。
总之,低剂量的PFD 联合Len 可有效抑制胆管癌HuCCT1 细胞的生长和增殖,上调细胞的自噬水平,作用机制可能是通过上调AMPK的磷酸化水平,下调mTOR 的磷酸化水平,进而抑制mTOR 信号通路。
