高温结晶合成Mn2O3@MoS2复合材料及其对铀的吸附性能
2022-09-01林育玲谢子杰卢雅宁王英财柳玉辉刘云海
林育玲,吴 凡,谢子杰,高 博,唐 梦,卢雅宁,王英财,张 爽,柳玉辉,刘云海,*
1.东华理工大学,核资源与环境国家重点实验室,江西 南昌 330013;2.深圳市工勘岩土集团有限公司,广东 深圳 518000
目前,铀污染主要来源于铀矿的开采、核燃料的加工利用以及乏燃料后处理等,大量高浓度的铀不可避免地被释放到环境中,污染土壤、地表水、地下水。无论是应用还是环境污染,铀的处理和去除是必要的。铀具有五个氧化态,但U(Ⅳ)和U(Ⅵ)是最常见的[1]。U(Ⅳ)不溶于水,通常会产生沉淀,而U(Ⅵ)形成离子溶液[2]。水溶液中去除U(Ⅵ)的方法有很多,例如化学沉淀[1]、膜分离[3]、生物法[4]、溶剂萃取[5]、电化学纯化[6]、反渗透[7]、离子交换[8]和吸附法。由于吸附法效率高且操作方便,因此被认为是水环境中污染物处理的常用方法之一[9],而且吸附可以降低铀的溶解浓度和潜在的迁移[10]。
石墨烯是一种只有一个原子厚的碳层,由sp2键合的碳组成。自2004年首次报道石墨烯的电学性质[11]以来,因为其独特的二维(2D)结构和优异的物理化学性能,如高电导率、导热率、机械强度大但质量超轻、比表面积大(2 620 m2/g[12])等,它引起了人们的强烈兴趣。石墨烯的化学修饰为其提供了新的性能和功能,从而带来了多种多样的技术应用[13]。近年来,石墨烯的快速发展带动了其他单层二维体系的研究,如二维过渡金属硫化物、六方氮化硼。它们的特殊结构导致了很多新奇的物理性质。二维二硫化钼(2D MoS2)已成为受到广泛研究的材料。MoS2的晶格结构是由一层六边形排列的钼原子共价夹在两层硫原子之间,形成一个整体的三角棱柱单元[14]。单层二硫化钼(MoS2)作为一种二维材料,具有超轻的质量和巨大的比表面积[15]。MoS2的表面具有硫官能团,并且具有极好的电荷转移潜力和极小的二次污染[16]。硫原子的存在对于MoS2有效去除污染物至关重要,因为硫原子是MoS2的主要吸附位。近来,MoS2与其他功能纳米材料的复合物由于其大的表面积和强的表面吸附能力而在吸附重金属离子方面取得了令人满意的结果。Yang等[17]研究了两种新型磁性核壳Fe3O4@MoS2和合成了MoS2@Fe3O4复合材料,并利用其去除Cr(Ⅵ),且证实了该材料具有良好的吸附和可再生性能。Xie等[18]通过水热法一步合成了MoS2和还原石墨烯的多孔纳米复合材料(MoS2-rGO),MoS2-rGO纳米复合材料对刚果红的吸附速率较快,pH=3时最大吸附容量可达440.9 mg/g。Sun等[9]将磁性Fe3O4纳米粒子用聚乙烯亚胺(PEI)包覆,然后通过水热法对Fe3O4@PEI进行MoS2改性,制备出三维花状结构的磁性聚乙烯亚胺@MoS2(MP@MoS2)复合材料,该材料在去除水环境中的Cr(Ⅵ)和Pb(Ⅱ)方面具有很大的实际应用潜力。Wang等[19]采用简单的水热法制备了涂覆MoS2的Mg/Al双层氢氧化物复合材料(LDHs@MoS2),用于从水溶液中吸附Cr(Ⅵ)。在pH=5.0时,LDHs@MoS2对Cr(Ⅵ)的去除容量达到76.3 mg/g。
在吸附铀方面,锰氧化物是金属的强吸附剂[20-23]。锰氧化物对重金属的吸附亲和力始终高于与环境相关的吸附剂[24-25]。锰氧化物具有重要的吸附性能,因此可用于从水溶液中清除放射性核素[26]。Mn2O3的价格低廉,且无毒、无害,对环境友好,选择Mn2O3来提升MoS2的吸附性能是个可行的方案,而且以MoS2为基底可以增加Mn2O3的比表面积,防止Mn2O3团聚,Mn2O3的复合活化了MoS2的吸附位点,增强了吸附性能。
本工作拟采用高温电化学法制备Mn2O3@MoS2,通过静态吸附批实验研究不同pH、接触时间、U(Ⅵ)初始浓度以及反应温度对Mn2O3@MoS2吸附U(Ⅵ)的影响,探究其对铀的吸附性能。
1 实验部分
1.1 试剂和仪器
氯化锂、氯化钾和钼酸铵,广东西陇科技有限公司(中国);硫氰酸钾,上海优试化工有限公司;硝酸钾、硝酸锂和硝酸钠,北京沃凯生物科技有限公司;乙酸锰,国药集团化学试剂有限公司;钼丝,上海金旭合金公司;碳棒,北京京龙特种碳石墨厂;硝酸铀酰六水合物,金鑫化工实业有限公司。所有药品和化学试剂均为分析纯,未进一步纯化即可使用。
Nova Nano 450扫描电子显微镜(SEM-EDS),荷兰FEI公司;FTS-65A傅立叶变换红外光谱仪(FTIR),美国Bio-RAD公司;Stabino-PMX400 Zeta电位仪,美国Microtrac有限公司;Bruker D8-A25 X射线粉末衍射仪(XRD),德国Bruker(布鲁克)公司;BSA224S电子天平,精度0.1 mg,赛多利斯科学仪器(北京)有限公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 材料的制备
1.2.1MoS2的制备 准确称量4.0 g钼酸铵、6.0 g硫氰酸钾放置于干燥的刚玉坩埚中,加入一定量的KCl-LiCl盐体系,混合均匀后置于60 ℃的恒温干燥箱中去除水分。将其在850 ℃的高温炉中熔解后以钼丝、碳棒为阴阳极,通入0.5 A的电流电解1 h得到粗产品,取出样品并待其冷却到室温,用去离子水洗涤、抽滤数次,将样品置于60 ℃的干燥箱中持续干燥24 h,干燥后即制得MoS2。
1.2.2Mn2O3@MoS2材料制备 准确称取固体硝酸钠13.5 g、硝酸锂7.4 g、硝酸钾4.1 g,缓慢地加入到研钵中,混合并充分研磨25 min,把研磨完成的盐转移到刚玉坩埚中,使用马弗炉在250 ℃恒温加热,等待硝酸盐在其中熔解完全,接着用石英棒慢慢搅拌加入2 g乙酸锰和4 g MoS2,保温3 h,从马弗炉中取出烧热的刚玉坩埚,马上用去离子水冷却至室温,加水浸泡3 h后将其倒入烧杯中磁力搅拌1 h,用去离子水多次洗涤、抽滤、除杂后在60 ℃下干燥12 h,得到Mn2O3@MoS2复合材料。
1.2.3铀标准溶液的制备 准确称取2.109 8 g硝酸铀酰六水合物于烧杯中,然后加入适量的浓硝酸搅拌至硝酸铀酰六水合物溶解,随后转移至1 L的容量瓶中,即可得到10 g/L的铀标准溶液。将10 g/L的铀标准溶液用去离子水稀释,得到相应实验所需的浓度。
1.3 吸附铀实验
本实验研究溶液的pH值、接触时间、铀初始浓度和温度对吸附剂(Mn2O3@MoS2)吸附U(Ⅵ)性能的影响。精确称取5 mg吸附剂放入150 mL的锥形瓶中,再向锥形瓶中加入25 mL一定浓度和pH值的U(Ⅵ)溶液,把锥形瓶放入振荡器中振荡一定时间后,取出一定量的溶液离心。最后,用双光束紫外可见分光光度计和偶氮胂Ⅲ法[16],测定吸附后上层清液的铀浓度,采用差减法计算出吸附容量。平衡吸附容量qe(mg/g)根据公式(1)计算。
(1)
式中:ρ0和ρe分别为U(Ⅵ)的初始和平衡质量浓度,mg/L;V是溶液体积,L;m是吸附剂的质量,g。
2 结果与讨论
2.1 样品表征
2.1.1XRD分析 Mn2O3、MoS2和Mn2O3@MoS2的XRD分析结果示于图1。由图1可以看出,Mn2O3@MoS2的(003)、(200)、(211)、(222)、(400)、(009)、(107)、(044)、(110)、(113)面均与Mn2O3标准卡片(PDF#41-1442)、MoS2标准卡片(PDF#17-0744)相对应,可发现Mn2O3@MoS2复合材料晶面衍射峰出现了Mn2O3、MoS2的特征衍射峰,且衍射峰较为尖锐,这说明Mn2O3的掺杂没有改变MoS2的结构,所制备的Mn2O3@MoS2晶化度高,结晶度良好。

图1 MoS2、Mn2O3和Mn2O3@MoS2的X射线粉末衍射图Fig.1 X-ray powder diffraction pattern of MoS2, Mn2O3 and Mn2O3@MoS2
2.1.2SEM-EDS分析 MoS2和Mn2O3@MoS2的SEM-EDS图示于图2。由图2(a)可以看出,MoS2呈现出片层结构,且具有金属一般光泽的透亮度。从图2(b)可以看出,Mn2O3球状结构分散在MoS2的片层上,由此可见,Mn2O3与MoS2复合之后形成的材料没有对原本MoS2的形貌特征发生改变。从EDS图可明显看出,图2(a)是复合前的MoS2,只含Mo和S元素,而图2(b)是复合之后的MoS2,图中存在Mn元素和O元素,XRD图表明成功制备Mn2O3@MoS2复合材料。

图2 MoS2(a)和Mn2O3@MoS2复合材料(b)的SEM以及Mapping图Fig.2 SEM and Mapping of MoS2(a) and Mn2O3@MoS2 composites(b)
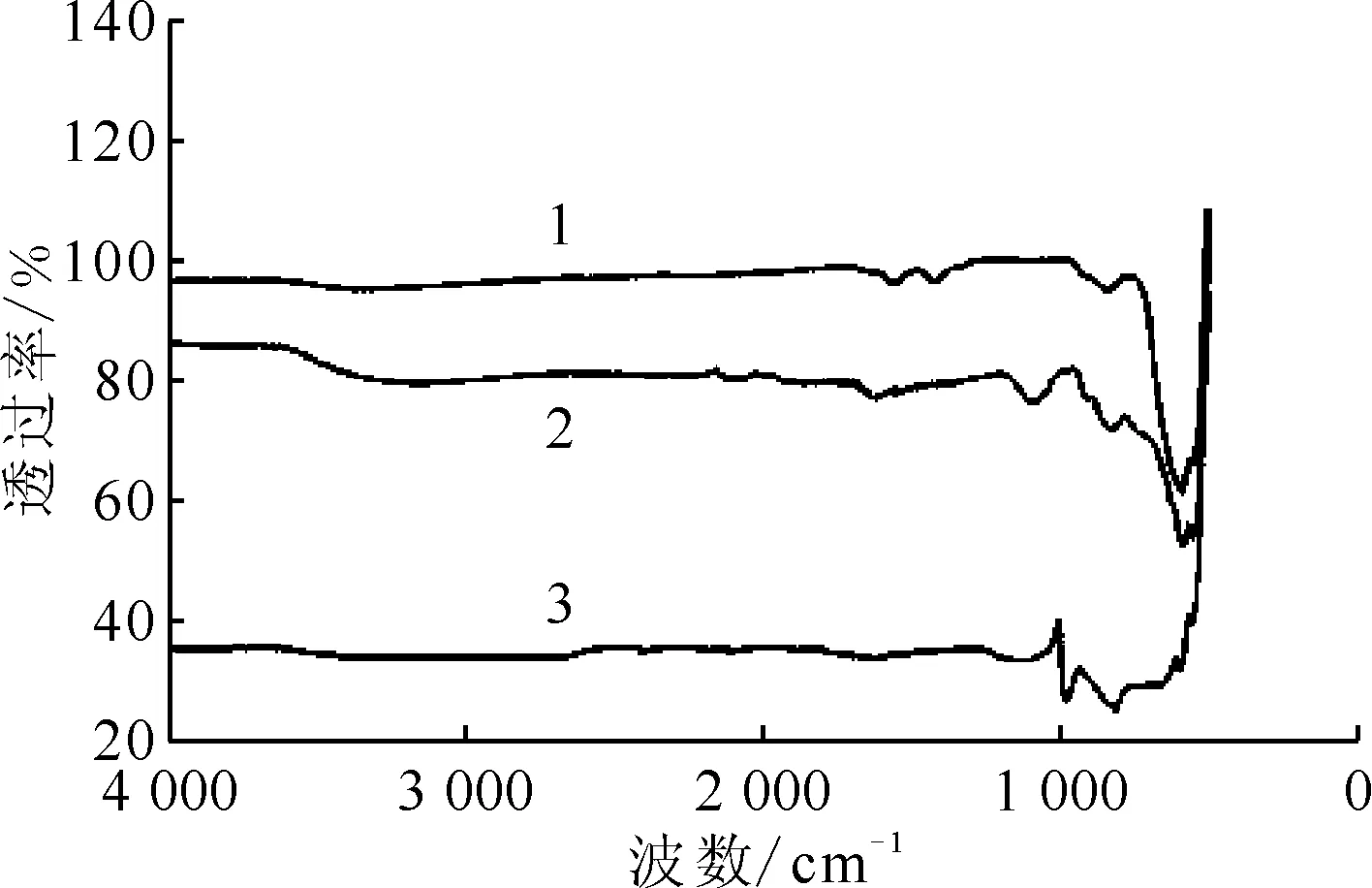
1——Mn2O3@MoS2,2——Mn2O3,3——MoS2图3 Mn2O3、MoS2和Mn2O3@MoS2的红外光谱图Fig.3 Infrared spectra of Mn2O3,MoS2 and Mn2O3@MoS2
2.1.3FTIR分析 图3为Mn2O3、MoS2和Mn2O3@MoS2的FTIR光谱。由图3可以看到,在491、560、633 cm-1处出现的特征峰,归因于Mn—O伸缩振动[27]。位于1 602、3 372 cm-1处的两个振动带分别对应于Mn2O3纳米颗粒上吸附的表面水分子的弯曲和伸缩振动[28]。在图3的Mn2O3@MoS2复合材料的FTIR光谱中,可以看到图中仍然存在Mn2O3的特征峰。在Mn2O3@MoS2的FTIR中可以观察到3 443 cm-1处的宽吸收带是由于MoS2中物理吸附水的O—H拉伸和在1 621 cm-1附近的δ(H—OH)振动[29]。在600 cm-1附近的弱带是Mo-S的伸缩振动[28, 30],但是MoS2的特征吸附带与Mn2O3的特征峰重合,因此,FTIR光谱进一步说明Mn2O3@MoS2的成功合成。
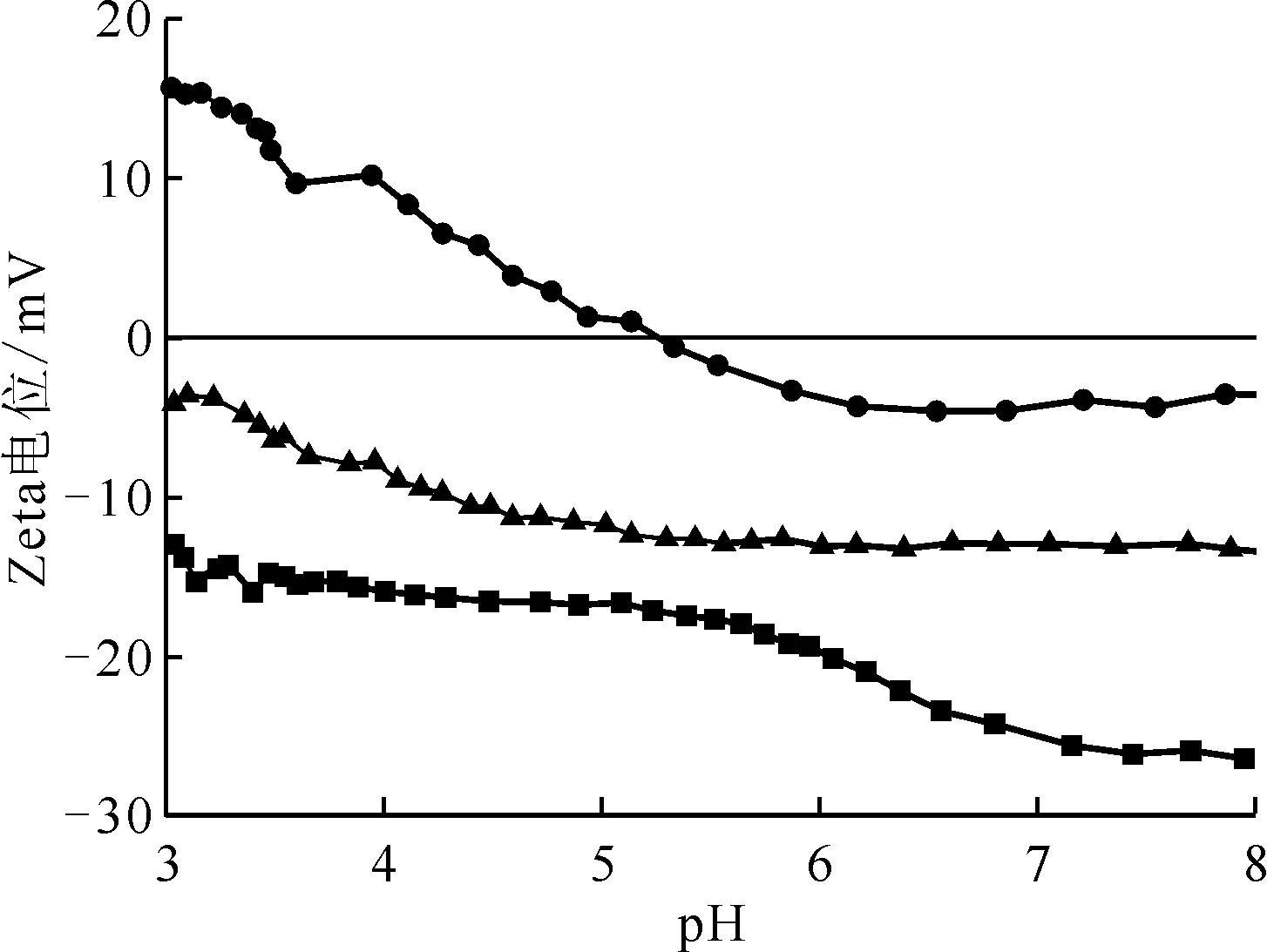
■——MoS2,●——Mn2O3,▲——Mn2O3@MoS2图4 MoS2、Mn2O3和Mn2O3@MoS2的Zeta电位图Fig.4 Zeta potential diagrams of MoS2, Mn2O3 and Mn2O3@MoS2
2.1.4Zeta电位分析 Zeta电位可以用来指示颗粒间的作用强度,以及材料表面的带电量。Mn2O3、MoS2和Mn2O3@MoS2的Zeta电位示于图4。由图4可知,在pH=3~8时,Mn2O3、MoS2和Mn2O3@MoS2的Zeta电位随着pH的升高而降低。其中,Mn2O3等电位点的pH=5.4,表面电势由15.73 mV降到-4.39 mV;MoS2表面电势由-12.81 mV降到-26.47 mV;Mn2O3@MoS2表面电势由-3.61 mV降到-13.52 mV;其电势皆为负电势,且皆大于-30 mV;Mn2O3材料表面带正电荷,MoS2由于其三明治的结构,表面由丰富的硫位点包围,因此表面带负电,但是其表面缺乏激活硫位点的官能团,因此对铀酰离子吸附作用低。复合材料Mn2O3@MoS2表面电势为负值,但是却没有MoS2的那么低,是因为引进Mn2O3使得硫位点所带的电荷被中和,进一步证明了Mn2O3@MoS2复合成功。
2.2 pH影响

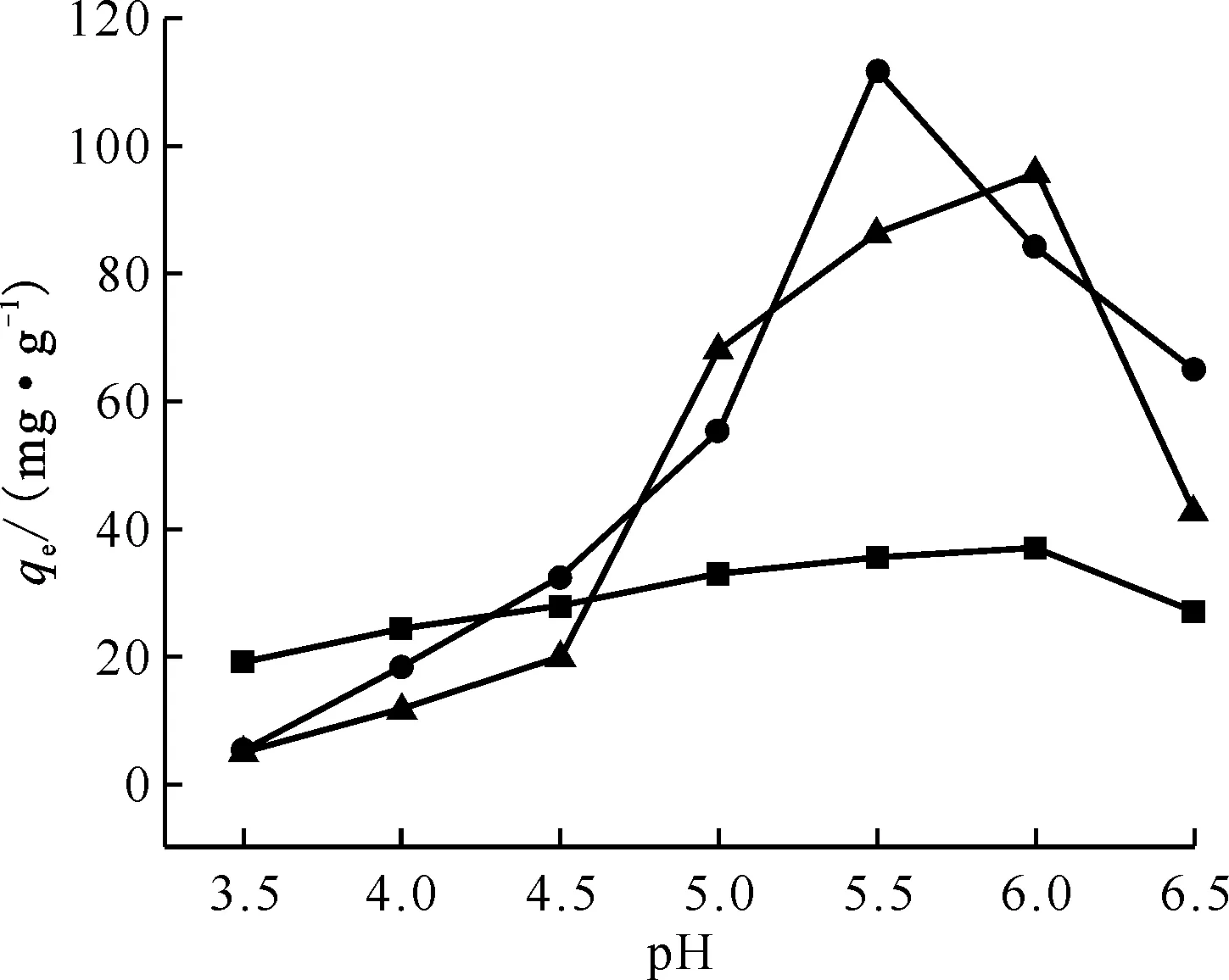
■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3m=5 mg,V=25 mL,ρ0=50 mg/L,吸附时间t=360 min,25 ℃图5 溶液pH对Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的影响Fig.5 Effect of pH on adsorption of U(Ⅵ) by Mn2O3,MoS2 and Mn2O3@MoS2
2.3 吸附动力学研究
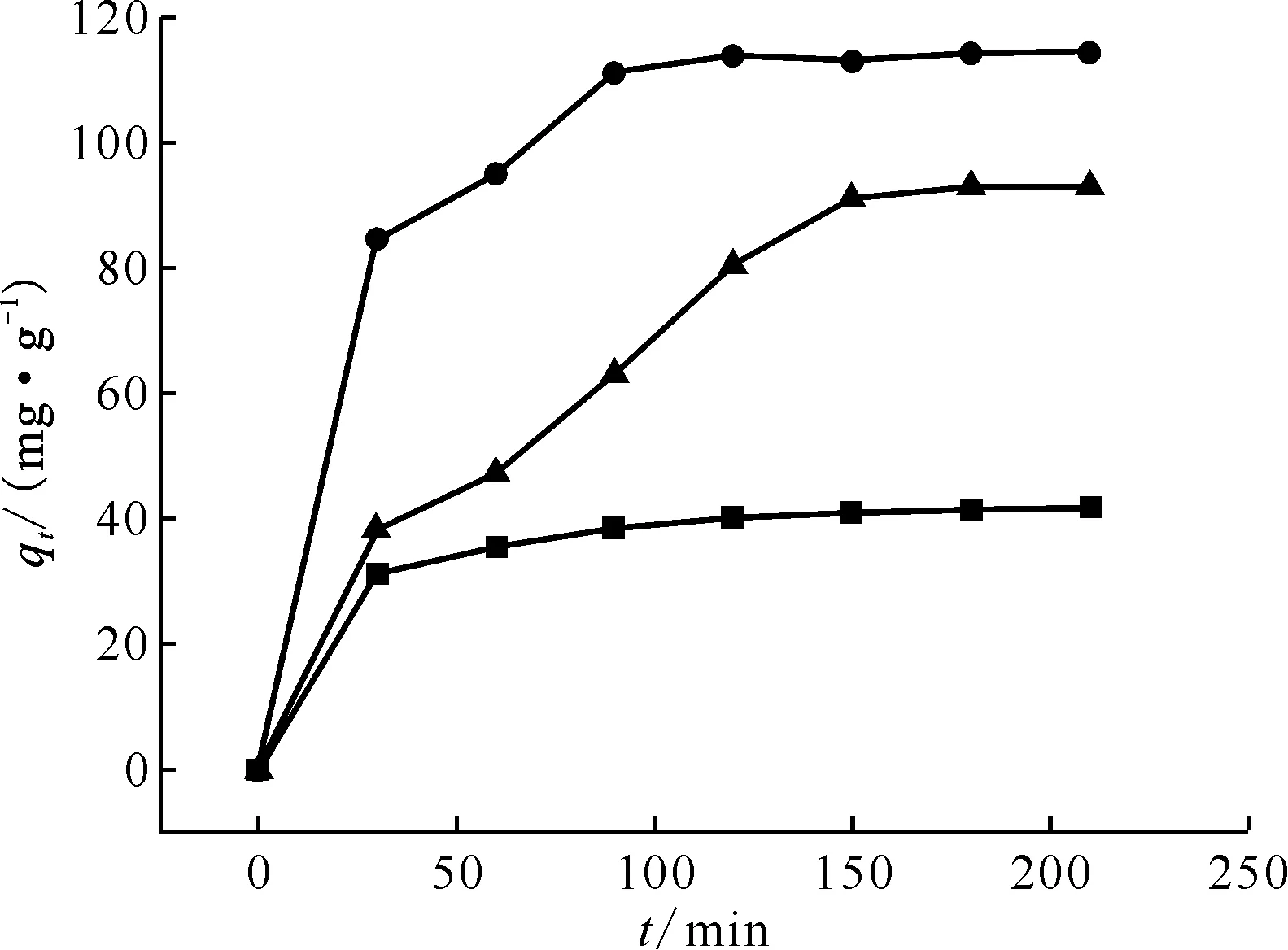
■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3m=5 mg,V=25 mL,ρ0=50 mg/L,pH=5.5,25 ℃图6 吸附时间对Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的影响Fig.6 Effect of contact time on adsorption of U(Ⅵ) by Mn2O3, MoS2 and Mn2O3@MoS2
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qe、qt分别为达到吸附平衡时和t时刻的吸附容量,mg/g;k1(min-1)、k2(g/(mg·min))为准一级和准二级动力学方程的吸附速率常数。以ln(qe-qt)对t和t/qt对t分别作图并线性拟合,从而得到准一级动力学拟合曲线(图7(a))和准二级动力学拟合曲线(图7(b))。通过图7(a、b)拟合直线方程的斜率及截距,按照公式计算不同吸附材料动力学参数k1、k2及线性相关系数r2。由图7及线性相关系数可以看出,MoS2、Mn2O3@MoS2和Mn2O3的实验数据与准二级吸附动力学模型相关性更好。通过准一级和准二级动力学方程拟合计算得到MoS2、Mn2O3@MoS2和Mn2O3的理论吸附容量列入表1。由表1结果可知,MoS2、Mn2O3@MoS2和Mn2O3的吸附容量准二级动力学方程拟合计算值(q2,cal)分别为 42.55、118.3、110.6 mg/g,与准一级动力学方程拟合计算值(q1,cal)相比较,q2,cal更接近实验得到的吸附容量(qe,exp)41.29、114.4、92.95 mg/g,说明该吸附过程更符合准二级动力学,则该吸附反应中起主导作用的是化学吸附。
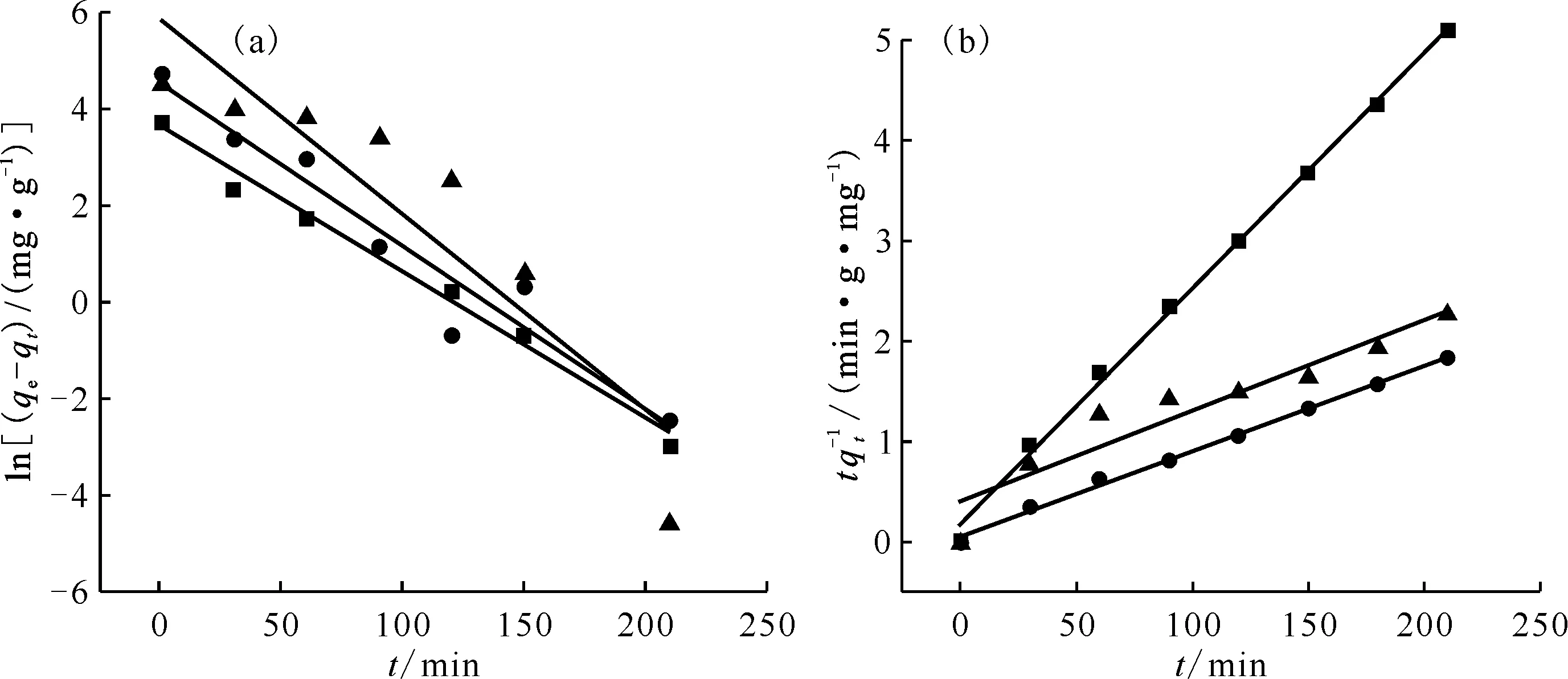
■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3图7 Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的准一级(a)和准二级(b)动力学拟合模型Fig.7 Pseudo-1st-order(a) and pseudo-2nd-order(b) kinetic modelsof U(Ⅵ) adsorption by Mn2O3, MoS2 and Mn2O3@MoS2
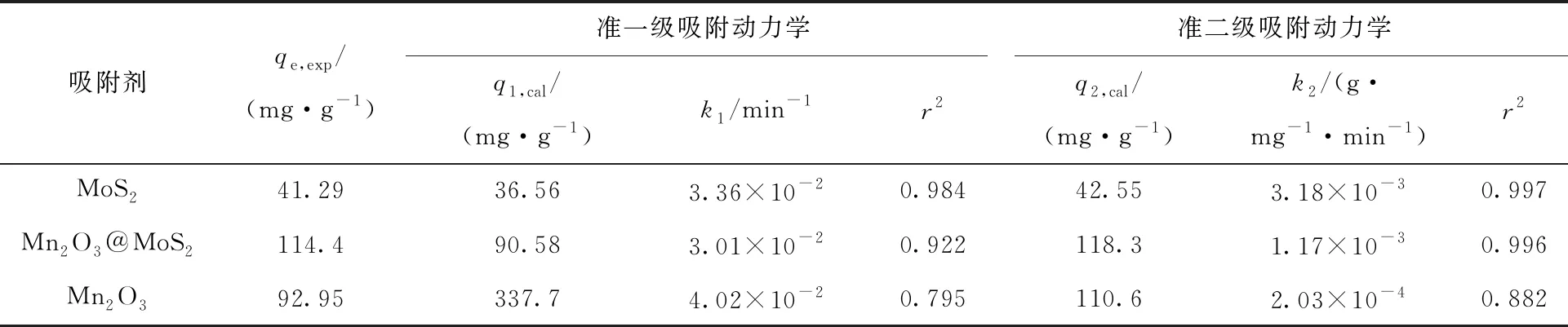
表1 MoS2、Mn2O3@MoS2和Mn2O3吸附U(Ⅵ)的动力学拟合Table 1 Fitted kinetic curves of U(Ⅵ) adsorption by MoS2, Mn2O3@MoS2 and Mn2O3
2.4 吸附等温模型
在吸附剂质量为5 mg、U(Ⅵ)溶液体积为25 mL、pH值为5.5、吸附时间为180 min条件下,探究不同的U(Ⅵ)初始浓度下(ρ0=10~80 mg/L),MoS2、Mn2O3@MoS2和Mn2O3对U(Ⅵ)的吸附影响,结果示于图8。由图8可以看出:随着U(Ⅵ)初始浓度的增大,MoS2、Mn2O3@MoS2和Mn2O3对U(Ⅵ)的吸附逐渐增加;在ρ0=40 mg/L时MoS2对U(Ⅵ)的吸附逐渐趋于平衡;在ρ0=50 mg/L时,Mn2O3@MoS2和Mn2O3对U(Ⅵ)的吸附达到饱和,最后趋于平衡。这可能是因为溶液中的铀酰离子量随铀浓度的增加而增加,吸附剂接触铀酰离子发生反应的机会更多,从而导致吸附容量上升。最终,位于材料表面上的活性位点近乎被完全占据,吸附趋于平衡。MoS2、Mn2O3和Mn2O3@MoS2对U(Ⅵ)的平衡吸附容量分别为45.60、94.81、113.4 mg/L。

■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3m=5 mg,V=25 mL,pH=5.5,t=180 min,25 ℃图8 U(Ⅵ)初始浓度对Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的影响Fig.8 Effect of U(Ⅵ) initial concentration on adsorption of U(Ⅵ) by Mn2O3, MoS2 and Mn2O3@MoS2
为了更好地解释Mn2O3、MoS2和Mn2O3@MoS2对U(Ⅵ)的吸附特性,采用Langmuir和Freundlich这两种模型对所得的实验数据结果进行计算拟合。Langmuir等温模型体现的是单层均一的吸附过程,它假设在吸附材料表面上的吸附位点是均一分布的,而且每个吸附位点的吸附力相同。其表达式如式(4)所示:
(4)
Freundlich吸附等温模型,假定在不均一的吸附材料表面上,吸附位点的分布也不均一。其等温模型表达式如式(5)所示:
(5)
式中:ρe为吸附平衡时的U(Ⅵ)质量浓度,mg/L;qe为平衡时的吸附容量,mg/g;KL为吸附平衡常数,L/mg,其值与吸附亲和力成正比;qm为单层饱和吸附容量,mg/g;KF为与吸附容量相关的参数, L/g;n为与吸附强度相关的参数。
以ρe/qe对ρe、以lnqe对lnρe作图并进行线性拟合,得到Langmuir和Freundlich等温式的线性拟合曲线,示于图9。计算得到的吸附容量和相关参数列于表2。由图9及表2可以知道,MoS2、Mn2O3和Mn2O3@MoS2吸附U(Ⅵ)的实验对Langmuir吸附等温模型的相关系数更接近1,其线性相关性更好。这表明了Mn2O3、MoS2、Mn2O3@MoS2吸附U(Ⅵ)是单层吸附占主导的。计算可得Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的单层饱和吸附容量为108.7、61.81 mg/g和117.5 mg/g。

(a)——Langmuir 吸附等温模型;(b)——Freundlich 吸附等温模型■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3图9 MoS2、Mn2O3和Mn2O3@MoS2对U(Ⅵ)的吸附等温模型Fig.9 Isothermal adsorption models of U(Ⅵ) by MoS2, Mn2O3 and Mn2O3@MoS2
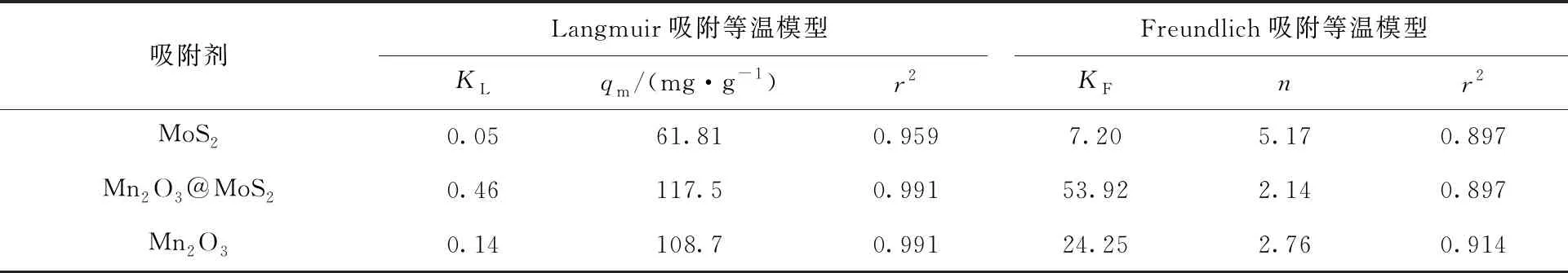
表2 Mn2O3、MoS2、Mn2O3@MoS2吸附U(Ⅵ)的Langmuir和Freundlich吸附等温模型拟合参数Table 2 Fitting parameters of Langmuir and Freundlich isotherm adsorption models for U(Ⅵ) on Mn2O3, MoS2, Mn2O3@MoS2
2.5 温度的影响与吸附热力学
在吸附剂质量为5 mg、U(Ⅵ)溶液体积为25 mL、ρ0=50 mg/L、pH=5.5、吸附时间为180 min条件下,探究温度对Mn2O3、MoS2、Mn2O3@MoS2吸附U(Ⅵ)的影响,结果示于图10。从图10可以看出,随着温度逐步地升高,Mn2O3、MoS2、Mn2O3@MoS2对U(Ⅵ)的吸附容量也随之提高,这表明升高温度有利于材料对U(Ⅵ)的吸附。

■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3m=5 mg,V=25 mL,ρ0=50 mg/L,t=180 min,pH=5.5图10 温度对Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的影响Fig.10 Effect of temperature on adsorption of U(Ⅵ) by Mn2O3, MoS2 and Mn2O3@MoS2
通过引入吉布斯自由能变(ΔG,kJ/mol)、焓变(ΔH,kJ/mol)和熵变(ΔS,J/(K·mol))这三个热力学参数,进一步研究Mn2O3、MoS2、Mn2O3@MoS2对U(Ⅵ)的吸附热力学。焓变和熵变通过式(6)计算,吉布斯自由能变通过式(7)计算。
(6)
ΔG=ΔH-TΔS
(7)
式中:Kd为吸附分配系数,mL/g;R为气体摩尔常数,8.314 J/(K·mol);T为热力学温度,K。
由式(6)作图得到热力学拟合曲线示于图11,根据式(6)和式(7)计算曲线斜率和截距,结果列于表3和表4。由表3和表4可知,Mn2O3、MoS2和Mn2O3@MoS2的ΔH⊖皆大于零,这表明了吸附剂吸附U(Ⅵ)的过程吸热;ΔS⊖皆大于零,混乱度增加,这表明了吸附U(Ⅵ)的过程为熵增过程;而吉布斯自由能ΔG<0,温度升高,ΔG绝对值变大,这表明3种材料对U(Ⅵ)的吸附是自发的,升高温度促进了吸附反应。
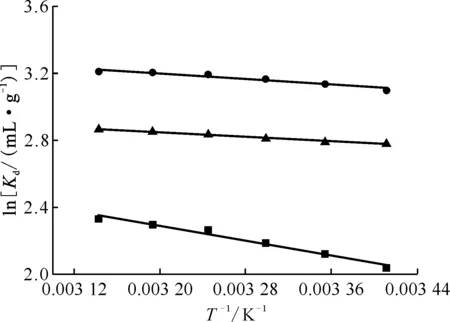
■——MoS2,●——Mn2O3@MoS2,▲——Mn2O3图11 Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的动力学模型拟合曲线Fig.11 Fitting curves of kinetic model for U(Ⅵ)adsorption by Mn2O3, MoS2 and Mn2O3@MoS2

表3 Mn2O3、MoS2和Mn2O3@MoS2吸附U(Ⅵ)的热力学参数ΔH⊖和ΔS⊖Table 3 Thermodynamic parameters ΔH⊖ and ΔS⊖ for adsorption of U(Ⅵ) by Mn2O3, MoS2 and Mn2O3@MoS2
3 结 论
(1) 通过高温熔融法成功制备了Mn2O3@MoS2复合材料,SEM&EDS、XRD、Zeta电位等表征结果表明制成的Mn2O3@MoS2仍呈现片状结构并没有破坏其晶体结构。
(2) Mn2O3@MoS2复合材料吸附U(Ⅵ)的吸附过程为自发吸热,吸附为单分子层吸附,且化学吸附占主导。
(3) Mn2O3@MoS2复合材料吸附U(Ⅵ)的最佳pH为5.5,平衡时间为90 min,单层饱和吸附容量为117.5 mg/g。

表4 MoS2、Mn2O3和Mn2O3@MoS2吸附U(Ⅵ)的热力学参数ΔGTable 4 Thermodynamic parameters ΔG for adsorption of U(Ⅵ) by MoS2, Mn2O3 and Mn2O3@MoS2
(4) Mn2O3@MoS2复合材料结合了Mn2O3和MoS2的优异特性,吸附性能优于MoS2,对水溶液中U(Ⅵ)的吸附具有一定优势。
