虾青素通过上调PINK1/parkin通路增强线粒体自噬并减轻大鼠对比剂急性肾损伤*
2022-09-01张驰昊轩永丽李文华
张驰昊,郑 迪,张 成,轩永丽,李文华,2△
(1徐州医科大学心血管病研究所,江苏徐州 221000;2徐州医科大学附属医院心内科,江苏徐州 221000)
随着临床介入技术的广泛使用,由对比剂引起的急性肾损伤(contrast-induced acute kidney injury,CI-AKI)已成为临床急性肾损伤发生的重要原因[1-3],CI-AKI 的发病机制目前尚不明确,目前公认主要与对比剂的直接毒性作用、肾脏血流动力学改变及氧化应激损伤有关[4-6]。CI-AKI 尚无有效治疗方法,当前公认的水化疗法可以预防但具有一定的局限性[7],有报道N-乙酰半胱氨酸、维生素C 等药物能够减轻CI-AKI[8-9],但尚未在临床广泛使用。虾青素(astaxanthin,AST)是在自然界中广泛存在的一种类胡萝卜素,是目前已知较强的天然抗氧化剂[10]。研究证明AST 能够减少活性氧簇(reactive oxygen species,ROS)的释放从而减轻大鼠CI-AKI[11],但机制未完全明确。有实验研究表明增强线粒体自噬能够减轻大鼠急性肾损伤[12]。本研究通过大鼠CI-AKI模型探讨PTEN 诱导假定激酶1(PTEN-induced putative kinase 1,PINK1)/parkin信号通路介导的线粒体自噬在CI-AKI 发生中的作用及AST 预处理的治疗效果,为CI-AKI预防药物研究提供实验依据。
材料和方法
1 动物
SPF 级7 周龄雄性SD 大鼠50 只,重(250±20)g,购自北京维通利华实验动物技术有限公司,动物合格证号为20211203Aazz0619000930。
2 主要试剂
AST 购自上海源叶生物科技有限公司;吲哚美辛购自上海麦克林生化科技有限公司;N-硝基-L-精氨酸甲酯(N-nitro-L-arginine methylester,L-NAME)购自北京索莱宝科技公司;碘海醇(每mL 含350 mg I)购自扬子江药业;3-甲基腺嘌呤(3-methyladenine,3-MA)购自上海阿拉丁生化科技股份有限公司;血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)及丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所;BCA 蛋白浓度检测试剂盒和蛋白上样缓冲液购自上海碧云天;SDS-PAGE 试剂盒购自上海生工生物工程;ROS 染液、热休克蛋白60(heat shock protein 60,Hsp60)抗体、Cy3-TSA和FITC标记的驴抗兔IgG购自武汉赛维尔。兔抗PINK1 抗体(AFFINITY);兔抗parkin 抗体(Abcam);兔抗微管相关蛋白1 轻链3(microtubuleassociated protein 1 light chain 3,LC3)抗体和溶酶体相关膜蛋白2(lysosomal-associated membrane protein 2,LAMP2)抗体(北京博奥森生物科技有限公司);山羊抗兔IgG、山羊抗小鼠IgG 和鼠抗GAPDH 抗体(Proteintech);ECL显色液购自Bioworld。
3 主要方法
3.1 动物分组及模型构建 50 大鼠随机分为5 组,假手术(sham)组、造模组(CI-AKI 组)、AST 治疗组(AST+CI-AKI 组)、自噬抑制剂组(3-MA+CI-AKI 组)和AST 联合自噬抑制剂组(AST+3-MA+CI-AKI 组),每组各10 只。大鼠模型构建参考文献[11]进行,具体操作如下:大鼠禁食禁水12 h,10%水合氯醛麻醉(3.0 mL/kg)麻醉,各组经尾静脉依次注射吲哚美辛(10 mg/kg)、L-NAME(10 mg/kg)和碘海醇(每kg 含3 g碘),每次给药间隔15 min;sham 组大鼠于相同时点依次注射相对应药剂等体积的PBS、生理盐水和生理盐水。AST+CI-AKI组在给予AST 灌胃1周后进行CI-AKI模型的建立,且于造模后3 d继续给予AST 灌胃。3-MA+CI-AKI 组参照前人文献[13]在造模前30 min 腹腔注射3-MA 溶液(20 mg/kg),后进行CI-AKI模型的建立。AST+3-MA+CI-AKI 组造模前给予AST灌胃1 周,并且于造模前30 min 腹腔注射3-MA 溶液,后进行CI-AKI 模型建立,造模后给予AST 灌胃3 d。所有组大鼠于造模后72 h,心脏穿刺取血6~8 mL,室温下静置2 h,4 ℃、1 580×g离心15 min,取上清置于-80 ℃保存待用;剪开腹部皮肤及肌肉组织,分离出双侧肾脏,组织剪剪取小部分肾脏置于电镜固定液中4 ℃保存,以备后续电镜样本制作,切取肾脏切片,修剪整齐后部分置于4%多聚甲醛中,4 ℃保存,用于石蜡切片制作及HE 染色、免疫荧光检测,部分置于-80 ℃保存,以备后续ROS 的检测,剩余部分肾脏组织块置于-80 ℃固定保存,用于肾脏组织蛋白提取及Western blot 检测。
3.2 SCr 和BUN 检测 取保存的血清样本,按相关试剂盒说明书操作,检测SCr和BUN水平。
3.3 肾脏组织T-SOD 和MDA 检测 取保存的肾脏组织块,按重量体积比1∶10 加入生理盐水,研磨离心后取上清液,BCA 法测定蛋白浓度,按T-SOD 和MDA 试剂盒说明书配制试剂,检测肾脏组织T-SOD和MDA水平。
3.4 HE 染色 取保存于4%多聚甲醛中的肾脏组织,按脱水透明浸蜡、包埋、切片步骤制作石蜡切片,按脱蜡、苏木素-伊红染色、脱水步骤进行切片HE 染色,光学显微镜下(×400)观察分析。
3.5 ROS 染色 取保存于-80 ℃中的肾脏组织,经OCT 包埋、切片后制作成冰冻切片,再经淬灭组织自发荧光、ROS 染色、DAPI 复染细胞核后,置于荧光显微镜下(×400)观察分析。
3.6 透射电镜观察 取保存于4 ℃电镜固定液中的肾脏组织小块,经漂洗、再次固定、脱水、包埋、聚合制成树脂块,后经切片、染色制成铜网切片,于透射电镜(Hitachi HT7800)下(×5 000)观察分析。
3.7 免疫荧光双标共定位 取保存于4%多聚甲醛中肾脏组织,制作成石蜡切片后,按脱蜡、抗原修复、孵育LC3 抗体、孵育Ⅱ抗、CY3-TSA 染色标记、孵育Hsp60(或LAMP2)抗体、荧光Ⅱ抗孵育标记、DAPI复染细胞核、淬灭自发荧光后封片,置于荧光显微镜(Nikon Eclipse C1)下(×400)观察分析。
3.8 Western blot 检测 取保存于-80 ℃中的肾脏组织块,经提取蛋白后,BCA 法测定蛋白浓度,将蛋白样本置于电泳仪中电泳,后经电转、脱脂奶粉溶液封闭,按说明书配制抗体工作液(PINK1、parkin、LC3和LAMP2 抗体均按1∶2 000 稀释),4 ℃摇床孵育过夜,相应Ⅱ抗(1∶5 000)孵育1 h,ECL 化学发光成像系统检测成像。以GAPDH 为内参照,采用Image-Pro Plus 6.0软件进行分析,计算蛋白相对表达量。
4 统计学处理
用GraphPad Prism 9.0 软件进行统计分析。数据均采用均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析,组间两两比较采用Tukey检验。以P<0.05为差异有统计学意义。
结果
1 大鼠SCr和BUN的检测
大鼠心脏取血后提取血清进行SCr 和BUN 检测,结果如表1所示。CI-AKI组大鼠SCr和BUN水平较sham 组显著升高(P<0.05);AST+CI-AKI 组SCr 和BUN 水平较CI-AKI 组显著降低(P<0.05);与此相对应的,3-MA+CI-AKI 组SCr 和BUN 水平较CI-AKI 组显著上升(P<0.05),而AST+3-MA+CI-AKI 组SCr 和BUN水平较AST+CI-AKI组显著升高(P<0.05)。

表1 各组大鼠血清肌酐及血尿素氮水平Table 1.SCr and BUN levels of rats in each group(Mean±SEM.n=10)
2 大鼠肾脏组织T-SOD和MDA的检测
大鼠处死后摘取肾脏组织进行T-SOD 和MDA检测,结果见表2。CI-AKI 组T-SOD 活性较sham 组显著降低,MDA 含量显著增加(P<0.05);同样地,与CI-AKI 组相比,AST+CI-AKI 组T-SOD 活性显著增高,MDA 含量显著减少(P<0.05),而3-MA+CI-AKI组T-SOD 活性较CI-AKI 组显著降低,MDA 含量显著增加(P<0.05);与此相对应的,AST+3-MA+CI-AKI组T-SOD活性较AST+CI-AKI组显著降低,MDA含量显著增加(P<0.05)。

表2 各组大鼠肾脏组织T-SOD及MDA水平Table 2.T-SOD and MDA levels in kidney tissues of rats in each group(Mean±SEM. n=10)
3 肾脏HE染色
大鼠肾脏组织取材后进行HE 染色,结果如图1所示。sham组肾小管结构清晰、无扩张,肾小管上皮细胞排列整齐;CI-AKI组肾小管结构紊乱,肾小管可见扩张,同时部分官腔可见阻塞,肾小管上皮细胞可见空泡样变性;AST+CI-AKI 组肾小管上皮细胞损伤与CI-AKI 组比较明显减轻,而3-MA+CI-AKI 组肾小管细胞损伤与CI-AKI组比较明显加重。
4 透射电镜观察线粒及自噬小体形态
大鼠肾脏组织取材后进行电镜标本制作后行透射电镜观察,结果如图2 所示。sham 组线粒体体积较大;而CI-AKI 组线粒体较sham 组可见线粒体体积减小,可见线粒体碎片及少量自噬小体;3-MA+CIAKI 组可见线粒体损伤严重及大量线粒体碎片,未见自噬小体;AST+CI-AKI 组线粒体呈长椭圆形,体积较大可见较多自噬小体及包裹了线粒体小碎片的自噬小体;与AST+CI-AKI 组相比,AST+3-MA+CIAKI组线粒体较小,自噬小体数量很少。
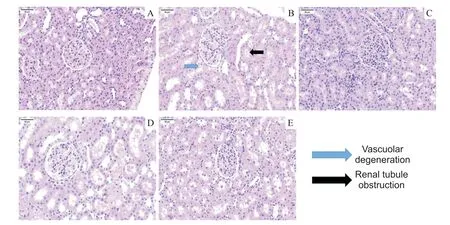
Figure 1.Observation under optical microscope(HE staining,scale bar=50 µm).A:sham group;B:CI-AKI group;C:AST+CIAKI group:D:3-MA+CI-AKI group;E:AST+3-MA+CI-AKI group.No tubular lumen stenosis and vacuolar degeneration of tubular epithelial cells were seen in the sham group,while obvious tubular lumen stenosis and massive vacuolar degeneration of tubular epithelial cells were seen in the CI-AKI group,and lumen stenosis and vacuolar degeneration were significantly reduced in the AST+CI-AKI group and aggravated in the 3-MA+CI-AKI group.图1 各组大鼠肾脏组织HE染色
5 免疫荧光双标共定位检测
大鼠肾脏组织取材后,进行双标免疫荧光染色,后行荧光显微镜观察,结果如图3、4所示:与sham 组相比,CI-AKI 组LC3 表记的自噬小体与Hsp60 标记的线粒体两者距离较近,有共定位信号,LC3 标记的自噬小体与LAMP2 标记的溶酶体距离较近,可见共定位信号,可认为CI-AKI 组较sham 组线粒体自噬水平有所提高;与CI-AKI 组相比,AST+CI-AKI 组LC3表记的自噬小体与Hsp60 标记的线粒体距离较近,共定位信号较多,LC3 标记的自噬小体与LAMP2 标记的溶酶体共定位信号同样较多,可见AST+CI-AKI组线粒体自噬水平及细胞自噬水平较CI-AKI组明显提高;3-MA+CI-AKI 组LC3 标记的自噬小体荧光强度微弱,且与Hsp60 标记的线粒体距离较远,未见有共定位信号,线粒体自噬及细胞自噬水平很低。
6 冰冻切片ROS染色
大鼠肾脏组织取材后,立即放于-80 ℃保存,后进行冰冻切片制作及ROS 染色,结果如图5 所示:sham组ROS表达很少,CI-AKI组较sham组ROS表达水平显著提高(P<0.05),3-MA+CI-AKI 组较CI-AKI组ROS 表达水平有显著上升(P<0.05),AST+CI-AKI组较CI-AKI 组ROS 表达水平显著降低(P<0.05),AST+3-MA+CI-AKI 组与AST+CI-AKI 组相比,ROS 表达量有显著上升(P<0.05)。
7 Western blot检测结果
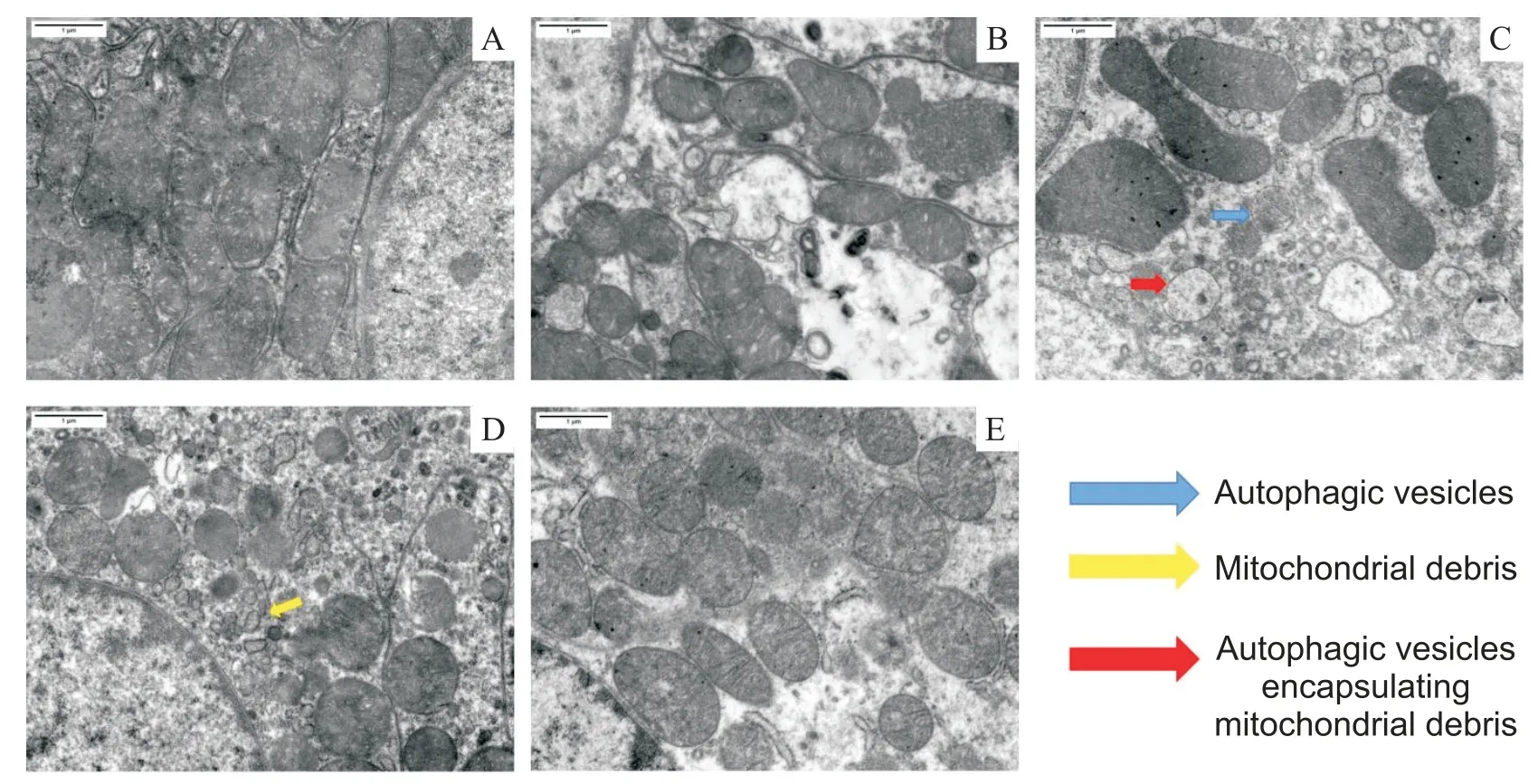
Figure 2.Mitochondria and autophagic vesicles were observed by transmission electron microscopy(scale bar=1 µm).A:sham group;B:CI-AKI group;C:AST+CI-AKI group:D:3-MA+CI-AKI group;E:AST+3-MA+CI-AKI group.The mitochondria in the sham group were large and no autophagosomes were seen.The mitochondria in the CI-AKI group were small and sporadic autophagosomes were seen.The mitochondria in the AST+CI-AKI group were large and more autophagosomes were seen,and mitochondrial fragments wrapped by autophagosomes were seen.The mitochondria in the 3-MA+CI-AKI group were small and no autophagosomes were seen,and a large number of small mitochondrial fragments were seen.图2 透射电镜下各组大鼠肾组织线粒体及自噬小体形态

Figure 3.LC3-labeled autophagosomes(red)were fluorescently double-stained with Hsp60-labeled mitochondria(green).The scale bar=50 µm.In the sham group,the two fluorescent signals were far apart and no co-localization was seen.In the CI-AKI group,the two signals were seen to be closer and co-localized,but the fluorescence intensity was weak.In the AST+CIAKI group,the two signals were seen to be extremely close and co-localized,and the fluorescence intensity was strong.In the 3-MA+CI-AKI group,the two signals were not co-localized and the fluorescence intensity was weak.图3 LC3标记的自噬小体与Hsp60标记的线粒体荧光双染
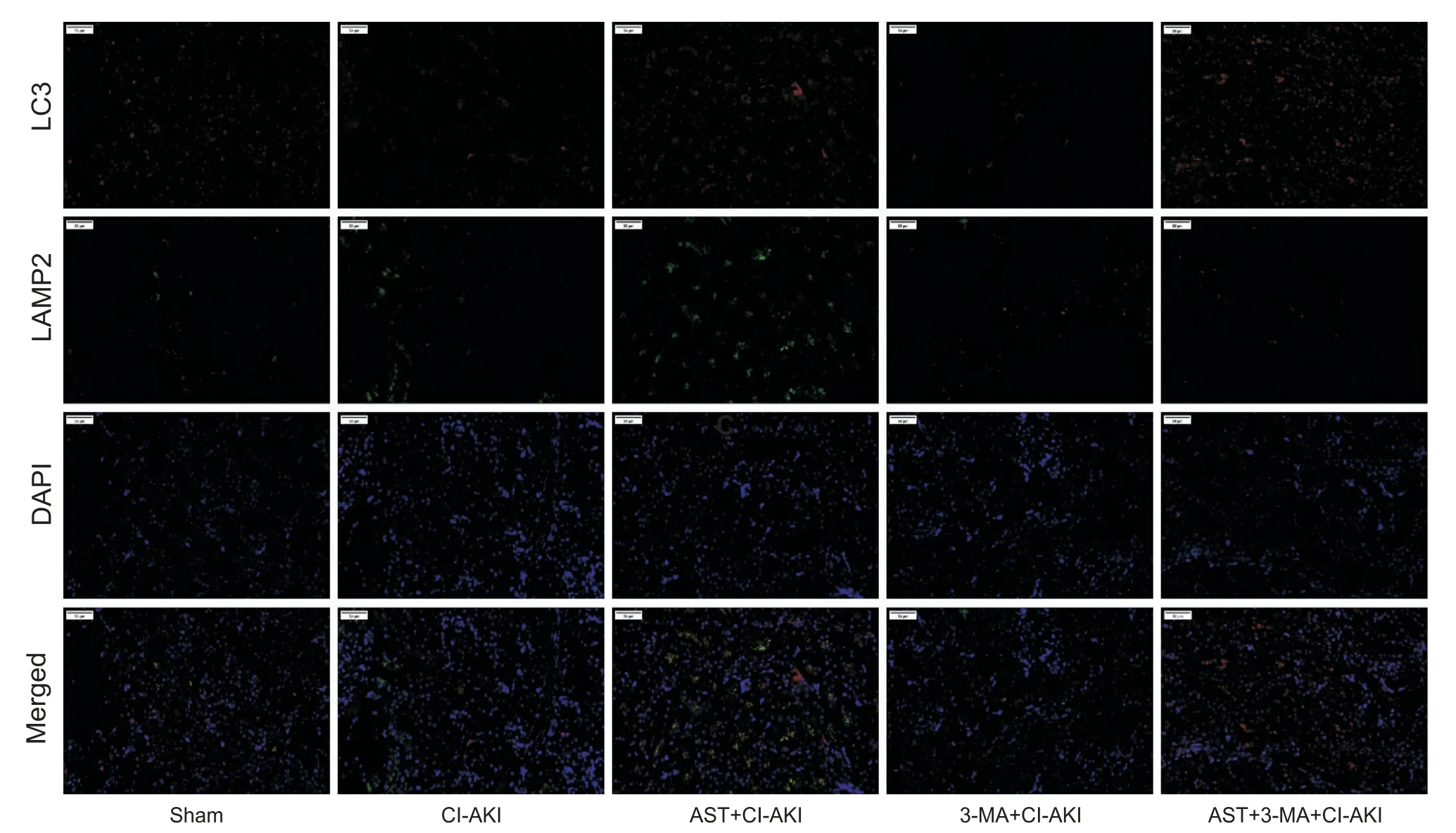
Figure 4.LC3-labeled autophagosomes(red)and LAMP2-labeled lysosomes(green)were fluorescently double-stained(scale bar=50 µm).In the sham group,the two fluorescence intensities were seen to be weak,far apart and no co-localization was seen.In the CI-AKI group,the two fluorescence intensities were seen to be slightly stronger,slightly close together and a small amount of co-localization was seen.In the AST+CI-AKI group,the two fluorescence intensities were seen to be stronger,closer together and more co-localization was seen.In the 3-MA+CI-AKI group,the two fluorescence intensities were seen to be very weak,far apart and no co-localization was seen.图4 LC3标记的自噬小体与LAMP2标记的溶酶体荧光双染
Western blot 结果见图6、7,与sham 组相比,CIAKI 组大鼠肾组织中PINK1、parkin、LC3 II/LC3 I 及LAMP2 蛋白的表达水平显著升高(P<0.05);使用AST 预处理 后,与CI-AKI 组相比,AST+CI-AKI 组PINK1、parkin、LC3 II/LC3 I 及LAMP2 蛋白表达水平显著升高(P<0.05);在自噬抑制剂干预组,与CI-AKI组相比,3-MA+CI-AKI 组大鼠肾组织中PINK1、parkin、LC3 II/LC3 I 及LAMP2 蛋白表达水平显著降低(P<0.05);联合应用AST与自噬抑制剂后,与AST预处理的AST+CI-AKI组相比,AST+3-MA+CI-AKI组大鼠肾组织中PINK1、parkin、LC3 II/LC3 I 及LAMP2 蛋白表达水平显著降低(P<0.05)。
讨 论
CI-AKI 是介入术后常见并发症之一,是造成医源性急性肾损伤的三大原因之一。目前研究CI-AKI发病机制的主要方法即为制备碘对比剂的急性肾损伤动物模型的。本研究中大鼠CI-AKI的病理改变主要以肾小管损伤为主,可见肾小管上皮细胞空泡变性、管腔狭窄和肾小管扩张等,在给予AST 预处理后,肾小管损伤可见明显减轻,说明AST 能够改善大鼠CI-AKI 的肾脏病理损害,而在使用自噬抑制剂干预的组别中,肾小管损伤有所加重。作为诊断CIAKI 传统指标的SCr 及BUN 主要反映肾小球的滤过功能,本实验中AST 预处理能明显降低大鼠SCr 及BUN,表明AST 能够减轻大鼠CI-AKI 后的肾小球损伤,在使用自噬抑制剂干预的组别中,大鼠SCr 及BUN 显著上升。由此表明,AST 能够改善大鼠CIAKI 后的肾小球滤过功能及肾小管损伤,而抑制自噬会加重肾小管及肾小球的损伤。
CI-AKI的发病机制目前公认的有以下几种:(1)碘对比剂的直接毒性作用;(2)血液动力学改变;(3)氧化应激损伤。目前认为氧化应激损伤是碘对比剂引起急性肾损伤的重要机制,碘对比剂造成肾脏的缺血缺氧,会引起ROS 的释放,并引发急性肾小管坏死[6]。
ROS 是引起氧化应激损伤的主要物质,本课题组前期研究表明[11],大鼠对比剂急性肾损伤的氧化应激主要与线粒体途径的ROS释放有关。因此减少ROS 的过量释放是缓解细胞氧化应激损伤的关键,而减少ROS的过量释放可以通过减少线粒体的分裂以及避免线粒体小碎片的破裂来实现。
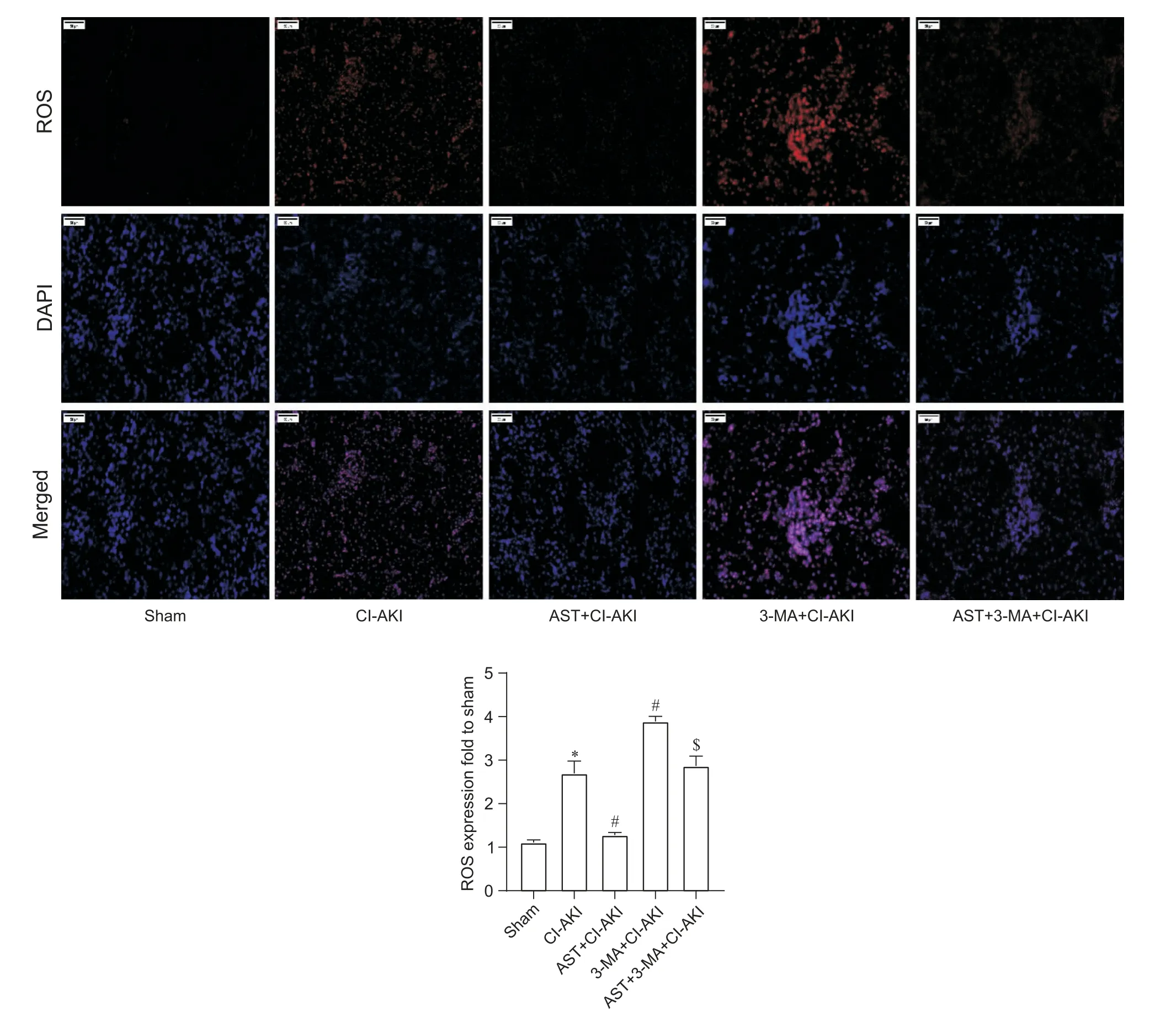
Figure 5.ROS staining of rat kidneys in each group(scale bar=50 µm).Mean±SEM. n=3.*P<0.05 vs sham group;#P<0.05 vs CIAKI group;$P<0.05 vs AST+CI-AKI group.图5 冰冻切片ROS染色
自噬是通过吞噬并降解受损细胞器从而使细胞自我修复维持相应功能,是细胞自我修复的重要途径之一。其中选择性降解线粒体的自噬,就被称为线粒体自噬。有研究表明,线粒体自噬是通过细胞自噬靶向清除受损伤的线粒体的过程,具有选择性[14]。通过增强线粒体自噬可以使得自噬小体及溶酶体降解线粒体小碎片减少ROS 的释放,阻止ROS过量产生,从而缓解氧化应激损伤。本实验研究中,通过透射电镜观察可见,在使用AST 预处理后,大鼠肾脏组织中线粒体体积增大,线粒体小碎片的产生减少,自噬小体增加,并可见自噬小体包裹线粒体小碎片,而在使用自噬抑制剂干预的组别中,可见大鼠肾组织线粒体体积较小,大量线粒体小碎片,未见自噬小体;冰冻切片ROS 染色可见,使用AST 预处理后,大鼠肾组织中ROS的表达量明显降低,而在使用自噬抑制剂干预的组别中可见大鼠肾组织ROS表达量明显上升,由此可以认为,在大鼠CI-AKI 模型中,抑制自噬会加重线粒体碎片的产生及ROS 的释放,而AST 预处理能够明显增强线粒体自噬并减少ROS的释放。

Figure 6.The protein expression of PINK1 and parkin of rats in each group.Mean±SEM. n=3.*P<0.05 vs sham group;#P<0.05 vs CI-AKI group;$P<0.05 vs AST+CI+AKI group.图6 各组大鼠肾组织PINK1和parkin的蛋白表达量
线粒体自噬是维持线粒体数量及质量的动态平衡的一种重要方式之一,PINK1/parkin通路介导的线粒体自噬是主要机制之一。PINK1 是一种靶向线粒体及激 酶[15-16]。parkin 是一个E3 泛素连接酶,与PINK1 一样,最初被认为是与帕金森病息息相关的一组蛋白[17-18]。在正常线粒体中,PINK1 被转运至线粒体内膜并被泛素-蛋白酶系统剪切及降解,当线粒体受到损伤后,PINK1 转运至线粒体内膜途径被阻断从而导致PINK1 在线粒体表面累积,自身发生磷酸化而被激活,激活的PINK1 将parkin 招募至线粒体表面并将其磷酸化,磷酸化的parkin 将线粒体膜上底物蛋白多聚泛素化,之后LC3 适配体蛋白识别多聚泛素化的底物蛋白并与之结合后,进入自噬体,再与溶酶体结合,形成自噬-溶酶体,最终将受损的线粒体降解。在已知的自噬相关基因(Autophagy-related gene,Atg)编码蛋白中,只有LC3 可以定位于所有类型的自噬膜,新生的LC3(proLC3)在合成后立即被加工成LC3 I[19],在自噬过程中,胞质中的LC3 I 通过活化酶和结合酶与磷脂酰乙醇胺结合称为LC3 II[20-21],然后LC3 II被招募到自噬体膜上,当自噬结束时,LC3 II被降解[22-23]。LAMP2构成了溶酶体中绝大多数膜蛋白,有助于自噬空泡的成熟,有利于自噬溶酶体中细胞质蛋白的选择性导入和降解[24-25]。在本实验研究中,使用AST 预处理后,LC3 及Hsp60 免疫荧光双染可见,两者共定位信号有明显增强,LC3 及LAMP2 免疫荧光双染后,两者共定位信号也明显增强,同时PINK1 和parkin 蛋白表达量明显上升,LC3 II/LC3 I 及LAMP2 蛋白表达量也有明显上升,表明AST 能够通过上调PINK1/parkin 通路增强线粒体自噬。
AST 已被证实除具有抗氧化能力外,还具有抗炎、调节脂质及糖代谢的能力,且能够预防动脉粥样硬化、高血压及血脂异常等疾病,对心血管系统有益[26]。同时AST 在肾脏相关疾病的动物及细胞实验中也表现出较好的治疗能力[27-28]。我们的研究结果表明大鼠CI-AKI 模型经过AST 预处理后,ROS 表达水平明显降低,T-SOD及MDA水平也有相应表现,同时线粒体自噬效应明显增强,相应的线粒体自噬相关蛋白PINK1 及parkin 表达均有所上调,且于自噬小体与溶酶体产生相关的LC3 II/LC3 I 及LAMP2 蛋白也有相应的上升,这与既往实验结果相似[29-32],由此我们推测AST 通过上调PINK1/parkin 通路,增强线粒体自噬,减少ROS的释放,减轻氧化应激损伤缓解大鼠对比剂急性肾损伤。本研究为对比剂急性肾损伤的防治提供新的实验依据,但AST 对肾脏的保护机制仍需进一步的研究。
