糖皮质激素对晚期肿瘤患者免疫疗效影响的Meta分析
2022-09-01刘申香路国涛殷旭东
叶 倩,凌 志,刘申香,路国涛,殷旭东
(扬州大学附属医院 a.肿瘤科;b.消化内科,江苏 扬州 225100)
肿瘤内科治疗已经进入免疫治疗时代,以程序性死亡蛋白-1(programmed death-1,PD-1)/程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)、细胞毒性T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte antigen 4,CTLA-4)为靶点的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在晚期非小细胞肺癌、黑色素瘤、霍奇金淋巴瘤、微卫星高度不稳定性结直肠癌等肿瘤治疗中取得了巨大成功[1-3]。纳武利尤单抗、帕博利珠单抗、阿特珠单抗、德瓦鲁单抗相继被批准用于非小细胞肺癌一线或者二线治疗[4-7]。糖皮质激素(glucocorticoid,GC)常用于处理肿瘤的并发症、免疫相关不良反应以及免疫联合化疗前的预处理。ICIs治疗早期,GC常用于化疗前的预处理或者降低颅内高压、疲劳、呼吸困难等多种并发症,在ICIs治疗后期,GC常用来处理较严重的免疫相关不良反应。一些研究报道[8-9],在ICIs治疗早期使用GC(主要指开始ICIs治疗的30天内)对ICIs疗效有较明显的抑制作用,但是Pinato等[10]却认为GC的使用不会影响患者的总生存率,且进一步证实GC使用的时间和剂量不影响免疫治疗患者的预后。Arbour等[8]研究则认为GC用药(泼尼松≥10 mg/d)会降低非小细胞肺癌的疗效,并且剂量越高,疗效减低可能会越明显。一些研究报道,当GC用于缓解和减轻免疫相关不良反应时,并未显著影响患者的生存时间和疾病进展的时间[11-13]。最近,Pinato等[10]一项关于GC对ICIs治疗肝细胞癌预后影响的研究发现,GC用于治疗肿瘤相关并发症的患者预后较差,主要归因于自身合并其他预后不良的因素,而并不一定是GC对ICIs疗效的抑制作用所致。GC对免疫治疗患者预后的影响是一个很有争议的问题。因此,本荟萃分析对相关的研究进行收集和整理,以探讨GC对接受ICIs治疗患者预后的影响。
1 资料与方法
1.1检索策略 将immunotherapy、immune checkpoint inhibitors、PD-1 antibody、PD-L1 antibody、CTLA-4、inhibitor、glucocorticoid、corticosteroid、steroid、survival、 overall survival、progression-free survival、cancer、tumor、carcinoma”作为关键词,使用PubMed、Wiley、Web of Science和Cochrane Library数据库检索2020年10月以前发表的文章,对全文进行评价,分析是否含有GC与接受免疫治疗患者预后相关性的信息。
1.2纳入标准 (1)文献纳入标准如下:①英文全文;②涉及GC对ICIs治疗疗效影响的相关研究;③包含有总生存期(OS)、无进展生存期(PFS)、生存曲线、风险比(hazard ratio,HR)及95%置信区间(CI)等数据的全文。(2)文献排除标准如下:①会议摘要;②综述、审稿意见和信件;③案例报告;④动物或者体外研究。
1.3文献筛选、数据整理和质量评价 2名研究者将检索到的文献导入Endnote X9文献管理器中。首先剔除重复文献,然后根据纳入与排除标准阅读文献标题、摘要和全文剔除研究内容不符合的文献。其间意见不统一时通过讨论或由第3名研究者裁决,最终确定纳入文献。2名研究者将最终纳入研究的相关数据包括第一作者、发表年份、地区、中位随访时间、总样本量、肿瘤类型、ICIs种类、GC治疗(GC类型、暴露率、ICIs开始治疗前后GC持续时间、治疗目的)、生存数据(PFS、OS)的HR值和95%CI进行整理录入Excel以供分析。2名研究者采用纽卡斯尔-渥太华量表(Nottingham-Ottawa-Scale,NOS)独立完成质量评价,从研究的设计、可比性、研究结果3个领域评估纳入的文献,≥7分的文献被认为是高质量。
1.4统计学方法 采用Review Manager 5.3软件和Stata14.0软件进行Meta分析,OS、PFS等生存资料采用HR及95%CI作为效应分析统计量。采用I2检验(检验水准I2>50%)评估各项研究之间的异质性;I2>50%被定义为研究结果之间存在异质性;若存在异质性,则采用随机效应模型合并分析数据,减少异质性对结果的影响;反之,则采用固定效应模型进行分析。采用Begg秩相关法对潜在的发表偏倚进行评估, 逐篇排除法进行敏感性分析。P<0.05表示差异有统计学意义。
2 结 果
2.1文献检索结果 共检索出492篇文献,剔除重复的72篇文献,通过阅读题名和摘要剔除172篇不符合标准的文献,进一步阅读全文,剔除效应值无法从原文获取或估算的文献。最终,23篇文献被纳入荟萃分析。其中,2篇文献的研究进行了分组分析,一项研究依据GC适应证分组,另一项研究依据肿瘤类型分组,见图1。
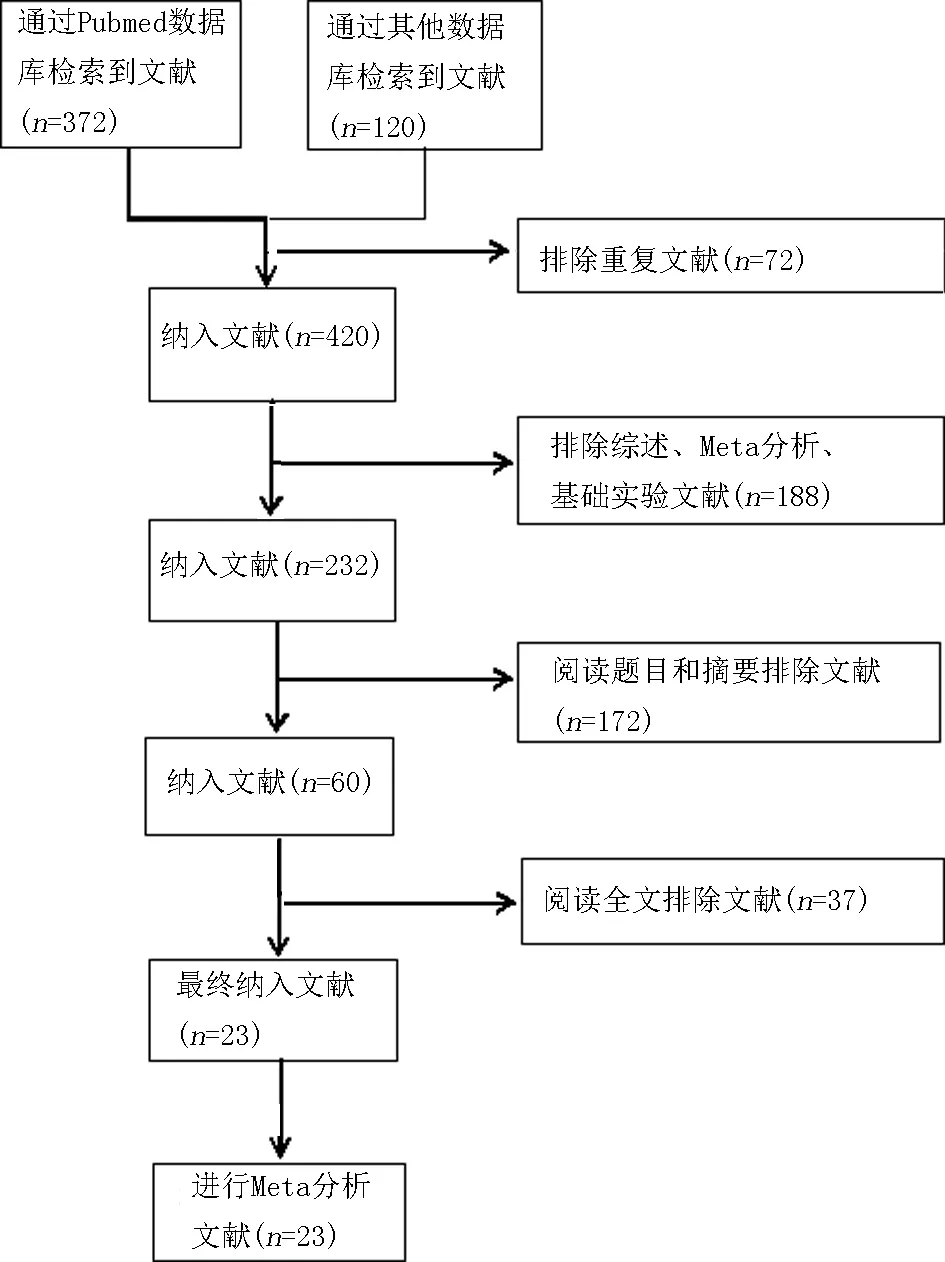
图1 文献筛选流程
2.2文献特征 纳入的23项研究[8,11-32],5项在日本进行,5项在法国进行,9项在美国进行,2项在澳大利亚进行,1项在意大利进行,1项在多个国家进行。23篇文献均为回顾性研究。除3项研究纳入不同癌种的受试者外,其余20项研究纳入为单个癌种的患者。在接受免疫治疗的患者中,大多数患者接受ICIs单药治疗,少数接受CTLA-4抑制剂或者联合治疗。GC使用原因主要包括治疗肿瘤引起的相关不良反应以及治疗免疫相关不良事件,使用GC的时间从ICIs开始治疗前1个月到治疗后8周不等。大部分纳入研究的NOS评分≥7分,属于中等或者高等质量研究[33],见表1~2。

表1 研究的一般特征

表2 接受ICIs治疗患者的GC使用特点
2.3OS的Meta分析 18篇文献报告了使用GC对ICIs治疗晚期肿瘤OS的影响。18项研究之间有较高的异质性(I2=76%,P<0.01),采用随机效应模型进行分析。结果显示,在接受ICIs治疗的患者中,GC使用与OS呈负相关(HR=1.54, 95%CI=1.29~1.83,P<0.01),见图2。
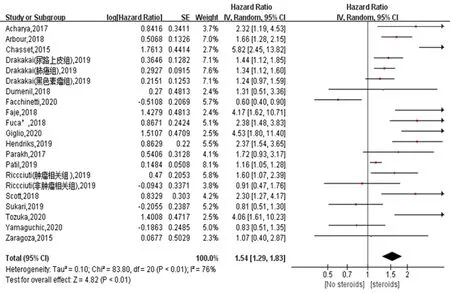
图2 接受ICIs治疗的患者中使用GC者与未使用GC者OS森林图 注:steroids:糖皮质激素;no steroids:无糖皮质激素
2.4无进展生存期的Meta分析 16篇文献报告了使用GC对ICIs治疗晚期肿瘤无进展生存期的影响。16项研究之间有较高的异质性(I2=78%,P<0.01),采用随机效应模型进行分析。结果显示,在接受ICIs治疗的患者中,GC使用与PFS呈负相关(HR=1.82, 95%CI=1.36~2.43,P<0.01),见图3。
2.5亚组分析 本研究对肿瘤类型(非小细胞肺癌、黑色素瘤和尿路上皮癌)、ICIs的种类(抗PD-L1/PD-1、抗CTLA-4和其他)、GC的适应证(肿瘤相关症状和非肿瘤相关症状)、国家、研究类型进行亚组分析。基于不同癌种的亚组分析结果显示,肺癌组与黑色素瘤组在免疫治疗期间使用GC明显影响PFS和OS。在对免疫治疗药物的亚组分析中,可以发现无论单药抗CTLA-4治疗组、抗PD-L1/PD-1治疗组或者联合治疗组,GC的使用都与患者的PFS和OS显著相关。且GC的使用对抗CTLA-4治疗组PFS和OS的影响大于其他治疗组。在分析GC的使用适应证与OS、PFS的相关性时,使用GC治疗肿瘤相关症状(如脑转移、癌性疼痛)时会显著影响患者的PFS和OS。但是GC治疗非肿瘤相关症状(如免疫不良事件、慢性阻塞性肺疾病和自身免疫病)时对PFS和OS的影响不大,见表3。
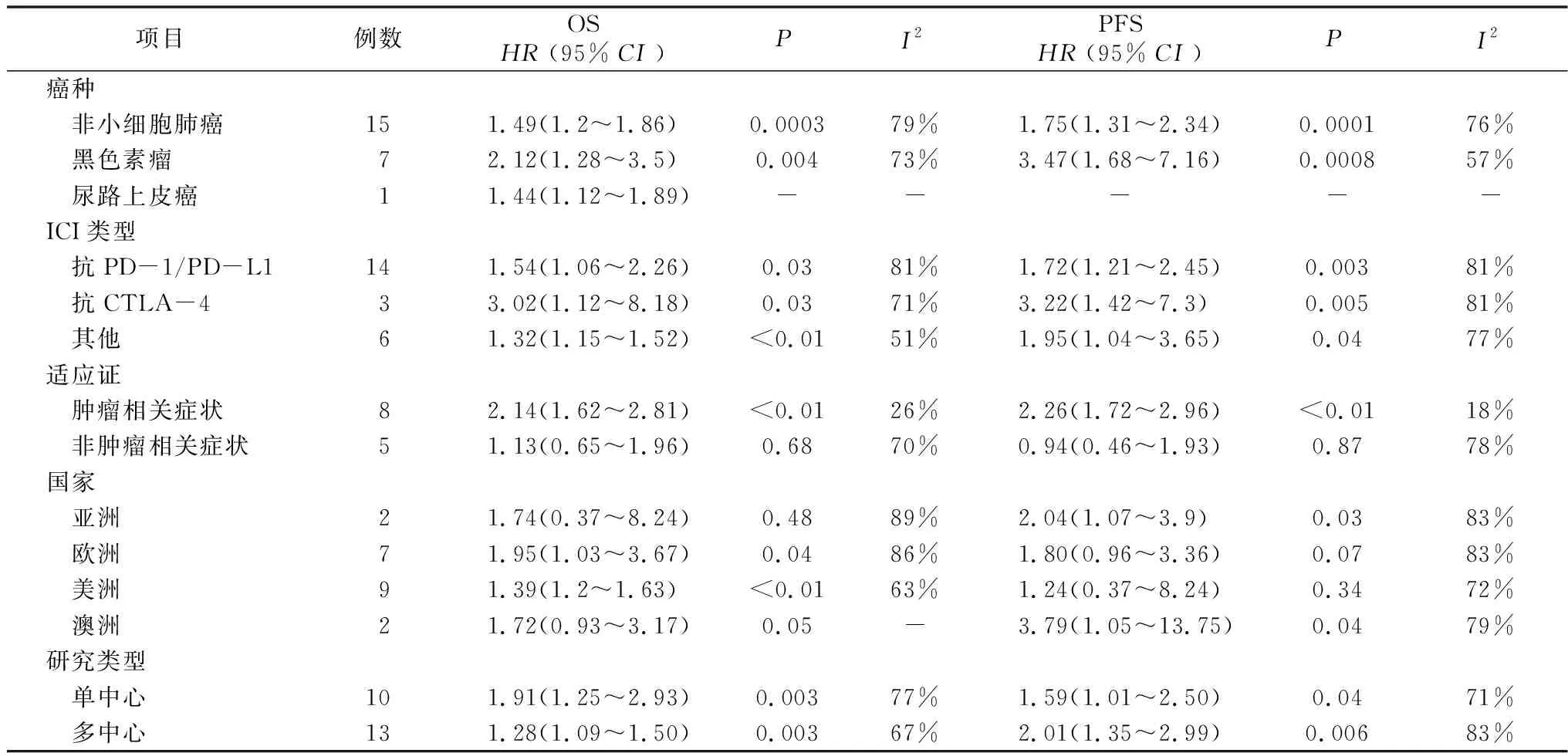
表3 接受ICIs治疗的患者中使用GC者与未使用GC者OS亚组分析
2.6发表偏倚和敏感性分析 采用Egger回归法和Begg秩相关法对PFS(Egger test:P=0.221和Begg test:P=0.303)和OS(Egger test:P=0.034和Begg test:P=0.156)的发表偏倚进行评估,结果显示漏斗图左右基本对称,呈倒漏斗状,各项研究之间不存在发表偏倚,纳入研究的结果基本可靠。通过逐篇剔除纳入文献的方式进行敏感性分析,其结果显示针对PFS和OS的Meta分析结果稳定、可靠,见图4~5。
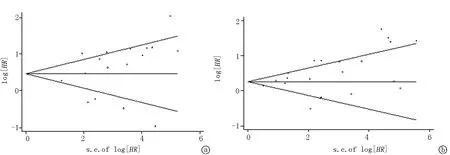
图4 关于GC使用与免疫疗效的漏斗分析图 a.PFS;b. OS
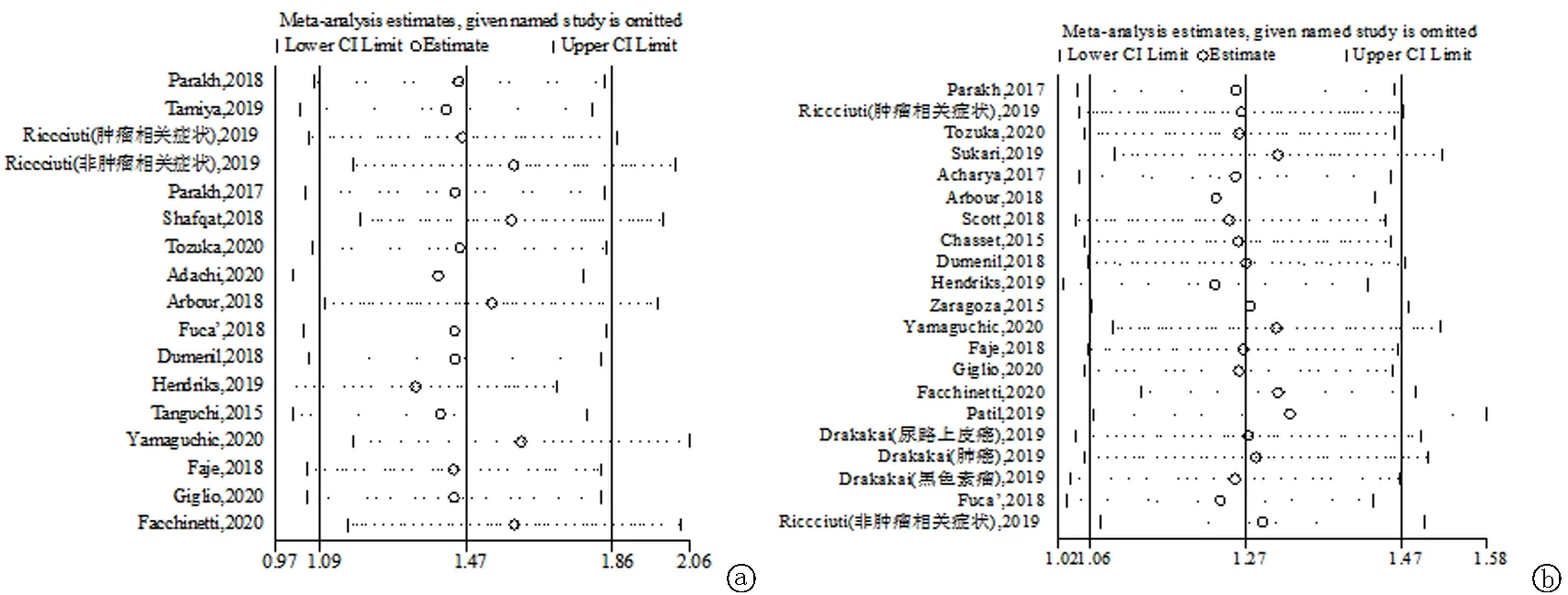
图5 分别移除每篇文献后的敏感性分析 a.PFS;b.OS
3 讨 论
目前已有许多关于探究GC与免疫治疗疗效关系的前瞻性或者回顾性研究,但研究的结果存在分歧。我们对纳入的23篇文献进行Meta分析,评价GC与免疫治疗疗效的关系。研究显示,在免疫治疗期间,GC使用与患者预后相关。GC的影响可能取决于用药的适应证,免疫治疗的患者因为肿瘤相关疾病比如脑转移症状、疲劳、癌性疼痛等使用GC相比于未使用或者小剂量使用GC对患者的PFS和OS有负面影响,而因为非肿瘤相关疾病比如免疫相关不良反应、自身免疫性疾病、合并症的进展等原因使用GC时对PFS和OS无影响。此外,GC的使用对PFS和OS的影响与ICIs的种类和肿瘤的类型无关。Petrelli等[34]一项关于类固醇使用与ICIs治疗患者预后关系的系统综述和荟萃分析与我们的结果相似。即在免疫治疗期间,接受GC治疗之后,患者PFS和OS有不良结局,进一步亚组分析的结果表示这种负面影响与GC的适应证相关。使用GC进行支持治疗对PFS和OS有明显不利影响,而GC用于治疗免疫相关不良反应时对PFS和OS无负面影响。
在肿瘤免疫治疗时代,一些临床研究表明免疫治疗对肿瘤患者治疗的效果不容乐观,需要更多的研究探讨免疫治疗的机制,减少削弱免疫治疗效果的因素。GC抑制免疫功能的机制可能与以下因素有关。免疫抑制剂是针对PD-1和PD-L1或CTLA-4的单克隆抗体,其作用是使细胞毒性T淋巴细胞重新获得攻击肿瘤细胞的能力[35],但是GC可通过诱导T细胞的凋亡、抑制白介素-2 (IL-2)介导的效应T细胞的增殖活化、促进PD-1和CTLA-4表达及增加Treg的数目比例等多种机制[36],对T细胞活性产生抑制作用。T淋巴细胞的减少削弱了抗肿瘤免疫反应能力。同时,GC可以诱导M2巨噬细胞极化和微生物群的变化[37],从而促进肿瘤的发生发展。此外,Giles等[38]在动物实验的研究结果表明地塞米松通过削弱CD28共刺激因子阻断幼稚T细胞的增殖和分化。一些研究表明免疫相关不良反应出现意味着抗肿瘤免疫反应已到达最强,GC治疗免疫相关不良反应总是在治疗后期使用,此时使用治疗剂量GC会使免疫反应不至于过强,而并不影响免疫系统的抗肿瘤反应。这可以解释在免疫治疗期间,使用GC处理免疫相关事件时对患者PFS和OS无明显影响。
本研究存在一定局限性:(1)本研究纳入的文献都是回顾性研究,无法获得原始数据,这些研究中存在许多混杂因素,比如高龄、厌食、体重减轻和KPS评分>2分等可能是不良预后因素,影响疗效分析;(2)纳入研究异质性较强,且异质性的程度不能在亚组分析中明确消除,这种异质性可能源于患者临床特征的差异以及其他混杂因素;(3)本次研究仅能说明GC的使用与ICIs疗效之间可能存在联系。这一结论还需要进行大规模的、良好的前瞻性研究来评估。尽管存在上述的局限性,但是本研究有助于临床医生对肿瘤患者的病情进行充分评估以制定合理的治疗方案,提高ICIs的疗效。
综上所述,在免疫治疗期间,使用GC处理免疫相关不良反应时,似乎并不能对患者的PFS和OS产生不利影响,可以安全用药。相反,GC治疗肿瘤相关症状时可能会影响免疫治疗的疗效,临床医师需要更加的谨慎,必要时进行一个多学科的讨论,寻找GC的替代治疗,避免大剂量、长时间的使用GC。为了让肿瘤患者从免疫治疗中更大的获益,仍然需要开展更多大样本的前瞻性研究来进行评估,为肿瘤免疫治疗提供理论支持。
