二肽基肽酶-4通过CXCR4/mTOR信号通路介导小鼠肺泡巨噬细胞MH-S自噬的机制研究
2022-08-31杨帆邓璐陈睦虎
杨帆,邓璐,陈睦虎
(西南医科大学附属医院1.急诊科,2.甲状腺外科,四川 泸州 646000)
肺巨噬细胞是免疫细胞的一种,能够吞噬外来病原体及人体衰老的细胞,同时肺巨噬细胞参与特异性免疫,刺激细胞因子的分泌[1-2]。多种肺疾病的病理特征均由炎症细胞及细胞因子导致,在其发病过程中,肺巨噬细胞发挥着重要作用。目前认为肺巨噬细胞在一些细菌或有害物质的刺激下,分泌大量炎症因子,部分因子又可趋化中性粒细胞等向肺部迁移,最终引起气道炎症或损伤,加重疾病[3]。因此,有效抑制炎症因子的释放对肺疾病的治疗具有重要意义。自噬是调节肺巨噬细胞吞噬、杀伤,以及调节细胞因子的重要机制,能够调控机体免疫系统[4]。本课题组前期研究发现,脂多糖(Lipopolysaccharide,LPS)能诱导肺巨噬细胞自噬。目前有多项研究表明,肺损伤及炎症反应与肺巨噬细胞炎性小体有关,因此推测肺巨噬细胞的自噬过程能够调控炎症反应[5-6]。二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)在肺巨噬细胞中大量表达,参与细胞免疫、自噬等多种生物学过程,目前DPP-4 对趋化因子及细胞因子的调控作用已得到证实[7-8]。本研究探究DPP-4 通过CXCR4/mTOR 通路对小鼠肺巨噬细胞自噬的机制,现报道如下。
1 材料与方法
1.1 细胞来源及培养
小鼠肺泡巨噬细胞MH-S 购自上海酶研生物科技有限公司。取出液氮冻存的MH-S 细胞,恢复至室温后转移至25 mL 培养瓶,同时加入15 mL 含10%胎牛血清的达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM)培养液,在37℃、5%二氧化碳培养箱中培养24 h。
1.2 主要试剂及仪器
1.2.1 主要试剂DPP-4 表达病毒、si-DPP-4 病毒载体(上海钰博生物科技有限公司),白细胞介素1β(Interleukin-1β,IL-1β)、白细胞介素6(Interleukin-6,IL-6)及肿瘤坏死因子-α(tumor necrosis factor-ɑ,TNF-ɑ)酶联免疫试剂盒(上海广锐生物科技有限公司),转染试剂盒(上海研卉生物科技有限公司),TRIzol、逆转录试剂盒(上海雅吉生物科技有限公司),实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)试剂盒(上海一研生物科技有限公司),DPP-4、mTOR 兔抗大鼠一抗(1 mg/mL)及山羊抗兔二抗(1 mg/mL)(上海圻明生物科技有限公司),CXCR4兔抗大鼠一抗(1 mg/mL)及山羊抗兔二抗(1 mg/mL)(上海康朗生物科技有限公司)。
1.2.2 主要仪器倒置荧光显微镜(型号:Echo Revolve,北京普迈精医科技有限公司),酶标仪(型号:LONZA ELx808,北京泽平科技有限责任公司),全自动生化分析仪(型号:PUZS-300,上海帝博思生物科技有限公司)。
1.3 细胞分组及干预
取对数生长期的MH-S 细胞,接种于6 孔板,每孔取1×105个细胞继续贴壁生长,当细胞融合75%~85%时进行转染。分别设置PBS 组、LPS 组、DPP-4 组,si-DPP-4 组、DPP-4 + BafA1 组及si-DPP-4+BafA1 组。
PBS 组仅为PBS 培养的MH-S 细胞;LPS 组在MH-S 细胞中加入100 ng/mL LPS,诱导培养24 h;DPP-4 组在LPS 组的基础上,加入100 nmol/L DPP-4表达病毒转染MH-S 细胞;si-DPP-4 组在LPS 组的基础上,加入100 nmol/L si-DPP-4 病毒载体转染MH-S 细胞;DPP-4 + BafA1 组 在LPS 组的基础上,在DPP-4 表达病毒转染MH-S 细胞中加入自噬抑制剂BafA1 干预;si-DPP-4 + BafA1 组在LPS 组的基础上,在si-DPP-4 病毒载体转染的MH-S 细胞中加入自噬抑制剂BafA1 干预。
1.4 细胞转染
根据细胞分组进行操作,每孔加入1 mL 病毒稀释液(病毒感染复数=100,DMEM 培养液1∶99),具体操作步骤参考转染试剂盒说明书,转染48 h 后,采用绿色荧光蛋白(green fluorescent protein,GFP)检测转染效率,当转染效率>70%时,可用于后续实验[9]。
1.5 酶联免疫吸附试验检测MH-S 细胞上清液炎症因子水平
取各组MH-S 细胞培养液,离心取上清液,采用酶联免疫吸附试验试剂盒检测MH-S 细胞IL-1β、IL-6 及TNF-ɑ 水平,向稀释后的标准品中加入MH-S 细胞上清液50 μL,混匀后于恒温水浴锅中温育0.5 h,分别加入50 μL 酶标志物、50 μL 显色剂A、50 μL 显色剂B 及50 μL 终止液,用酶标仪检测各孔450 nm 处吸光度,根据IL-1β、IL-6 及TNF-ɑ 的标准曲线计算其相应浓度[10]。每组有4 个复孔,实验均重复3 次,取均值。
1.6 腺病毒检测MH-S细胞自噬流变化
取各组稳定转染的MH-S 细胞,接种于12 孔板上,孔内铺放细胞爬片,加入携带mRFP-GFP-LC3的腺病毒,进行贴壁生长,当细胞融合度为70%时,移除上清液,PBS 冲洗3 次,加入4%多聚甲醛固定,再冲洗3 次,加入抗荧光猝灭封片液进行封片,于荧光显微镜下观察自噬流的变化,即GFP、红色荧光蛋白(red fluorescent protein,RFP)及其合并通道(黄色)[11]。GFP 减弱表明自噬小体与溶酶体融合,形成自噬溶酶体。
1.7 qRT-PCR 检 测DPP-4、CXCR4、mTOR mRNA的表达
取各组稳定转染的MH-S 细胞,采用TRIzol 试剂盒提取MH-S 细胞总RNA,检测RNA 浓度及纯度。采用逆转录试剂盒,以RNA 为模板,通过逆转录得到cRNA。设置20 μL 的PCR 反应体系:cDNA模板1 μL,SYBR 10 μL,正、反向引物各0.5 μL,纯水8 μL;反应体系设置完成后进行扩增,反应条件:95℃预变性2 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40 个循环。根据2-ΔΔCt法计算DPP-4、CXCR4、mTOR 相对表达量[12],引物序列见表1。

表1 qRT-PCR引物序列
1.8 Western blottig 检测CXCR4/mTOR 通路蛋白的表达
取各组稳定转染的MH-S 细胞,加入适量裂解液裂解混匀,裂解MH-S 细胞,1 500 r/min 离心20 min,取上清液进行免疫凝胶电泳,分离CXCR4、mTOR 蛋白条带,并采用湿膜法转移到PVDF 膜上,5%脱脂奶粉封闭2 h,将PVDF 膜分别在含有一抗(1∶500 稀释)及二抗(1∶1 000 稀释)的孵育盒中孵育,孵育后PBS 冲洗3 次进行显影、定影,分析相应灰度值,目的蛋白相对表达量=目的蛋白/β-actin 灰度值[13]。
1.9 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义
2 结果
2.1 MH-S细胞转染情况
正常MH-S 细胞形态均匀,呈梭形,而转染后细胞一般成簇存在,呈漩涡样生长,经绿色荧光蛋白标记后,细胞在荧光显微镜下呈绿色荧光。见图1。
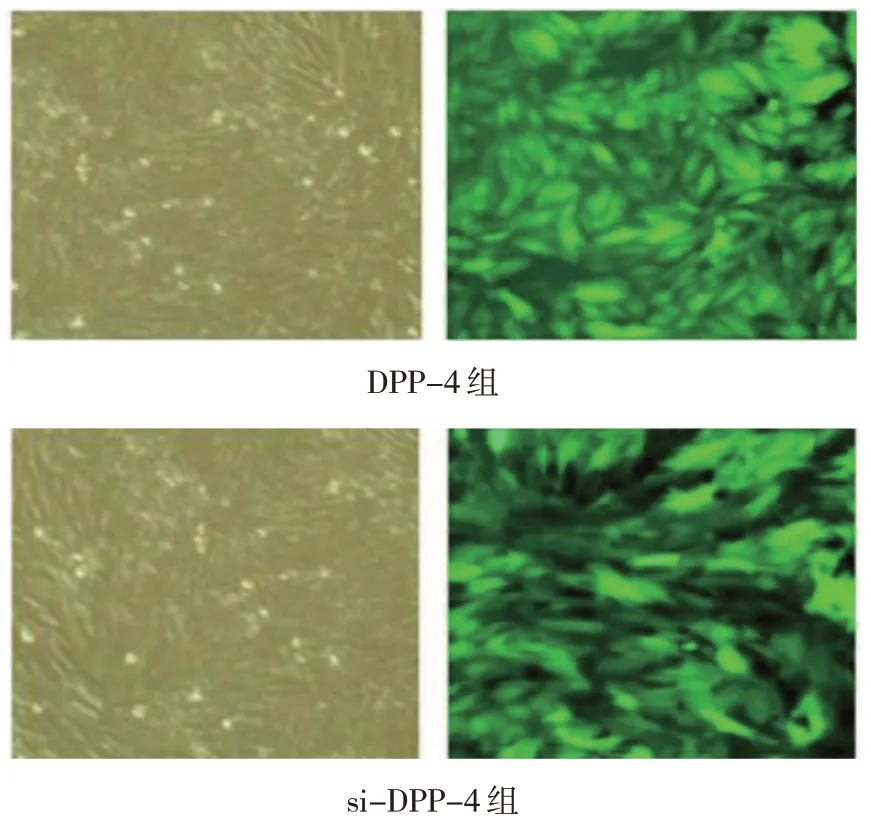
图1 MH-S细胞转染图 (左图:×100,右图:×200)
2.2 各组MH-S细胞上清液炎症因子水平比较
各组IL-1β、IL-6 及TNF-α 水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:LPS 组IL-1β、IL-6 及TNF-α 高于PBS 组(P<0.05);DPP-4 组与LPS 组IL-1β、IL-6 及TNF-α 水平比较,差异无统计学意义(P>0.05);si-DPP-4 组IL-1β、IL-6 及TNF-α 高于LPS 组(P<0.05);si-DPP-4组和DPP-4 + BafA1 组IL-1β、IL-6 及TNF-α 高于DPP-4 组(P<0.05);si-DPP-4 + BafA1 组IL-1β、IL-6高于si-DPP-4 组(P<0.05)。见表2。
表2 各组MH-S细胞上清液炎症因子水平比较(ng/mL,±s)
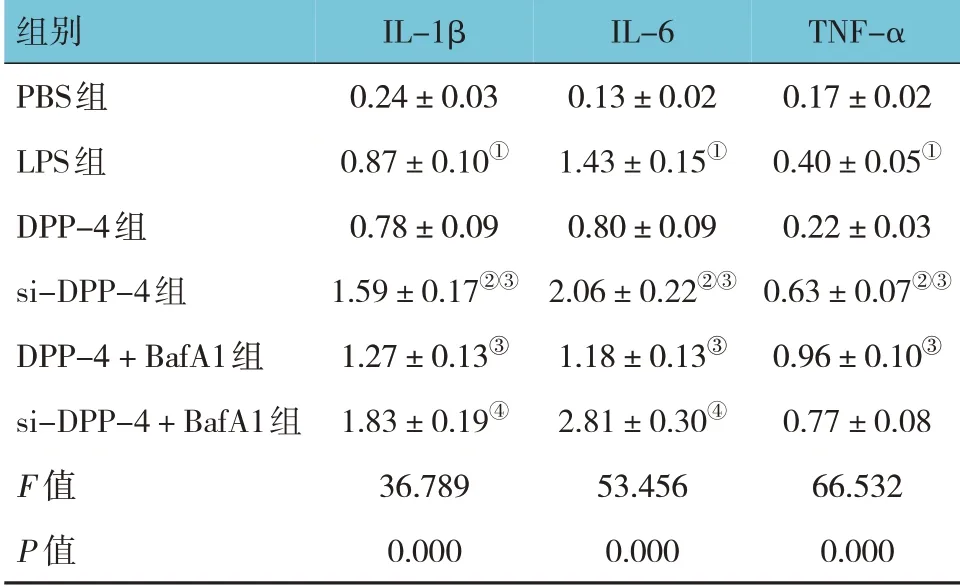
表2 各组MH-S细胞上清液炎症因子水平比较(ng/mL,±s)
注:①与PBS组比较,P<0.05;②与LPS组比较,P<0.05;③与DPP-4组比较,P<0.05;④与si-DPP-4组比较,P<0.05。
TNF-α 0.17±0.02 0.40±0.05①0.22±0.03 0.63±0.07②③0.96±0.10③0.77±0.08 66.532 0.000组别PBS组LPS组DPP-4组si-DPP-4组DPP-4+BafA1组si-DPP-4+BafA1组F 值P 值IL-1β 0.24±0.03 0.87±0.10①0.78±0.09 1.59±0.17②③1.27±0.13③1.83±0.19④36.789 0.000 IL-6 0.13±0.02 1.43±0.15①0.80±0.09 2.06±0.22②③1.18±0.13③2.81±0.30④53.456 0.000
2.3 各组MH-S细胞自噬流的变化
各组MH-S 细胞GFP、RPF 及Merge 数量比 较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:LPS 组GFP、RPF 及Merge 数量高于PBS 组(P<0.05);DPP-4 组GFP、RPF 及Merge 数量高于LPS 组(P<0.05);si-DPP-4 组GFP、RPF 及Merge 数量低于LPS 组(P<0.05);si-DPP-4 组和DPP-4+BafA1 组GFP、RPF 及Merge 数量低于DPP-4组(P<0.05);si-DPP-4 + BafA1 组GFP、RPF 及Merge数量低于si-DPP-4 组(P<0.05)。见表3和图2。

图2 各组MH-S细胞自噬流的变化 (×400)
表3 各组MH-S细胞GFP、RPF及Merge数量比较 (个/细胞,±s)

表3 各组MH-S细胞GFP、RPF及Merge数量比较 (个/细胞,±s)
注:①与PBS组比较,P<0.05;②与LPS组比较,P<0.05;③与DPP-4组比较,P<0.05;④与si-DPP-4组比较,P<0.05。
组别PBS组LPS组DPP-4组si-DPP-4组DPP-4+BafA1组si-DPP-4+BafA1组F 值P 值Merge 104.83±10.68 171.66±17.83①199.67±20.56②97.68±9.96②③138.34±15.75③77.98±8.02④318.456 0.000 GFP 106.68±0.07 169.70±0.08①221.64±0.17②95.75±0.04②③133.58±0.17③79.45±8.17④364.897 0.000 RPF 156.97±16.86 201.55±22.64①274.75±30.54②138.73±14.47②③189.29±18.68③119.68±21.65④495.588 0.000
2.4 各组MH-S 细胞DPP-4、CXCR4、mTOR mRNA相对表达量比较
各组DPP-4、mTOR、CXCR4 mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:LPS 组CXCR4、mTOR mRNA相对表达量高于PBS 组(P<0.05);DPP-4 组DPP-4 mRNA 相对表达量高于LPS 组(P<0.05),CXCR4、mTOR mRNA 相对表达量低于LPS 组(P<0.05);si-DPP-4 组DPP-4 mRNA 相对表达量低于DPP-4 组(P<0.05),CXCR4、mTOR mRNA 相对表达量高于DPP-4 组(P<0.05);DPP-4 + BafA1 组CXCR4、mTOR mRNA 相对表达量高于DPP-4 组(P<0.05);si-DPP-4 + BafA1 组CXCR4、mTOR mRNA 相对表达量高于si-DPP-4 组(P<0.05)。见表4。
表4 各组M H-S细胞DPP-4、CXCR4、mTOR mRNA相对表达量比较 (±s)
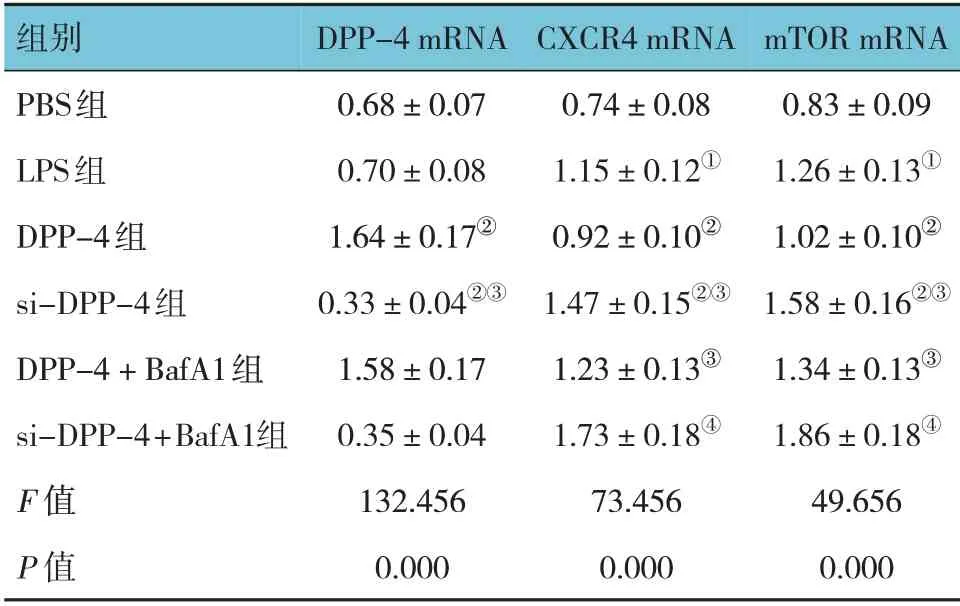
表4 各组M H-S细胞DPP-4、CXCR4、mTOR mRNA相对表达量比较 (±s)
注:①与PBS组比较,P<0.05;②与LPS组比较,P<0.05;③与DPP-4组比较,P<0.05;④与si-DPP-4组比较,P<0.05。
mTOR mRNA 0.83±0.09 1.26±0.13①1.02±0.10②1.58±0.16②③1.34±0.13③1.86±0.18④49.656 0.000组别PBS组LPS组DPP-4组si-DPP-4组DPP-4+BafA1组si-DPP-4+BafA1组F 值P 值DPP-4 mRNA 0.68±0.07 0.70±0.08 1.64±0.17②0.33±0.04②③1.58±0.17 0.35±0.04 132.456 0.000 CXCR4 mRNA 0.74±0.08 1.15±0.12①0.92±0.10②1.47±0.15②③1.23±0.13③1.73±0.18④73.456 0.000
2.5 各组MH-S 细胞CXCR4/mTOR 通路蛋白相对表达量比较
各组CXCR4、p-mTOR/mTOR 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:LPS 组CXCR4、p-mTOR/mTOR 蛋白相对表达量高于PBS 组(P<0.05);DPP-4组CXCR4、p-mTOR/mTOR 蛋白相对表达量低于LPS组(P<0.05);si-DPP-4 组 和DPP-4 + BafA1 组CXCR4、p-mTOR/mTOR 蛋白相对表达量高于DPP-4组(P<0.05);si-DPP-4 + BafA1 组CXCR4、p-mTOR/mTOR 蛋白相对表达量高于si-DPP-4 组(P<0.05)。见表5和图3。
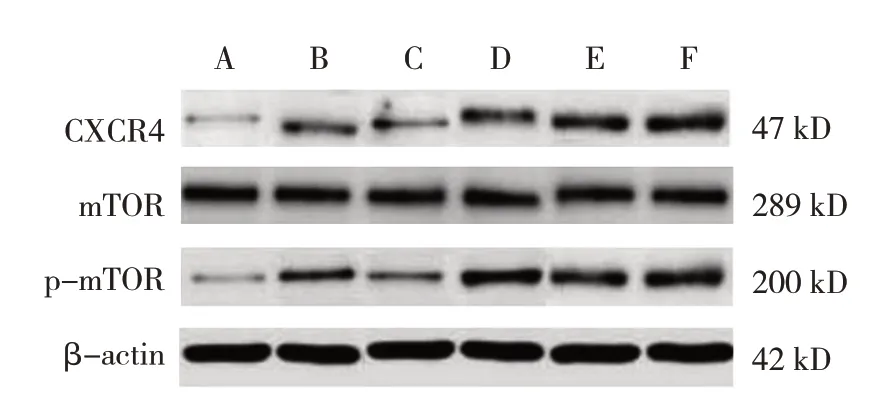
图3 各组MH-S细胞CXCR4/mTOR通路蛋白的表达
表5 各组MH-S细胞CXCR4/mTOR通路蛋白相对表达量比较 (±s)
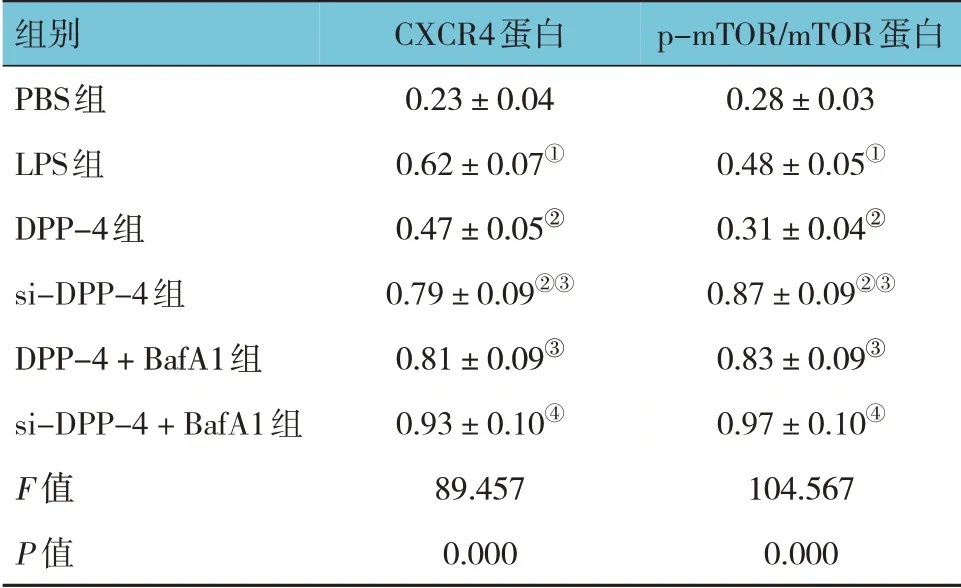
表5 各组MH-S细胞CXCR4/mTOR通路蛋白相对表达量比较 (±s)
注:①与PBS组比较,P<0.05;②与LPS组比较,P<0.05;③与DPP-4组比较,P<0.05;④与si-DPP-4组比较,P<0.05。
p-mTOR/mTOR蛋白0.28±0.03 0.48±0.05①0.31±0.04②0.87±0.09②③0.83±0.09③0.97±0.10④104.567 0.000组别PBS组LPS组DPP-4组si-DPP-4组DPP-4+BafA1组si-DPP-4+BafA1组F 值P 值CXCR4蛋白0.23±0.04 0.62±0.07①0.47±0.05②0.79±0.09②③0.81±0.09③0.93±0.10④89.457 0.000
3 讨论
细胞自噬是机体重要的生物学过程,能够调节细胞代谢平衡,促进增殖分化等,在非生理状态下自噬作用被激活,能够调控多种细胞因子,发挥保护细胞的作用[14]。肺巨噬细胞在免疫应答过程中发挥重要作用。多数研究认为,肺巨噬细胞的自噬作用在动脉粥样硬化、尘肺及癌症等多种疾病中均有积极作用[15]。DPP-4 在肺巨噬细胞中大量表达,在细胞自噬过程中具有一定作用。在郑文彬[16]的研究中,DPP4 抑制剂(西格列汀)具有降糖作用,同时还可以通过抑制NF-κB 和JNK/AP1 通路减轻肝脏炎症,上调AMPK/mTOR 信号通路增强细胞自噬作用,进而改善肝脂肪变性,表明DPP-4 参与细胞炎症及自噬作用的调节过程。国外有研究显示,DPP-4 对mTOR 通路有一定的调控作用[17],因此推测DPP-4可能通过mTOR 通路介导小鼠肺泡巨噬细胞MH-S自噬。CXCL12 是DPP-4 底物中的一种,而CXCR4是CXCL12 的特异性受体,在肺巨噬细胞中高表达,相关研究表明,CXCR4/mTOR 信号能够对肿瘤相关巨噬细胞发挥调控作用[18]。
在马晓娟等[19]研究中显示,DPP-4 抑制剂能有效降低血糖并抑制血清肺巨噬细胞移动抑制因子水平,从而发挥抗炎作用,对糖尿病合并冠状动脉粥样硬化性心脏病患者起到一定的保护作用。黄玉芳等[20]研究显示,DPP-4 抑制剂能够下调小鼠肺巨噬细胞系RAW264.7 细胞的炎症反应,其作用机制与PKA/NF-κB 通路有关。上述研究均显示,DPP-4 对小鼠肺巨噬细胞具有一定的抗炎作用。本研究中同样对各组MH-S 细胞炎症因子水平进行检测,其中LPS 组IL-1β、IL-6 及TNF-α 明显高于PBS组,表明MH-S 细胞在LPS 的诱导下激活细胞炎症反应,释放大量炎症因子,分析其原因为LPS 是内毒素的主要成分,能够与细胞中多种受体结合,诱导细胞炎症反应的发生。与LPS 组比较,DPP-4 组炎症因子水平呈下降趋势,但无统计学意义,而si-DPP-4 组炎症因子水平升高,说明DPP-4 对细胞炎症水平具有一定的抑制作用,但抑制作用较弱,导致各组炎症因子变化不明显,而抑制DPP-4 表达能够促进炎症反应的发生。与DPP-4 组比较,si-DPP-4 组和DPP-4 + BafA1 组IL-1β、IL-6 及TNF-α 升高,提示抑制DPP-4 表达能够促进炎症反应,DPP-4 在自噬抑制剂的作用下,同样有促炎作用,反向说明DPP-4 高表达和细胞自噬均有抗炎作用。与si-DPP-4 组比较,si-DPP-4 + BafA1 组IL-1β、IL-6 降低,表明在DPP-4 低表达情况下,抑制细胞自噬作用相较于炎症反应的促进作用更强,进一步说明DPP-4 高表达与细胞自噬均有抗炎作用。
CXCL12/CXCR4 通路在肿瘤转移、炎症、免疫等过程中发挥重要作用。国外有研究显示,抑制DPP-4表达能够通过CXCL12/CXCR4/mTOR 通路促进上皮间质转化,加速乳腺癌细胞转移,且能够增加乳腺癌细胞的化疗耐药性[21-22]。本研究对MH-S 细胞自噬流、CXCR4/mTOR 通路mRNA 和蛋白进行检测,结果显示,经过LPS 诱导,细胞自噬流升高,mTOR mRNA、CXCR4 mRNA、p-mTOR 蛋白、CXCR4 蛋白表达上调,表明在炎症反应的刺激下,CXCR4/mTOR 通路部分被激活,而在DPP-4 过表达的情况下,自噬流进一步升高,通路mRNA 和蛋白表达进一步上调,表明DPP-4 能够有效激活CXCR4/mTOR 通路,促进细胞自噬;而在DPP-4 低表达的情况下,自噬作用受到抑制。另外本研究在DPP-4 过表达及低表达的情况下给予自噬抑制剂,结果显示,两种情况下细胞自噬流及通路蛋白表达均下调,进一步说明DPP-4 能够通过CXCR4/mTOR 通路对MH-S 细胞自噬作用进行调控。
综上所述,DPP-4 能够通过调控小鼠肺巨噬细胞自噬作用影响细胞炎症因子分泌,其作用机制与CXCR4/mTOR 通路有关,未来可对DPP4 抑制剂的抗炎作用进行深入研究,为炎症性疾病的治疗提供新的研究思路。
