良附丸治疗胃寒型功能性消化不良的药效学研究
2022-08-30付江波桂蓓李坤平杨超燕魏玲梁晋如马江任孟月陈艳芬
付江波,桂蓓,李坤平,杨超燕,魏玲,梁晋如,马江,任孟月,陈艳芬
(广东药科大学1.中药学院;2.中医药研究院,广州 510006)
良附丸出自《良方集腋》,主要由高良姜和香附组成,具有温胃散寒、理气止痛的功效,临床主要应用于胃脘痛、胃炎、胃溃疡等,药理研究表明该方具有促进胃肠运动作用[1-2]。功能性消化不良(functional dyspepsia,FD)是一种常见的无明确器质性病因的胃肠疾病,主要临床表现为餐后饱胀不适、早饱、上腹痛和上腹灼烧感[3]。流行病学调查显示在亚洲人群中 FD 的发病率5%~30%,在西方国家发病率10%~40%[4]。中医古籍对该疾病没有确切的记载,根据FD的临床症状,将其归属为“胃脘痛”“痞满”“积滞”等范畴[5]。为了探讨良附丸对FD是否具有潜在治疗作用,本研究首先通过小鼠胃肠运动实验和镇痛实验考察良附丸的基础药效,并通过建立胃寒型FD大鼠模型,探讨良附丸治疗FD的作用及其机制,为良附丸的临床应用提供实验依据。
1 材料与方法
1.1动物 SPF级昆明小鼠,雌雄兼用,体质量18~22g,实验动物使用许可证号:SYXK-(粤)2017-0125;SPF级SD大鼠,雌雄各半,体质量180~220 g,实验动物使用许可证号:SYXK-(粤)2020-0002,均购于广东省医学实验动物中心。所有动物实验前先适应性饲养3 d,期间水、饲料自由摄取。
1.2药品与试剂 高良姜、醋香附购于岭南中药饮片有限公司,批号分别为2006001,2005001,经广东药科大学程轩轩副教授鉴定为正品;按照高良姜、醋香附各 9 g配比良附丸,加水煎煮2次,收集滤液浓缩至一定浓度备用。吲哚美辛(广东华南药业集团有限公司,批号:190501);多潘立酮(西安杨森制药有限公司,批号:190107);莫沙必利分散片(成都康弘药业集团有限公司,批号:0I002);羧甲基纤维素钠(carboxymethyl-cellulose sodium,CMC-Na,天津市致远化学试剂有限公司,批号:2016092094);冰醋酸(国药集团化学试剂有限公司,批号:20150505);甲醛(天津市福晨化学试剂厂,批号:20190926);电镜固定液(赛维尔生物科技有限公司,批号:G1102);S12包埋剂(SPI公司,批号:90529-77-4);磷酸盐缓冲液(PBS,赛维尔生物科技有限公司,批号:G0002);4%多聚甲醛(赛维尔生物科技有限公司,批号:G1101);组化试剂盒二氨基联苯胺显色剂(赛维尔生物科技有限公司,批号:G1211)。
1.3仪器 分析天平(日本岛津 SHIMADZU,感量:0.1 mg);医用离心机(湖南湘仪实验室仪器开发有限公司);YLS-6B智能热板仪(济南益延科技发展有限公司);包埋机(武汉俊杰电子有限公司);病理切片机(上海徕卡仪器有限公司);全自动酶标仪(Bio Tek Instruments)。
1.4实验方法与检测指标
1.4.1对醋酸所致小鼠扭体反应的影响 取小鼠60只,按照随机数字表法随机分为正常对照组,吲哚美辛组,良附丸大(14.4 g·kg-1)、中(7.2 g·kg-1)、小剂量组(3.6 g·kg-1),每组12只。各组小鼠灌胃20 mL·kg-1相应药物,连续3 d,每天1次。正常对照组小鼠灌胃等剂量0.5% CMC-Na。末次给药1 h后腹腔注射0.6%醋酸0.2 mL。观察并记录在15 min内出现的扭体次数。扭体次数抑制率(%)=(正常对照组扭体数-给药组扭体数)/正常对照组扭体数×100%[6]。
1.4.2对甲醛致小鼠舔足反应的影响 取小鼠60只,分组与给药同“1.4.1”项。于每只小鼠皮下注射2.5%甲醛溶液50 μL。给药后置于透明容器中观察小鼠足部。每个时间段均观察15 s,并在15 s按评分标准记录小鼠的最高疼痛强度评分。分别记录各组小鼠1,10,20,30,40 min的疼痛反应分值。评分方法具体为:小鼠出现舔足、咬足、抖足时,为3分;小鼠出现提高足部时,为2分;小鼠出现跛行或足部轻触地面但不负重时,为1分;小鼠正常负重、走动自如,为0分[7]。
1.4.3小鼠胃排空与肠推进实验 取小鼠60只,称质量,随机分为正常对照组,多潘立酮组,良附丸小(3.6 g·kg-1)、中(7.2 g·kg-1)、大(14.4 g·kg-1)剂量组。各组小鼠灌胃20 mL·kg-1相应药物,末次给药40 min后,每只小鼠灌胃营养半固体糊0.8 mL。灌胃完毕后,立即对小鼠进行逐一计数。灌胃20 min后,脱颈椎处死,开腹。结扎胃贲门,取出全胃。取出后,用滤纸把胃擦干,称总质量(G)。然后沿胃的大曲线切开,清洗胃内容物,用滤纸将胃体擦干,称净质量(M)。胃排空率(%)=[1-(G-M)/所灌半固体营养糊的质量]×100%[8]。
取出幽门到回盲部的小肠,用尺测量小肠总长度(S)及幽门端到炭末端长度(L),计算小肠推进率。小肠推进率(%)=L/S×100%[8]。
1.4.4胃寒型FD大鼠模型实验 大鼠72只,随机分为6组,分别为正常对照组、模型对照组、莫沙必利组(0.016 g·kg-1)和良附丸小、中、大剂量组(1.8,3.6,7.2 g·kg-1),每组12只。除正常对照组外其余各组均造模,胃寒型FD模型根据课题组前期经验构建,即采用郭氏夹尾刺激法+不规律饮食+0.9%氯化钠溶液多因素干预方法,造模14 d。夹尾刺激法:于每日9:30和15:30用长柄医用纱布包裹3或4层的金属钳夹住大鼠尾端1/3处,激怒大鼠,与笼内其他大鼠打斗,每次30 min;不规律饮食:单日禁食,双日给予 饲料150 g,正常饮水;0.9%氯化钠溶液:于每日9:00和15:00用0~4 ℃ 0.9%氯化钠溶液灌胃大鼠(每只2 mL)。
①大鼠一般情况观察。详细记录各组大鼠的精神、皮毛、活动度、粪便和进食量。食物进食量的测定方法如下:每组大鼠单独饲养,称取24 h前后饲料质量。
②糖水偏好实验。在实验的第3天、第8天、第14天分别进行糖水实验,在进行糖水偏好实验前需对大鼠进行糖水适应性练习,操作方法参考文献[9]。测1 h的糖水偏好,到时间取走各组水壶,测量水壶剩余质量,计算糖水偏好率[9]。
③旷场实验。建模第14天,用长宽80 cm、高80 cm的黑色内壁纸箱,底部画出20块等面积为12 cm×12 cm的白色方块。将大鼠放于纸箱底部的中央,开始计时5 min。水平分数为:两只前爪交叉在盒子底部其他方格内的次数为1分;垂直分数为:两只前爪抬起并爬上盒子墙壁的次数为1分。每次实验结束后,及时清理箱体底部和内壁,避免影响下次检测结果[9]。
④胃肠运动实验。末次给药1 h后,处死大鼠,立即打开腹腔,测量胃排空率和小肠推进率,实验具体步骤及结果见相关文献[10]。
⑤酶联免疫吸附测定实验(ELISA)测定5-羟色胺(5-HT)、胃动素(motilin,MTL)、血管活性肠肽(vasoactive intestinal peptide,VIP)、P物质(substance P,SP)的含量。末次给药1 h后取血,分离血清,分别测定各组大鼠血清 VIP、MTL、SP 的含量和胃肠组织5-HT水平,测定步骤严格按照试剂盒说明书操作。
⑥透射电镜观察胃窦、结肠组织中嗜铬细胞。在新鲜组织中确定取样部位,组织体积一般不大于1 mm×1 mm×1 mm,用电子显微镜固定液 4 ℃快速固定 2~4 h,用含1%锇酸的0.1 mol·L-1磷酸盐缓冲液(PBS,pH值7.4)冲洗3次,每次15 min。冲洗后用乙醇梯度脱水,丙酮透明,包埋烘烤后超薄切片,最后采用铀铅双染色(2%醋酸铀饱和乙醇,柠檬酸铅),置于透射电镜下观察并摄片。
⑦免疫组化(immunohistochemistry,ICH) 法观察胃窦及空肠组织中5-HT的表达。切开胃窦和空肠组织,用 4%甲醛溶液固定,然后脱水。石蜡切片成厚4 μm切片,免疫组化染色后,置于显微镜下观察并摄片。用ImageJ图像分析系统进行阳性显色的平均吸光度(A值)测定。将图片调节为灰度图片:Image/Type,将图片改为8-bit;将8-bit灰度图片转换为A值:Analyze/Calibrate,选择Uncalibrate OD;选择需要测量的参数:Analyze/Set Measurements,选择Integrated Density、Area、 Limit to Threshold;选择阳性信号:Image/Adjust/Threshold调节阈值,选择所有阳性信号;计算,分析结果:Analyze/Measure,得到平均A值(平均A值=积分A值/阳性区域面积)。
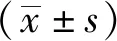
2 结果
2.1对醋酸所致小鼠扭体反应的影响 结果见表1。与正常对照组比较,良附丸各剂量组小鼠的平均扭体次数均有不同程度减少,呈剂量依赖关系,表明良附丸能显著抑制醋酸刺激所致小鼠扭体的次数[F(4,55)=30.723,P<0.01或P<0.05]。
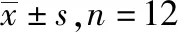
表1 5组小鼠扭体反应比较 Tab.1 Comparison of writhing response among five groups of mice
2.2对甲醛致小鼠舔足反应的影响 结果见表2。与正常对照组比较,良附丸各剂量组和吲哚美辛组在1 min内差异无统计学意义;10 min时,良附丸各剂量组可略微减轻小鼠疼痛,吲哚美辛组能显著降低小鼠疼痛;20~40 min时,良附丸各剂量组能降低甲醛致小鼠的疼痛值,其镇痛作用随时间延长减弱,吲哚美辛组也能显著降低小鼠的疼痛值[F(4,55)=46.891,P<0.01或P<0.05]。
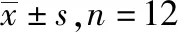
表2 5组小鼠舔足反应(疼痛评分)比较 Tab.2 Comparison of foot licking reaction(pain score) among five groups of mice
2.3小鼠胃排空与肠推进实验 结果见表3。与正常对照组比较,良附丸中、大剂量组小鼠胃排空率显著升高[F(4,55)=9.558,P<0.01]。良附丸各剂量组小鼠小肠推进率均有不同程度升高[F(4,55)=74.352,P<0.05或P<0.01])。
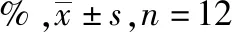
表3 5组小鼠胃排空率和肠推进率比较 Tab.3 Comparison of gastric emptying rate and intestinal propulsion rate among five groups of mice
2.4胃寒型FD大鼠模型实验
2.4.1一般情况 各组大鼠第1天精神状态良好,皮毛整齐有光泽,敏感活跃,粪便呈棕色、干燥、球形,抗捕性强;造模第6天,正常对照组大鼠无异常,其余各组大鼠精神尚可,活动量如前,均有不同程度的毛发散乱,体形渐瘦,活动减少,抓捕时挣脱束缚次数逐渐减少,粪便呈褐色等症状;造模第10天,正常对照组大鼠无异常,其余各组大鼠出现活动量大幅减少,逐渐放弃挣扎,精神疲惫,声音嘶哑,粪便呈黄色软便等现象;造模第14天时,正常对照组大鼠未见异常,其余各组大鼠扎堆静卧,神态疲倦,叫声微弱,粪便呈时干时溏。
经药物治疗7 d后,药物组大鼠皮肤毛发及精神均较前明显好转,活动度明显增加,抓捕时开始挣扎反抗,粪便转干。模型对照组大鼠一般状态较造模时略有好转,但与正常对照组比较在活动和反应等情况仍有明显差异。
2.4.2体质量、进食量及饮水量 结果见图1。14 d造模结束时,与正常对照组大鼠比较,其余各组大鼠体质量均明显下降(P<0.01)。治疗7 d后,各给药组大鼠的体质量有所改善,但与正常对照组比较仍有明显差异;与模型对照组大鼠比较,良附丸各剂量组和莫沙必利组的体质量明显增长[F(5,66)=98.23,P<0.01或P<0.05]。良附丸和莫沙必利对FD模型大鼠体质量、进食量及饮水量降低有一定改善作用。

图1 6组大鼠体质量的变化 Fig.1 Body mass changes in six groups of rats
2.4.3对大鼠糖水消耗百分率的影响 见表4。治疗前,给药组、模型对照组大鼠的糖水偏好率与正常对照组相比均差异有统计学意义(P<0.05),而给药组与模型对照组之间差异无统计学意义(P>0.05)。治疗后,与正常对照组大鼠比较,模型对照组大鼠的糖水消耗百分率比较均差异有统计学意义(P<0.05);与模型对照组比较,良附丸各剂量组大鼠的糖水偏好百分率均有不同程度上升[F(5,66)=69.914,P<0.05或P<0.01]。
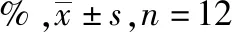
表4 6组大鼠糖水消耗百分率比较 Tab.4 Comparison of sugar water consumption percentage among six groups of rats
2.4.4对大鼠旷场实验得分的影响 见图2。治疗前,给药组和模型对照组大鼠的旷场实验得分与正常对照组相比均差异有统计学意义(P<0.05),而药物组与模型对照组之间差异无统计学意义(P>0.05)。治疗后,模型对照组与正常对照组大鼠比较差异有统计学意义(P<0.05);与模型对照组比较,良附丸各剂量组的旷场实验得分均有不同程度上升[F(5,66)=165.758,114.778,152.498,120.388,P<0.05或P<0.01],表明良附丸可能具有一定的抗焦虑作用。

A.正常对照组;B.模型对照组;C.莫沙必利组;D.良附丸小剂量组;E.良附丸中剂量组;F良附丸大剂量组。①与正常对照组比较,P<0.05;②与正常对照组比较,P<0.01;③与模型对照组比较,P<0.01;④与模型对照组比较,P<0.05。图2 6组大鼠旷场实验水平运动和垂直运动得分 A.normal control group;B.model control group;C.mosapride group;D.Liangfu pill low dose group;E.Liangfu pill middle dose group;F Liangfu pill high dose group.①Compared with normal control group,P<0.05;②Compared with normal control group,P<0.01.③Compared with model control group,P<0.01;④Compared with model control group,P<0.05.Fig.2 Horizontal locomotion and vertical locomotion scores in the open field test in six groups of rats
2.4.5ELISA法测定5-HT、MTL、VIP、SP水平 结果见表5。与正常对照组比较,模型对照组大鼠的胃窦组织、空肠组织中5-HT、MTL、SP含量显著下降,VIP的含量显著升高。与模型对照组比较,给药组大鼠的胃窦组织中、空肠组织中的5-HT含量明显上升[F(5,66)=55.262,59.378,P<0.05或P<0.01],MTL、SP的含量均明显上升[F(5,66)=98.328,112.657,P<0.05或P<0.01],VIP的含量显著下降[F(5,66)=68.615,P<0.05或P<0.01]。说明良附丸能不同程度调节FD大鼠的胃肠组织中5-HT以及血清脑肠肽水平。
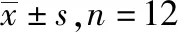
表5 6组大鼠5-HT、SP、MTL、VIP水平比较 Tab.5 Comparison of 5-HT,SP,MTL and VIP levels among six groups of rats
2.4.6透射电镜观察胃窦、结肠组织中嗜铬细胞分布 肠嗜铬细胞是肠道中的一种特化细胞,由肠上皮基底干细胞分化而来,虽然只占肠道上皮细胞的1%,但产生超过90%的体内5-HT。电镜下发现,呈圆形或椭圆形的肠嗜铬细胞在正常胃黏膜和肠黏膜有较多分布,模型对照组相对较少,而与模型对照组比较,良附丸大剂量组嗜铬细胞数量明显增多(图3),提示其可能通过影响嗜铬细胞进而调节5-HT水平产生胃肠功能调节作用。

图3 3组大鼠胃肠黏膜嗜铬细胞分布情况(×2000) Fig.3 Distribution of chromaffin cells in gastrointestinal mucosa of three groups of rats(×2000)
2.4.7IHC法观察胃窦及肠组织中5-HT的表达 结果见图4,5。与模型对照组比较,良附丸中、大剂量组和莫沙必利组胃窦及肠组织中5-HT阳性表达明显增高[F(5,30)=52.063,46.891,P<0.05或P<0.01],表明良附丸可能通过调节5-HT表达改善FD模型的胃肠动力障碍症状。
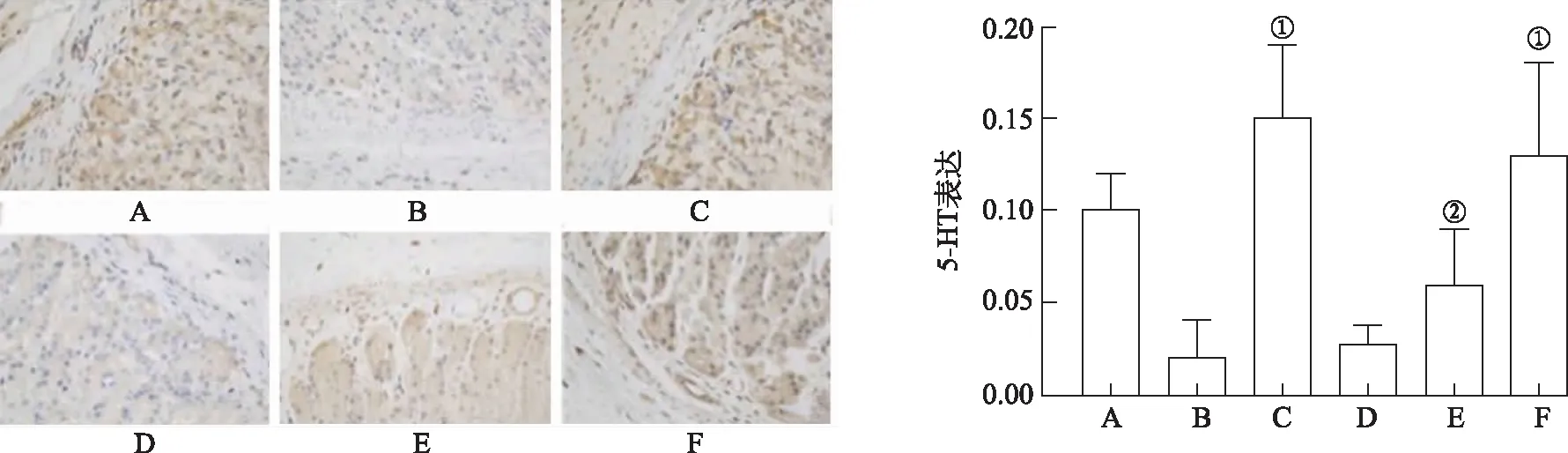
A.正常对照组;B.模型对照组;C.莫沙必利组;D.良附丸小剂量组;E.良附丸中剂量组;F良附丸大剂量组。①与模型对照组比较,P<0.01;②与模型对照组比较,P<0.05。图4 6组大鼠胃窦中5-HT表达水平比较(×40) A.normal control group;B.model control group;C.mosapride group;D.Liangfu pill low dose group;E.Liangfu pill middle dose group;F Liangfu pill high dose group.①Compared with model control group,P<0.01;②Compared with model control group,P<0.05.Fig.4 Comparison of 5-HT expression levels in gastric antrum among six groups of rats(×40)
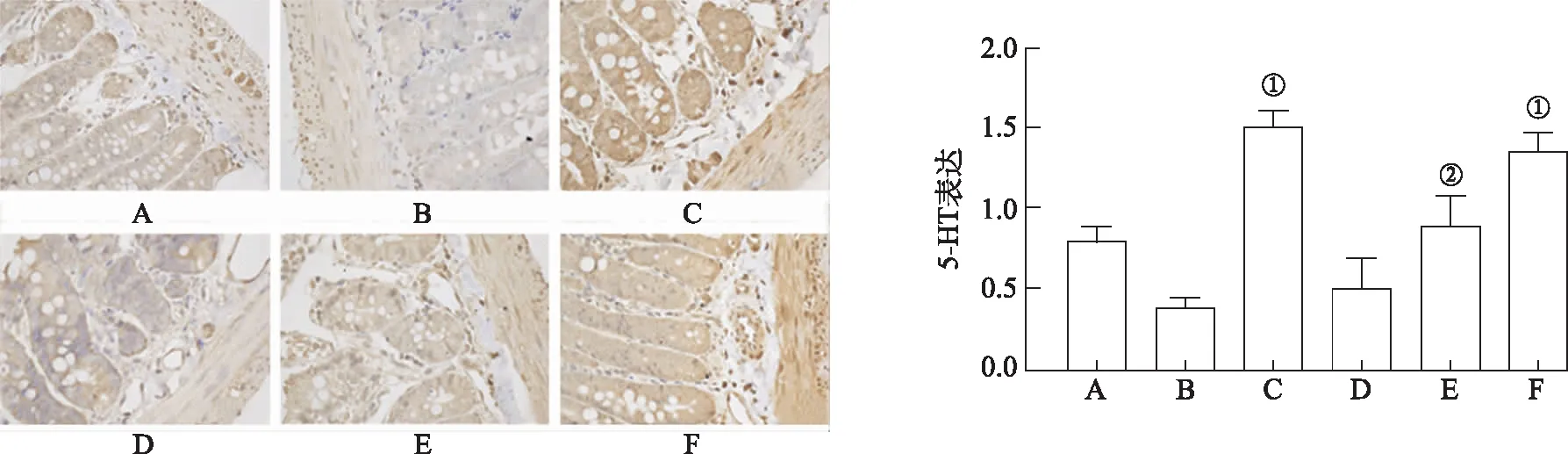
A.正常对照组;B.模型对照组;C.莫沙必利组;D.良附丸小剂量组;E.良附丸中剂量组;F良附丸大剂量组。①与模型对照组比较,P<0.01;②与模型对照组比较,P<0.05。图5 6组大鼠空肠组织中5-HT表达水平比较(×40) A.normal control group;B.model control group;C.mosapride group;D.Liangfu pill low dose group;E.Liangfu pill middle dose group;F Liangfu pill high dose group.①Compared with model control group,P<0.01;②Compared with model control group,P<0.05.Fig.5 Comparison of 5-HT expression levels in jejunal tissues of six groups of rats(×40)
3 讨论
良附丸具有温胃散寒、理气止痛功效,可以治疗寒凝气滞导致的上腹痛、腹胀等病症。FD是一种常见的临床综合征,发病具有持续性或反复性的特点。FD的病理生理机制认为是多种因素综合而成的,但胃肠动力障碍和内脏超敏反应是目前FD最重要和公认的病理生理学基础[11]。因此,本研究首先以胃肠运动实验和镇痛实验考察了良附丸的基本药效。研究结果表明良附丸可明显抑制醋酸、甲醛疼痛模型,且能促进小鼠胃排空及小肠推进,初步确定了其治疗功能性消化不良的潜在作用。
目前 FD 较为经典的造模方法是夹尾刺激法或加不规则饮食法[12],模拟的是不良生活事件形成的心理应激和饮食失调导致出现类似FD 症状。本研究胃寒型FD模型采用文献加自身经验的方法构建,即采用郭氏夹尾刺激法+不规律饮食+0.9%氯化钠溶液多因素干预方法,符合中医实寒证的理论和表现。实验结果表明,经药物治疗7 d后,药物组大鼠一般状况明显好转,活动度明显增加,抓捕时开始挣扎反抗,粪便转干;良附丸对模型大鼠体质量、进食量及饮水量降低也有一定的拮抗作用。糖水偏好实验和旷场实验结果表明,良附丸具有一定的抗焦虑作用。近年以来,脑肠轴与脑肠肽的异常被认为是FD发病的重要病理生理基础[13]。在影响胃肠的动力因素中,5-HT是调整胃肠运动、分泌和感觉的关键神经递质[14]。人体95%的5-HT分布在胃肠道的嗜铬细胞和肠神经元[15]。外周神经系统90%的5-HT由嗜铬细胞合成、分泌和再摄取。5-HT一方面可以直接影响胃肠平滑肌,另一方面可以通过调整其他神经纤维影响胃肠运动,在调整胃肠动力及肠道敏感性方面均起着重要作用。5-HT与受体结合增加后,肠道初级传入神经元兴奋性增加,加速胃排空、增加内脏敏感性。除此之外,脑肠肽MTL、VIP、SP等成分对胃肠运动也具有重要的调节作用[16-17]。本研究采用透射电镜观察胃窦、结肠组织中嗜铬细胞,IHC法观察检测5-HT的表达,ELISA检测5-HT、MTL、VIP、SP的含量。实验表明良附丸组嗜铬细胞数量增多,胃窦、空肠组织中的5-HT含量相比模型对照组也有显著增高,提示良附丸可能通过影响嗜铬细胞进而调节5-HT水平产生胃肠功能调节作用。
综上所述,本研究通过小鼠镇痛与胃肠动力实验,证实了良附丸对FD的潜在治疗作用;通过FD大鼠实验观察到良附丸的抗焦虑作用以及通过调控5-HT、SP、MTL、VIP等的含量发挥治疗FD的作用,从而为良附丸的临床应用提供了实验依据,下一步可针对其具体作用机制进行深入研究。
