救必应对小肠黏膜损伤模型大鼠的防治作用及其机制*
2022-08-30梁欣仪李茹柳刘乙婷陈婉霞曾信平胡玲
梁欣仪,李茹柳,刘乙婷,陈婉霞,曾信平,胡玲
(广州中医药大学科技创新中心、脾胃研究所,广州 510405)
岭南中药救必应为冬青科植物铁冬青(IlexrotundaThunb.)的干燥树皮,性寒味苦,归肺、胃、大肠、肝经,具有清热解毒、利湿止痛功效,常用于治疗暑湿发热、咽喉肿痛、湿热泻痢、脘腹胀痛、风湿痹痛、湿疹、疮疖、跌打损伤等[1],最早记载于《岭南采药录》,也是《中华人民共和国药典》2010年、2015年、2020年版收录的品种。救必应有调理脾胃作用,临床上应用广泛。国医大师邓铁涛、广东省名中医劳绍贤等岭南医者常用救必应配伍其他中药治疗湿热内蕴或肝郁内热慢性胃肠疾病,如难治性消化性溃疡、慢性萎缩性胃炎、肠易激综合征、溃疡性结肠炎等[2-4]。另外,含有救必应的中成药腹可安片、飞扬肠胃炎胶囊等广泛用于治疗急慢性胃肠炎等。但救必应调理脾胃作用机制的研究较少,本研究在吲哚美辛致大鼠小肠黏膜损伤模型上,观察其对小肠黏膜损伤的防治作用并分析其机制,检测指标包括肠黏膜屏障功能相关指标(紧密连接蛋白ZO-1、Occludin、Claudin-1,黏附连接蛋白E-cadherin、α-catenin、β-catenin,肠通透性指标血浆D-乳酸)以及肠特异性转录因子CDX-2,从促进肠黏膜损伤修复角度探讨救必应调理脾胃的作用机制。
1 材料与方法
1.1材料
1.1.1药物和动物 救必应为冬青科植物铁冬青IlexrotundaThunb.的干燥树皮,购于广州市三元里杏园春药店,经广州中医药大学鉴定教研室童家赟副教授鉴定药材性状符合《中华人民共和国药典》标准。
SD大鼠,雄性,无特定病原体(SPF)级,体质量180~220 g,购自广州中医药大学动物实验中心,实验动物生产合格证:SCXK(粤)2018-0034;实验环境:SPF级;实验动物使用许可证:SYXK(粤)2018-0001。大鼠饲养条件:12 h明暗交替、温度为18~26 ℃,日温差≤3 ℃,相对湿度40%~70%,适应性喂养7 d后开始实验。10%水合氯醛麻醉后取样及处死。
1.1.2试剂和主要仪器 吲哚美辛(美国Sigma公司,批号:056M4036V);通用链霉卵白素-生物素法免疫组化试剂盒(SP-9000)、二氨基联苯胺(diamino-benzidine,DAB)试剂盒(北京中杉金桥有限公司); ZO-1抗体(61-7300),Occludin抗体(40-4700)(美国Thermo Fisher Scientific公司);二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量试剂盒(凯基生物公司);D-乳酸试剂盒(cat#13810,lot:2391443)(美国ATT,bioquest公司);Claudin-1抗体(ab15098)、E-cadherin抗体(ab76055)、β-catenin抗体(ab32572)、α-catenin抗体(ab51032)、CDX-2抗体(ab76541)(英国abcam公司);二抗:山羊抗兔IgG H&L(HRP,ab205718),山羊抗小鼠IgG H&L(HRP,ab6789)。
ME204型电子天平(瑞士METTLER TOLEDO公司,感量:0.1 mg),ClarityTMwestern ECL substrate、ChemiDocTMXRS+成像仪、TM电泳仪、垂直电泳仪槽(美国BIO-RAD公司);DNA Expert型多用途微量板检测仪(奥地利TECAN公司);HeraousMultifuge X1R离心机(美国 Thermo Fisher公司)。
1.2方法
1.2.1救必应水提物的制备 称取救必应药材600 g,掰成小块,12倍体积量纯水浸泡2 h,180 ℃煮开,后用120 ℃煮2 h,纱布过滤;滤渣用12倍体积纯水煎煮2 h,纱布过滤,合并2次滤液;滤液浓缩至1 g·mL-1(约600 mL),-60 ℃过夜,次日真空干燥2 d,得救必应水提物冻干粉105 g(得率为17.5%),-20 ℃保存。
1.2.2动物分组、造模和给药方法 按Excel软件产生的随机数字表将大鼠分成正常对照组6只,模型对照组及救必应小、大剂量(8,16 g·kg-1)组各10只;大鼠适应性喂养1周,体质量(260±10) g;造模前受试药组灌胃救必应水提物(8,16 g·kg-1),模型对照组和正常对照组灌胃等体积纯水;1 h后,模型对照组和受试药组分别皮下注射吲哚美辛5 mg·kg-1造模,正常对照组皮下注射等体积0.9%氯化钠溶液。按10 mL·kg-1体积灌胃和皮下注射均为每天1次,共4 d;末次灌胃后禁食不禁水24 h,第5天以10%水合氯醛20 mL·kg-1腹腔注射麻醉大鼠,剖腹,腹主静脉采血,并取小肠组织剪开;肉眼观察小肠黏膜损伤情况,按评分细则计算损伤的大体评分;取损伤最明显的小肠组织(长约2 cm)置4%多聚甲醛固定,常规石蜡包埋切片,苏木精-伊红(HE)染色,显微镜下进行小肠组织病理评分;其余小肠冰上刮取黏膜组织,-80 ℃冰箱保存,以备后续免疫印迹(Western blotting)实验。
1.2.3小肠黏膜损伤大体及病理评分标准 小肠黏膜损伤大体评分[5]:按溃疡和粘连分别评分,总分为二者之和。溃疡评分:游标卡尺测量全小肠的溃疡长度,每一毫米计1分,宽度>1 mm计分加倍,累积评分。粘连评分:无粘连为0分;粘连较轻,少许力量即可将小肠与其他组织分开为1分;粘连较重为2分。
小肠黏膜损伤病理评分[6],显微镜下观察小肠组织病理变化。0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性坏死、脱落,部分绒毛脱落、固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解,出血或溃疡形成。
1.2.4免疫组化法检测小肠组织蛋白表达 组织切片60 ℃加热1 h,常规脱蜡、水化;放进0.01 mol·L-1柠檬酸盐缓冲液(pH值6.0),微波炉加热修复抗原,先中高火9 min,自然冷却15 min,再高火5 min,自然冷却1 h;SP法阻断内源性过氧化物酶10 min,磷酸盐缓冲液(PBS)冲洗2次,每次5 min;正常山羊血清封闭液封闭15 min;孵育一抗(ZO-11:200,Occludin 1:100,Claudin-1 1:100,E-cadherin 1:100,α-catenin 1:100,β-catenin 1:100,CDX-2 1:100),4 ℃过夜,37 ℃复温45 min,甩去一抗,冲洗,滴加二抗,室温孵育15 min,冲洗,滴加辣根酶标记链霉卵白素工作液,室温孵育15 min,冲洗,擦干,DAB室温显色10 min,显微镜下控制染色程度(细胞质呈棕色则判为阳性表达细胞);自来水冲洗5 min终止反应;苏木精复染,自来水冲洗2 min;常规脱水,中性树胶封片、镜检。正常对照组、模型对照组、救必应水提物16和8 g·kg-1组全部样本均进行免疫组化检测,若显色失败、染色效果较差时,则视作脱落样本不纳入统计。
组织切片镜检方法及图片数据化:显微镜下所见棕黄色颗粒即为所测蛋白阳性表达,每张切片随机选取5个视野(×200)进行评分,该5个视野再选取重点部位显微镜下(×400)观察该蛋白表达。ImageJ软件及IHC-Profiler插件处理图片,软件自动分离棕黄色部分(目标蛋白)进行测量,并得出“Negative,Low positive,Positive,and High positive”[7]。将软件所得结果量化,Negative为0分,Low positive为1分,Positive为2分,High positive为3分,计算每张切片5个视野的平均阳性得分,即为该蛋白表达的半定量结果。
1.2.5Western blotting法检测小肠黏膜蛋白表达 总蛋白提取及蛋白样品准备,匀浆:小肠黏膜组织每50 mg加裂解液1 mL,低温快速电动匀浆。12000×g离心,4 ℃,15 min,冰上静置30 min。取少量上清液进行定量,用BCA试剂盒进行测定。将所有蛋白样品调至等浓度,充分混合加5倍缓冲液,100 ℃变性10 min,冰上30 s冷却,上样,余下样品-20 ℃保存。正常对照组、救必应水提物16 g·kg-1组全部样本进行Western blotting检测,模型对照组和救必应水提物8 g·kg-1组按随机数字表各取6个样本进行Western blotting检测。
蛋白质免疫印迹,制胶:按照伯乐快速制胶试剂盒说明书配制。电泳:所有蛋白样品调至等浓度后上样,先用恒压80 V,当跑至分离胶后改为200 V。转膜:恒流250 mA电转1.5~2 h。封闭:取膜,TBST洗5 min,3次,用5%脱脂奶粉封闭1.5 h。孵育一抗:TBST洗膜,切膜,并放于对应的稀释后的一抗4 ℃过夜(ZO-1 1:500,Occludin 1:500,Claudin-1 1:500,E-cadherin 1:1000,α-catenin 1:1000,β-catenin 1:1000,CDX-2 1:500)。室温复温20 min。孵育二抗:TBST洗膜,放入对应的稀释好的二抗1 h(鼠二抗及兔二抗1:5000)。显影:TBST洗膜,显影液浸泡30 s后显影。图像处理:用ImageJ软件处理得到所对应的吸光度(A值)。
1.2.6Amplite荧光法测血浆D-乳酸 按D-乳酸测定试剂盒说明书步骤,用DNA Expert型多用途微量板检测仪检测,发射波长/激光波长=532/590 nm,读取吸光度,绘制标准曲线,计算血浆D-乳酸浓度。

2 结果
2.1救必应水提物对大鼠小肠黏膜损伤的影响(大体评分) 实验结束时模型对照组和救必应小剂量组动物死亡各2只(2/10),救必应大剂量组死亡4只(4/10),动物死亡原因均为造模所致小肠穿孔,4组死亡数差异无统计学意义。
对各组存活大鼠进行小肠黏膜损伤大体评分,结果见表1。正常对照组大鼠小肠黏膜无粘连,黏膜未见明显异常;模型对照组大鼠小肠肠管可见不同程度粘连,小肠黏膜均可见充血、糜烂、多发溃疡灶及穿孔,溃疡灶呈红褐色,大体评分较正常对照组明显增高(P<0.01,死亡大鼠不纳入统计,下同),提示造模成功。救必应水提物小剂量组可见小肠粘连,但程度轻于模型对照组,小肠肠管内可见多处溃疡灶,但溃疡总长度及总面积较模型对照组小,大体评分较模型对照组低(P<0.05);救必应大剂量组大鼠小肠见少量粘连,小肠肠管内可见多处溃疡灶,但溃疡总长度及总面积较模型对照组减小(图1),大体评分较模型对照组低(P<0.01)。表明救必应水提物对吲哚美辛大鼠小肠黏膜损伤有防治作用。
由图1及表1可见,正常对照组大鼠小肠可见轻微的黏膜层绒毛上皮细胞脱落,考虑跟饲养环境及动物批次有关;模型对照组大鼠可见小肠黏膜损伤形成,黏膜层绒毛及肠腺完全坏死,肌层肌细胞坏死,浆膜层及脂肪组织见结缔组织增生,病理评分较正常对照组明显增高(P<0.01);救必应大剂量组也可见小肠黏膜损伤,部分为固有层裸露或充血水肿,病理评分较模型对照组降低(P<0.01);救必应小剂量组损伤较模型对照组有所减轻,绒毛表面上皮细胞脱落,固有层崩解,但与模型对照组比较差异无统计学意义(P>0.05)。本结果从病理评分角度表明救必应水提物对吲哚美辛所致大鼠小肠黏膜损伤有改善作用。
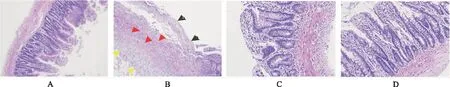
A.正常对照组;B.模型对照组;C.救必应小剂量组;D.救必应大剂量组。图1 4组大鼠小肠黏膜组织病理变化(HE,×200) A.normal control group;B.model control group;C.Ilex rotunda Thunb. low dose group;D.Ilex rotunda Thunb. high dose group.Fig.1 Histopathological changes of small intestinal mucosa in four groups of rats(HE,×200)
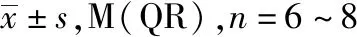
表1 4组大鼠小肠黏膜损伤大体及病理评分比较 Tab.1 Comparison of gross and pathological scores of small intestinal mucosal injury among four groups of rats
2.2救必应水提物对造模大鼠小肠黏膜紧密连接蛋白表达的影响 免疫组化结果见图2,正常对照组紧密连接蛋白ZO-1、Occludin和Claudin-1在小肠黏膜绒毛和隐窝可见表达;与正常对照组比较,模型对照组小肠黏膜ZO-1、Occludin和Claudin-1表达均下降(均P<0.05),提示吲哚美辛诱导小肠黏膜损伤可致紧密连接蛋白表达下降;与模型对照组比较,救必应小、大剂量组大鼠ZO-1、Occludin和Claudin-1表达升高(P<0.05或P<0.01)。图2显示(由于技术原因未取得ZO-1的 Western blotting结果),与正常对照组比较,模型对照组紧密连接蛋白Occludin、Claudin-1表达降低(P<0.05);与模型对照组比较,救必应小、大剂量组大鼠Occludin和Claudin-1表达升高(P<0.05或P<0.01)。表明救必应水提物防治大鼠小肠黏膜损伤的作用与其提高小肠黏膜紧密连接蛋白ZO-1、Occludin和Claudin-1表达有关。
A.正常对照组;B.模型对照组;C.救必应小剂量组;D.救必应大剂量组;①与正常对照组比较,χ2=-2.863~-2.674(IHC),t=0.003~0.798(WB),P<0.05;②与模型对照组比较,χ2=-3.253~-2.650(IHC),P<0.05;③与模型对照组比较,t=-0.129~0.644(WB),P<0.01。图2 免疫组化法(IHC)和免疫印迹法(WB)检测4组大鼠ZO-1、Occludin和Claudin-1水平及其半定量分析结果(×200) A.normal control group;B.model control group;C.Ilex rotunda Thunb.low dose group ;D.Ilex rotunda Thunb.high dose group.①Compared with normal control group,χ2=-2.863—-2.674(IHC),t=0.003-0.798(WB),P<0.05;②Compared with model control group,χ2=-3.253—-2.650(IHC),P<0.05; ③Compared with model control group,t=-0.129—0.644(WB),P< 0.01.Fig.2 ZO-1,Occludin and Claudin-1 detected by immunohistochemistry(IHC),Western blotting(WB) and their semi-quantitative analysis results in four groups of rats(×200)
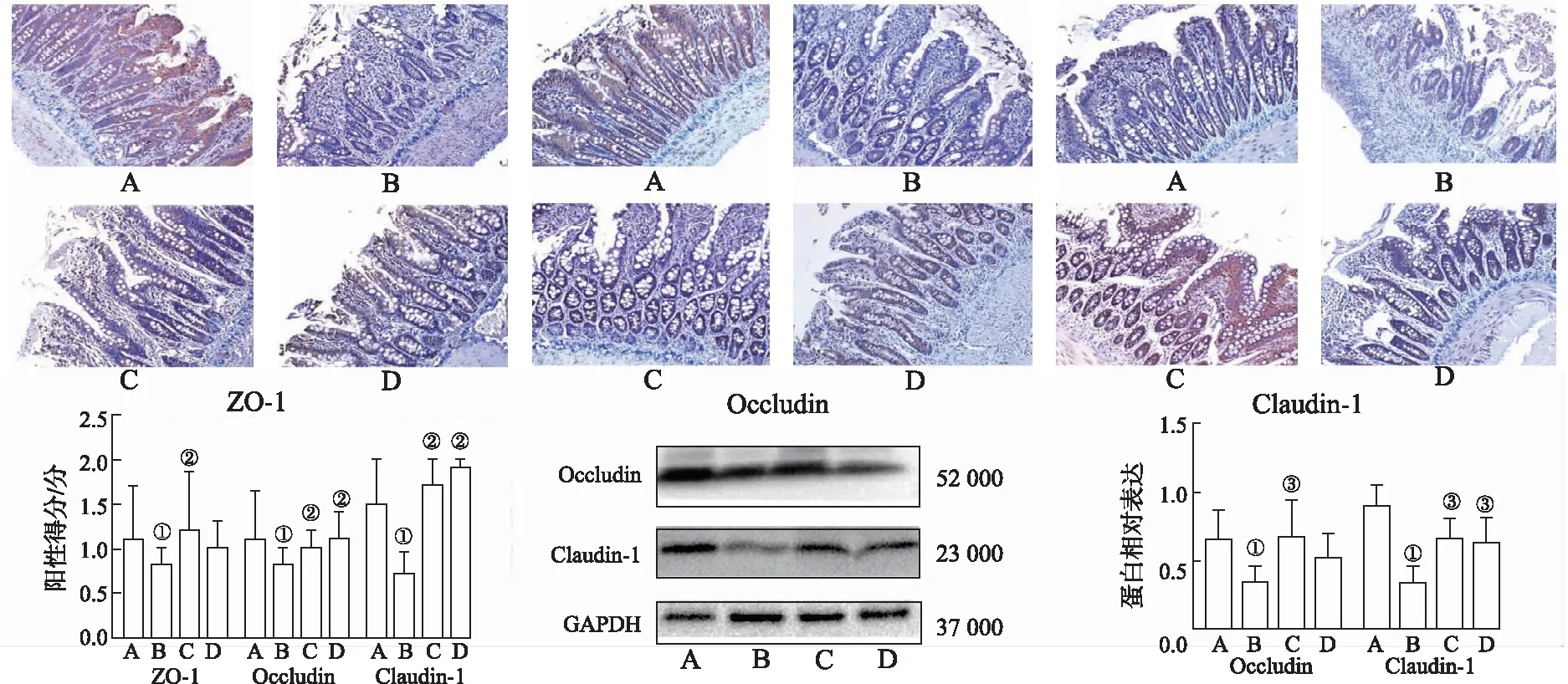
2.3救必应水提物对造模大鼠小肠黏膜粘附连接蛋白表达的影响 免疫组化和免疫印迹检测结果见图3,正常对照组粘附连接蛋白E-cadherin、α-catenin和β-catenin在小肠黏膜绒毛和隐窝可见表达;与正常对照组比较,模型对照组小肠黏膜E-cadherin、α-catenin和β-catenin表达下降(均P<0.05或P<0.01);与模型对照组比较,救必应小、大剂量组大鼠E-cadherin、α-catenin和β-catenin表达升高(P<0.05或P<0.01)。表明救必应水提物防治大鼠小肠黏膜损伤的作用与其提高小肠黏膜紧密连接蛋白E-cadherin、α-catenin和β-catenin表达有关。
2.4救必应水提物对造模大鼠小肠黏膜CDX-2表达的影响 免疫组化和免疫印迹检测结果见图4,正常对照组CDX-2在小肠黏膜绒毛和隐窝可见表达;与正常对照组比较,模型对照组小肠黏膜CDX-2表达下降(P<0.05);与模型对照组比较,救必应小、大剂量组大鼠小肠黏膜CDX-2表达升高(P<0.01或P<0.05)。与正常对照组比较,模型对照组CDX-2表达下降(P<0.05);与模型对照组比较,救必应小、大剂量组大鼠小肠黏膜CDX-2表达升高(P<0.05或P<0.01)。表明救必应水提物能提高吲哚美辛造模大鼠小肠黏膜CDX-2表达。
A.正常对照组;B.模型对照组;C.救必应小剂量组;D.救必应大剂量组。①与正常对照组比较,χ2=-2.806~-2.749(IHC),P<0.05;②与模型对照组比较, χ2=-3.318~-2.693(IHC),P<0.05;③与正常对照组比较,t=-1.731~ 1.773(WB),P<0.01;④与模型对照组比较,t=-0.652~ 1.680(WB),P<0.01。图3 免疫组化法(IHC)和免疫印迹法(WB)检测4组大鼠E-cadherin、α-catenin和β-catenin蛋白水平及其半定量分析结果(×200) A.normal control group;B.model control group;C.Ilex rotunda Thunb.low dose group ;D.Ilex rotunda Thunb.high dose group.①Compared with normal control group,χ2=-2.806—-2.749(IHC),P<0.05; ②Compared with model control group,χ2=-3.318—-2.693(IHC),P<0.05; ③Compared with normal control group,t=-1.731—1.773(WB),P< 0.01;④ Compared with model control group,t=-0.652—1.680(WB),P< 0.01.Fig.3 E-cadherin,α-catenin and β-catenin detected by immunohistochemistry(IHC),Western blotting(WB) and their semi-quantitative analysis results in four groups of rats(×200)
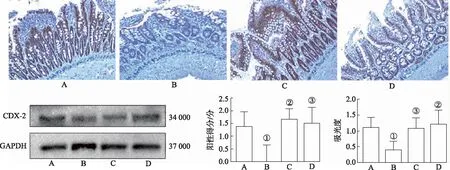
A.正常对照组;B.模型对照组;C.救必应小剂量组;D.救必应大剂量组。①与正常对照组比较,χ2=-2.680(IHC),t=0.106(WB),P<0.05;②与模型对照组比较,χ2=-3.385(IHC),t=1.276(WB),P<0.01;③与模型对照组比较,χ2=-2.765(IHC),t=0.098(WB),P<0.05。图4 免疫组化法(IHC)和免疫印迹法(WB)检测4组大鼠CDX-2蛋白水平及其半定量分析结果(×200) A.normal control group;B.model control group;C.Ilex rotunda Thunb.low dose group ;D.Ilex rotunda Thunb.high dose group.①Compared with normal control group,χ2=-2.680(IHC),t=0.106(WB),P<0.05; ②Compared with model control group,χ2=-3.385(IHC),t=1.276(WB),P<0.01; ③Compared with model control group,χ2=-2.765(IHC),t=0.098(WB),P<0.05.Fig.4 CDX-2 detected by immunohistochemistry(IHC),Western blotting(WB) and their semi-quantitative analysis results in four groups of rats(×200)
2.5救必应水提物对造模大鼠血浆D-乳酸的影响 正常对照组、模型对照组和救必应小、大剂量组血浆D-乳酸分别为(22.100±8.084),(44.715±13.809),(30.565±6.590),(26.284±8.702) μmol·L-1。与正常对照组比较,模型对照组大鼠血浆D-乳酸升高(t=-9.063,P<0.01),提示造模大鼠肠通透性增加,肠黏膜屏障受损;与模型对照组比较,救必应小、大剂量组血浆D-乳酸降低(t=-31.983,P<0.05;t=-1.544,P<0.01)。表明救必应水提物能抑制吲哚美辛所致的肠通透性增高,有助于恢复肠屏障功能,促进肠黏膜损伤修复。
3 讨论
胃肠黏膜损伤是临床常见病变,其中非甾体抗炎药是导致胃肠黏膜损伤的常见因素。报道显示,在胶囊内窥镜检查者中76.3%服用非甾体抗炎药的受试者发现了小肠黏膜的糜烂或溃疡性病变[8]。救必应在岭南地区广泛用于治疗胃肠病变,但其作用机制特别是对小肠病变的干预作用研究较少,本研究在非甾体抗炎药吲哚美辛所致大鼠小肠黏膜损伤模型上,观察救必应防治肠黏膜损伤的作用及机制。
细胞间连接(紧密连接、粘附连接、缝隙连接和桥粒等)是维持肠黏膜屏障的关键因素,其中紧密连接和粘附连接对维护肠黏膜屏障的作用尤为突出。细胞间连接控制着细胞旁转运途径的通透性,从而调节肠道屏障通透性[9-10]。临床研究发现,炎症性肠病患者在活动期紧密连接功能下调,其超微结构和蛋白组成被改变,并引起肠道通透性增加[11]。本研究结果表明,救必应水提物对吲哚美辛所致大鼠小肠黏膜损伤有防治作用,作用机制与其提高造模大鼠小肠黏膜紧密连接蛋白(ZO-1、Occludin和Claudin-1)和黏附连接蛋白(E-cadherin、α-catenin和β-catenin)表达有关;川陈皮素、广藿香提取物等有效组分能通过调节紧密蛋白的功能维持肠上皮屏障的完整性和通透性,从而减轻溃疡性结肠炎的症状[12],本研究结果与之有相似之处,提示细胞间连接蛋白是调理脾胃中药的作用靶点之一。
血浆D-乳酸是反映肠道通透性的指标,其在克罗恩病、缺血性肠病等多种消化系统疾病均升高[13]。紧密连接蛋白能反映肠道屏障完整性。结合肠通透性指标血浆D-乳酸能更好反映肠屏障功能。本研究结果表明,吲哚美辛诱导的大鼠小肠黏膜损伤模型不但导致黏膜细胞连接蛋白表达下降,还可致血浆D-乳酸升高,临床胃肠病变患者也有类似表现[14];救必应不但能提高造模大鼠小肠黏膜细胞连接蛋白表达,还能降低造模大鼠血浆D-乳酸水平,表明救必应可通过改善肠屏障功能而起肠黏膜保护作用。
CDX-2为肠特异性转录因子,能调节Rho-GEFs转录从而激活Rho信号级联,导致肌动蛋白细胞骨架的重组和粘附连接的增强[15]。肠上皮特异性缺乏CDX-2的小鼠出现巨噬细胞浸润和促炎级联反应的激活,导致慢性炎症反应[16]。本研究结果表明,吲哚美辛诱导的大鼠小肠黏膜损伤模型黏膜CDX-2表达下降,而救必应能提高造模大鼠小肠黏膜CDX-2表达,且有研究报道黄芩素、黄芩苷等清热解毒中药成分通过激活CDX-2而间接激活孕烷X受体,减轻小鼠实验性溃疡性结肠炎[17],本实验结果与之有相似之处。
本研究表明,救必应可通过作用于小肠黏膜紧密连接蛋白(ZO-1、Occludin和Claudin-1)和粘附连接蛋白(E-cadherin、α-catenin和β-catenin)、肠特异性转录因子CDX-2、肠通透性指标(血浆D-乳酸)等而防治小肠黏膜损伤,为探讨救必应肠黏膜损伤修复作用及机制提供了参考,也丰富了对岭南中药救必应的认识。本研究仅对救必应水提物进行动物水平的初步机制研究,后续可考虑对其药效物质基础等其他方面开展研究。
