津力达颗粒对高糖作用下小鼠胰岛β细胞增殖和凋亡的影响
2022-08-30陈伟王之旸付友娟刘子微乐岭
陈伟,王之旸,付友娟,刘子微,乐岭,
(1.湖北中医药大学第一临床学院,武汉 430070;2.中国人民解放军中部战区总医院内分泌科,武汉 430070)
2型糖尿病(type 2 diabetes mellitus,T2DM)是在遗传和环境等多因素作用下β细胞功能逐渐衰竭的代谢性疾病,其中糖毒性在胰岛β细胞衰竭中起重要作用[1]。改善高糖对β细胞的毒性作用是治疗糖尿病的关键途径之一。近年来中药治疗糖尿病的热点研究发现,胰岛β细胞功能与中医脾主运化功能密切相关,根据中医辨证论治理论使用益气健脾养阴中药可有效治疗糖尿病,保护胰岛β细胞[2]。津力达颗粒(Jinlidagranules,JLD)有健脾助运、益气养阴之功,多项研究表明它在降低血糖的同时可改善T2DM患者气阴两虚证的症状[3-4],但JLD能否保护胰岛β细胞尚不明确。因此,本研究拟通过观察JLD对体外高糖环境下的小鼠胰岛β细胞增殖、凋亡及胰岛素分泌的影响,探讨JLD对高糖诱导的胰岛β细胞损伤的保护作用及其可能机制。
1 材料与方法
1.1实验材料 MIN6 细胞(CRL-3237)购自美国菌种保藏中心(ATCC)。JLD(石家庄以岭药业股份有限公司,批准文号:国药准字Z20050845)。D-葡萄糖分析纯(国药集团化学试剂有限公司,批号 :WHC2006-0621);低糖(5.5 mmol·L-1) 达尔伯克改良伊格尔培养液(Dulbecco's modified Eagle's medium,DMEM)(美国Hyclone公司,批号:JM-SH30021.01B);高糖培养基自配,即称取D-葡萄糖溶于DMEM培养基,配制成终浓度25.0 mmol·L-1葡萄糖溶液;0.25%胰酶(美国Gibco公司,批号:15050065);10%胎牛血清(美国Corning公司,批号:35-076-CV);兔单抗p-Smad2/3、兔抗Smad2/3、兔多抗Bax、兔多抗Bcl-2均购自Cell signaling(批号:8828,8685,50599-2-Ig,12789-1-AP);兔多抗Caspase-3(武汉三鹰生物技术有限公司,批号:19677-1-AP);内参(GAPDH)抗体(杭州贤至生物有限公司,批号:AB-P-R 001); 辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔二抗(武汉博士德生物工程有限公司,批号:BA1054)。小鼠胰岛素酶联免疫吸附测定(ELISA)试剂盒(武汉优尔生商贸有限公司,批号:CEA448Mu);细胞凋亡检测试剂盒(南京凯基生物,批号:KGA108);细胞增殖检测试剂盒(噻唑蓝,MTT)(BIOSHARP公司,批号:0793);电化学发光(electrochemiluminescence,ECL)底物液(Thermo,批号:NCI5079);X光胶片购自柯达(XBT-1);显影定影试剂盒(天津市汉中摄影材料厂,D-76,批号:20190309)。倒置显微镜(日本OLYMPUS株式会社,IX51);全自动酶标仪(Thermo scientific,Multiskan MK3);微型高速离心机(美国Labnet,C2500-R-230 V);低速离心机(德国Eppendorf公司,5702R);电热恒温培养箱(日本ASONE,ICV-450);流式细胞仪(美国BD公司,BD FACSCalibur)。
1.2实验方法
1.2.1细胞培养 将MIN6细胞在含10%胎牛血清、100 U·mL-1青霉素、100 U·mL-1链霉素的 DEME基础培养基5 mL中培养,置于饱和湿度、温度37 ℃和5%二氧化碳(CO2)的培养箱中,生长至约80%融合时,收集细胞,在原瓶中以1:2至1:3传代培养。
1.2.2分组及干预 MTT法筛选JLD最佳干预浓度为200 mg·L-1。参考高糖诱导MIN6损伤模型方法[5],在干预之前,将所有细胞与5.5 mmol·L-1葡萄糖共同孵育24 h,再分别在5.5,25 mmol·L-1葡萄糖加或不加200 mg·L-1JLD继续培养48 h。根据不同培养条件分为4组,①正常对照(normal control,NC)组:5.5 mmol·L-1葡萄糖;②JLD组:5.5 mmol·L-1葡萄糖+200 mg·L-1JLD;③高糖(high glucose,HG)组:25 mmol·L-1葡萄糖;④HG+JLD组:25 mmol·L-1葡萄糖+200 mg·L-1JLD。
1.2.3ELISA法测葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS) 按条件培养MIN6细胞后,弃上清液,分别加入含2.8,16.7 mmol·L-1葡萄糖KRBH缓冲培养液37 ℃孵育0.5 h,收集各组细胞上清液检测胰岛素,每组设3个复孔,同时分别设空白孔、标准孔,采用小鼠胰岛素ELISA试剂盒,依照说明书进行检测:在各孔中依次加入标准品50 μL、抗小鼠胰岛素抗体50 μL、HRP标记的亲和素100 μL,再加显色底物 90 μL避光孵育15 min,最后加入终止液50 μL,终止反应,蓝色转黄色,立即用酶标仪在450 nm波长测量各孔的吸光度(A值),绘制标准曲线计算每组样品胰岛素浓度。
1.2.4MTT法检测细胞增殖 按照条件培养MIN6细胞,每组3个复孔,每孔加入 MTT10 μL,37 ℃培养4 h;吸出培养基,加入二甲亚砜150 μL震荡10 min;于酶标仪波长568 nm处测定各孔A值,取各组平均值后,计算细胞增殖率[细胞增殖率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%]。
1.2.5流式细胞术检测细胞凋亡 采用Annexin V-FITC/PI 凋亡检测试剂盒,依照说明书进行检测:①加入 缓冲液500 μL,重悬细胞;②AnnexinV-FITC 5 μL,混匀后加入 PI 5 μL,混匀;③室温避光反应5~15 min(同时设阴性对照,即正常细胞不加AnnexinV-FITC和PI;阳性对照1,以凋亡效果最明显的溶剂组作为阳性对照,只加AnnexinV-FITC单标5 μL;阳性对照2,以凋亡效果最明显的溶剂组作为阳性对照,只加 PI单标5 μL)。最后在1 h内采用流式细胞仪分析凋亡细胞比例。每组细胞检测各重复3次,取平均值。
1.2.6免疫印迹法(Western blotting)检测蛋白表达 终止培养后,收集各组细胞,提取蛋白,通过二喹啉甲酸蛋白浓度测定试剂盒检测蛋白浓度,每组蛋白质样本40 μg,在沸水下变形10 min,通过凝胶电泳分离,转移至聚偏二氟乙烯膜(polyvinylidene difluoride,PVDF)。转膜结束后,室温下,5%脱脂奶封闭2 h,随后将PVDF膜浸泡于用封闭稀释液稀释的一抗[GADPH、Smad2/3、p-Smad2/3(1:1000)、Bcl-2(1:2000)、Caspase-3(1:600)、Bax(1:3000)]孵育液中,4 ℃孵育过夜,三羟甲基氨甲烷缓冲盐溶液(trisbuffered saline with tween 20,TBST)充分洗涤PVDF膜,再在37 ℃下用稀释的HRP(1:50 000)摇床孵育2 h,TBST充分洗涤PVDF膜。电化学发光显影,使用BandScan分析胶片灰度值。
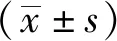
2 结果
2.1JLD增加高糖环境下的MIN6细胞的GSIS 16.7 mmol·L-1葡萄糖刺激的NC组、JLD组、HG组、HG+JLD组GSIS较2.8 mmol·L-1葡萄糖刺激时升高(P<0.01)。在2.8 mmol·L-1葡萄糖刺激下,HG组GSIS低于NC组(P<0.01),JLD组与正常对照组、HG+JLD组与HG组GSIS相似(P>0.05)。在16.7 mmol·L-1葡萄糖刺激下,HG组GSIS低于NC组(P<0.01),JLD组与NC组GSIS相似(P>0.05);HG+JLD组GSIS高于HG组(P<0.01)。见表1。
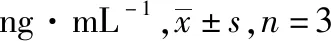
表1 4组胰岛细胞的GSIS比较 Tab.1 Comparison of GSIS from islet cells among four groups
2.2JLD促进高糖作用下的MIN6细胞增殖 NC组、JLD组、HG组和HG+JLD组MIN6细胞增殖率分别为(99.67±2.08)%,(106.33±2.00)%,(68.33±2.08)%和(84.33±4.04)%。 与NC组比较,HG组细胞增殖率降低(t=-14.25,P<0.01), JLD组细胞增殖率相似(P>0.05)。HG+JLD组较HG组细胞增殖率增高(t=15.31,P<0.01)。
2.3JLD抑制高糖诱导的MIN6细胞凋亡 与NC组比较,JLD组早、晚期细胞凋亡率下降(P<0.05或P<0.01),HG组细胞早、晚期凋亡率上升(均P<0.01)。HG+JLD组较HG组的早、晚期细胞凋亡率下降(均P<0.01)。见图1。
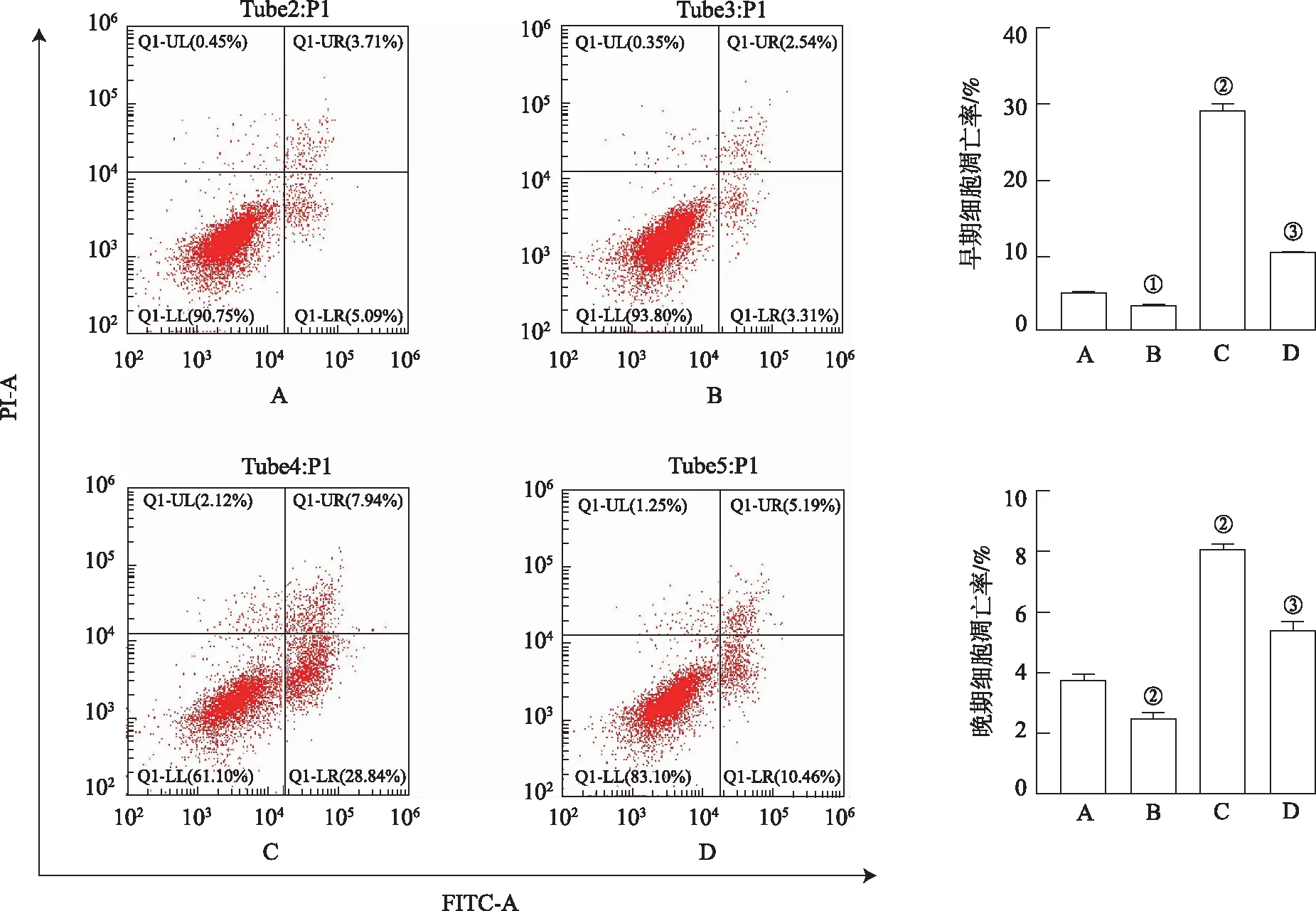
A.NC组;B.JLD组;C.HG组;D.HG+JLD组。①与NC组比较,t=-14.28,P<0.05;②与NC组比较,t=7.97,6.06,27.17,P<0.01;③与HG组比较,t=-50.68,-16.86,P<0.01。图1 4组流式细胞图 A.NC group;B.JLD group;C.HG group;D.HG+JLD group.①Compared with NC group,t=-14.28,P<0.05;②Compared with NC group,t=7.97,6.06,27.17,P<0.01;③Compared with HG group,t=-50.68,-16.86,P<0.01.Fig.1 Flow cytometry in four groups of cells
2.4JLD抑制高糖环境下的MIN6细胞p-Smad2/3、Caspase-3-2、Bax蛋白表达、促进Bcl-2蛋白表达 与NC组比较,HG组的p-Smad2/3、Caspase-3-2、Bax蛋白表达显著上调(均P<0.01),Bcl-2蛋白表达显著下调(P<0.01),Smad2/3、Caspase-3-1的蛋白表达相仿(P>0.05);JLD组的Smad2/3、p-Smad2/3、Caspase-3-1、Caspase-3-2、Bcl-2、Bax蛋白表达均相似(均P>0.05)。与HG组比较,HG+JLD组p-Smad2/3、Caspase-3-2、Bax蛋白表达均下调(P<0.01或P<0.05),Bcl-2蛋白表达显著上调(P<0.01),Smad2/3、Caspase-3-1蛋白表达差异无统计学意义(P>0.05)。见图2。
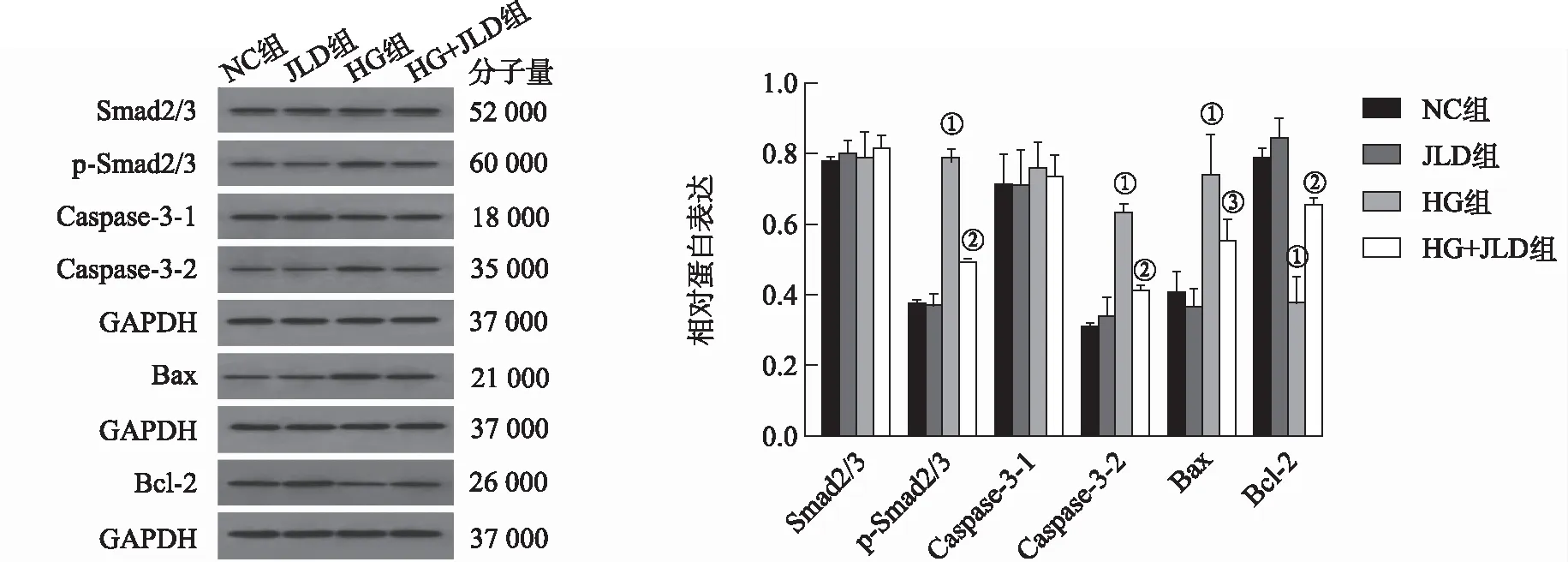
①与NC组比较,t=24.83,22.97,10.61,-10.61,P<0.01;②与HG组比较,t=-17.76,-15.21,7.15,P<0.01;③与HG组比较,t=-7.15,P<0.05。图2 4组细胞Smad2/3、p-Smad2/3、Caspase-3-1、Caspase-3-2、Bcl-2、Bax相对蛋白水平 ①Compared with NC group,t=24.83,22.97,10.61,-10.61,P<0.01;②Compared with HG group,t=-17.76,-15.21,7.15,P<0.01;③Compared with HG group,t=-7.15,P<0.05.Fig.2 Relative protein levels of Smad2/3,p-Smad2/3,Caspase-3-1,Caspase-3-2,Bcl-2 and Bax in four groups of cells
3 讨论
中医药治疗糖尿病可协同降糖、改善症状和体征、防治并发症及提高生活质量,因其副作用少已成为糖尿病治疗的研究热点。吴以岭院士的络病理论认为“脾”是糖尿病病机变化的中心环节,发病基础关乎脾,渴饮无度害于脾,治疗自然应顾及脾。JLD由人参、黄精、苍术、茯苓、葛根、苦参等17味中药组成,具有益气健脾、养阴生津的功效,被《中国2型糖尿病防治指南(2020年版)》推荐用于治疗气阴两虚型的糖尿病前期和T2DM患者。一项基于15项临床研究的Meta分析发现,JLD治疗的T2DM病患者与基线时比较胰岛素分泌指数升高、胰岛素抵抗指数降低[6],提示JLD对胰岛素分泌和抵抗均有改善作用。GSIS是评价胰岛β细胞分泌功能的重要指标,它主要受磷酸化磷脂酰肌醇3激酶/丝氨酸苏氨酸激酶(phosphoinositide-3-kinase/serine-threonine kinase,PI3K/AKT)[7]、AKT/糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)[8]、转化生长因子β/Smad(TGF-β/Smad)[9-10]等信号通路调控。JLD成分中的葛根素、黄精多糖均被证实有促进胰岛素分泌的作用。葛根素通过上调胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)受体的表达增强GLP-1刺激胰岛素分泌的作用[11]。黄精多糖可降低胰岛β细胞对氧化应激的敏感性,减轻胰腺免疫损伤和自由基损伤,从而改善胰岛β细胞的分泌功能[12]。本实验观察到JLD可改善高糖作用下胰岛β细胞GSIS,可能与JLD组分的协同作用有关。同时观察到JLD不增加正常环境下以及低糖刺激时的β细胞的GSIS,考虑JLD对胰岛β细胞的刺激可能与葡萄糖浓度有关,JLD对MIN6细胞GSIS是否呈现葡萄糖依赖性,有待进一步研究其作用机制。
JLD改善胰岛β细胞GSIS亦可能与其促进胰岛β细胞增殖、抑制凋亡有关。笔者既往研究[13-14]发现JLD可促进高糖作用下小鼠胰岛微血管内皮细胞及人脐静脉内皮细胞增殖,抑制高糖诱导的微血管内皮细胞、人脐静脉内皮细胞、SD大鼠阴茎海绵体平滑肌细胞凋亡,其机制可能与抑制细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)[14]信号通路有关。文献报道葛根素可上调 GLP-1受体激活PI3K/AKT通路,促进高脂饮食模型大鼠β 细胞增殖而减少其凋亡[11];黄精多糖可通过减少高糖刺激的超氧化物歧化酶发生非酶糖基化,减轻胰岛氧化损伤而减少胰岛细胞凋亡[12]。笔者观察到高糖对MIN6细胞具有抑制增殖和促进凋亡的作用,使用JLD干预后,高糖+JLD组胰岛β细胞增殖受到促进,凋亡被抑制。因此认为JLD可能具有促进高糖环境下胰岛β细胞增殖,抑制其凋亡的作用,其机制可能与组方中多个成分有关。
TGF-β/Smad是细胞内重要的信号通路,被认为与增殖和凋亡过程密切相关[15],以MIN6和小鼠胰岛为实验对象的体外实验发现抑制TGFβ信号通路可促进胰岛β细胞增殖[9- 10]。Smad是TGF-β通路重要的效应蛋白,TGFβ激活素诱导Smad蛋白磷酸化,p-Smad2和p-Smad3与Smad4形成复合体在细胞核内聚集调节靶基因转录,调控细胞生长、分化、凋亡等过程。JLD组方中葛根、山茱萸可通过上调ERK1/2、p-ERK1/2、MEK1/2蛋白表达调节MIN6细胞增殖与凋亡[16]。人参的多种提取物可通过TGF-β/Smad途径调节细胞生长、分化、凋亡等病理生理过程[17]。本实验发现高糖作用下MIN6细胞增殖减少、凋亡增加并伴p-Smad2/3表达上调,加用JLD可下调p-Smad2/3表达,上述作用被阻断,提示p-Smad2/3可能介导了JLD对高糖作用下MIN6细胞的保护作用。
Caspase-3是凋亡过程中关键的凋亡执行蛋白酶,活化的Caspase-3(Caspase-3-2)因可裂解细胞蛋白质故被认为是细胞凋亡标志物。Bcl家族中的Bcl-2、Bax可控制线粒体通透性并促进细胞色素C的通过。Bax上调、Bcl-2下调可丧失线粒体膜电位并释放细胞色素C,进而引发 Caspase-3 活化并导致细胞凋亡。本实验发现,高糖上调胰岛β细胞Caspase-3-2、Bax,下调Bcl-2,细胞凋亡率明显上升,加入JLD显著下调Caspase-3-2和Bax,降低凋亡率。提示高糖通过调控Caspase-3-2、Bax、Bcl-2诱导胰岛β细胞凋亡[18],而JLD可改善上述蛋白的异常表达,抑制高糖环境下的胰岛β细胞凋亡。但确切的机制有待更深入的分子生物学和动物、临床研究证实。
本研究探讨了高糖环境下JLD对胰岛β细胞功能的作用,以及对β细胞增殖凋亡的影响和可能机制,还探究了低糖环境下JLD对胰岛β细胞分泌功能的影响,为JLD降糖作用和安全性提供了更多的基础证据。
