腺花素对急性肺损伤模型小鼠的保护作用及其机制*
2022-08-30司徒杰曾诚
司徒杰,曾诚
(1.广州中医药大学第一附属医院药学部,广州 510405;2.广东药科大学新药研发中心,广州 510006)
急性肺损伤(acute lung injury,ALI)是指机体遭受到非心源性内外致病因素,造成以急性呼吸困难和难治性低氧血症为主要临床表现的一类疾病[1]。既往研究认为,ALI发病机制的本质是中性粒细胞异常激活、炎症因子释放及炎症信号通路的活化等一系列炎症反应的失控,最终导致肺组织破坏[2]。目前临床上主要以类固醇激素为主要药物治疗手段[3]。然而,类固醇激素药物副作用大且影响患者预后生活质量。因此,亟需寻找不良反应小、效果良好新型药物治疗ALI。
Toll样受体4(Toll-like receptor 4,TLR4)是一种跨膜受体,在脂多糖诱导的炎症反应中具有至关重要的作用[4]。脂多糖与TLR4结合后,通过髓样分化因子(myeloid differentiation factor,MyD88)途径可激活核因子κB(nuclear factor kappa-B,NF-κB)信号,从而导致中性粒细胞浸润和炎症因子“爆发”等一系列炎症反应[5]。多项研究表明,TLR4/MyD88/NF-κB通路的激活与ALI的发生发展密切相关[6]。
腺花素是从天然腺花香茶菜植物中提取的一种呋喃二萜类化合物[7],可以抑制过氧化物还原酶Ⅰ/Ⅱ诱导急性早幼粒白血病细胞分化且杀死肝癌细胞[8]。研究报道,腺花素可通过抑制NF-κB信号通路预防及治疗自身免疫性脑脊髓炎[9],提示抑制NF-κB信号通路可能是腺花素治疗疾病的潜在机制。但笔者目前未见腺花素对ALI治疗作用的研究报道。
本研究拟使用气管滴注脂多糖构建ALI作为动物模型和脂多糖诱导RAW264.7巨噬细胞损伤作为细胞模型,从体内外水平探究腺花素对ALI的作用,检测其对NF-κB及其上游信号的影响以探究其作用机制,为治疗ALI新药研发提供新的科学依据。
1 材料与方法
1.1主要材料与试剂 细胞为小鼠单核巨噬细胞RAW 264.7(中国科学院上海细胞库);C57BL/6雄性小鼠,无特定病原体(SPF)级,年龄6~8周,体质量22~25 g,广东省医学实验动物中心提供,实验动物使用许可证号:SYXK(粤)2017-0125;脂多糖 (Escherichia coli 055:B5) 、噻唑蓝(MTT)购于Sigma-Aldrich。TLR4、MyD88、p-NF-кB(Ser276)、NF-кB、Bcl-2、Bax及β-Tubulin购于Abclonal Technology;兔二抗IgG购于Cell Signaling Technology;Annexin V-FITC和碘化丙啶(propidium iodide,PI) 双染凋亡试剂盒购于贝博生物公司;瑞氏-吉姆萨复合染色液购于雷根生物公司;PierceTMBCA Protein Assay Kit购于Thermo scientific;白细胞介素(IL)-6、IL-1β和肿瘤坏死因子(TNF)-α 酶联免疫吸附测定(ELISA)试剂盒购于联科生物公司。
1.2实验方法
1.2.1造模及分组 将30只小鼠采用随机数字表法分为6组:正常对照组、模型对照组、地塞米松组及腺花素小、中、大剂量组(腺花素 5,10,20 mg·kg-1)[10],每组5只。0.3%戊巴比妥钠腹腔注射麻醉小鼠,正常对照组给予一定量的无菌磷酸盐缓冲液(PBS),其余组分别向气管内滴注1 mg·mL-1脂多糖造模,造模剂量为10 mg·kg-1[11],然后记录体质量。造模6 h后,地塞米松组腹腔注射地塞米松5 mg·kg-1[12],腺花素小、中、大组分别腹腔注射腺花素5,10和20 mg·kg-1[9]。18 h后用戊巴比妥钠腹腔注射深度麻醉,记录体质量,取肺泡灌洗液后处死小鼠取肺组织。
1.2.2支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)及肺组织样本的收集 用4 ℃预冷的无菌PBS 0.8 mL进行支气管肺泡灌洗,重复灌洗3次,BALF的回收率达75%为合格。BALF离心10 min(4 ℃,1000×g)。分别收集上清液和沉淀,上清液用二喹啉甲酸法进行总蛋白含量测定。沉淀部分用无菌PBS 100 μL重悬,并利用细胞计数板进行细胞总数计数。取细胞沉淀涂片进行瑞氏-吉姆萨染色,在低倍镜下计数200个细胞,根据颜色和形态学特征计数中性粒细胞及巨噬细胞百分比。支气管肺泡灌洗后分离肺组织,左肺用于苏木精-伊红(HE)染色,右肺-80 ℃冰箱保存备用。
1.2.3小鼠肺组织湿/干质量之比 用滤纸将小鼠右肺中叶组织表面血液和水分吸干,称质量,记录为湿质量(wet mass,W)。然后将右肺组织置于70 ℃烘箱内,烘烤48 h,再次称质量,记录为干质量(dry mass,D)。计算肺组织湿/干质量之比(W/D),判断肺部水肿情况。
1.2.4ELISA法检测肺组织匀浆中TNF-α、IL-1β、IL-6含量 选用联科生物公司ELISA试剂盒,检测TNF-α[13]、IL-6[14]。严格按照试剂盒说明书步骤操作,根据吸光度值(A)分别计算含量。
1.2.5HE染色 对分离后的左肺组织利用10%中性缓冲甲醛液进行固定,然后对左肺组织进行脱水,透明,石蜡包埋后切片(厚5 μm),进行HE染色,观察肺组织病理学改变。评分标准如下:①肺间质水肿;②肺泡水肿;③炎症细胞浸润;④肺泡出血;⑤肺泡结构完整性破坏。根据每项标准按无、轻、中、重分别记为0,1,2,3分,计算平均分为肺组织的病理评分。
1.2.6细胞活力检测 采用MTT法检测腺花素对RAW264.7细胞增殖的影响。以5×103个细胞每孔的密度接种到96孔板中,用不同浓度腺花素(0,2,4,8,12,16,20,24和28 μmol·L-1)处理24 h。药物干预结束后,每孔中加入无血清培养基180 μL和 0.5 mg·mL-1MTT溶液20 μL,并37 ℃下避光孵育4 h。最后,吸去96孔板中液体,每孔加入二甲亚砜150 μL,并用酶标仪在570 nm下测量每孔A值。细胞活力=(A实验组-A正常对照组)/(A模型对照组-A正常对照组)。
1.2.7细胞凋亡 将巨噬细胞RAW 264.7接种于6孔板中,待细胞贴壁后,正常对照组、模型对照组[15]及腺花素小、中、大剂量组[9]分别给予药物处理12 h。严格按照试剂盒说明书操作,用流式细胞仪检测。
1.2.8免疫印迹法(Western blotting)检测细胞和肺组织中TLR4、MyD88、p-NF-κB、NF-κB、Bcl-2及Bax含量 将巨噬细胞RAW 264.7接种于6孔板中,待细胞贴壁后,正常对照组、模型对照组及腺花素小、中、大剂量组分别给予药物处理12 h进行制样。将各组小鼠麻醉处死后,取100 mg左肺部组织匀浆进行制样。所得细胞和小鼠肺组织样品经过电泳、电转及封闭过程后,分别在4 ℃下孵育抗体(稀释倍数1:1000)过夜,次日加入兔二抗(稀释倍数1:10 000)孵育,最后加入发光液后于凝胶成像仪进行曝光拍照,采用Image J 1.47v统计灰度值,计算TLR4、MyD88、p-NF-κB、NF-κB、Bcl-2及Bax相对表达量。
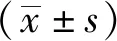
2 结果
2.1小鼠基本状态 与正常对照组比较,模型对照组活跃度降低,呼吸不顺畅,体质量明显减轻,肺组织湿干比显著增大,BALF中总蛋白浓度明显升高(P<0.05);与模型对照组比较,地塞米松组和腺花素小、中、大剂量组小鼠基本状态改善,体质量减轻较小,肺组织湿干比明显减小,BALF中总蛋白浓度显著降低(P<0.05)(表1、图1)。HE染色结果显示,与正常对照组比较,模型对照组肺组织损伤严重,肺泡间隔增宽,肺组织间质及肺泡腔可见大量炎症细胞浸润,地塞米松组及腺花素小、中、大剂量组肺组织损伤改善,肺泡间隔清晰,肺泡结构完整度较高(图2)。对HE切片进行评分,与正常对照组比较,模型对照组得分较高(P<0.05),肺组织损伤严重;与模型对照组比较,地塞米松组及腺花素小、中、大剂量均得分降低,肺组织损伤显著改善(P<0.05)(表2)。
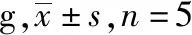
表1 6组小鼠治疗前后体质量的变化比较 Tab.1 Comparison of changes of mass among six groups of mice before and after treatments
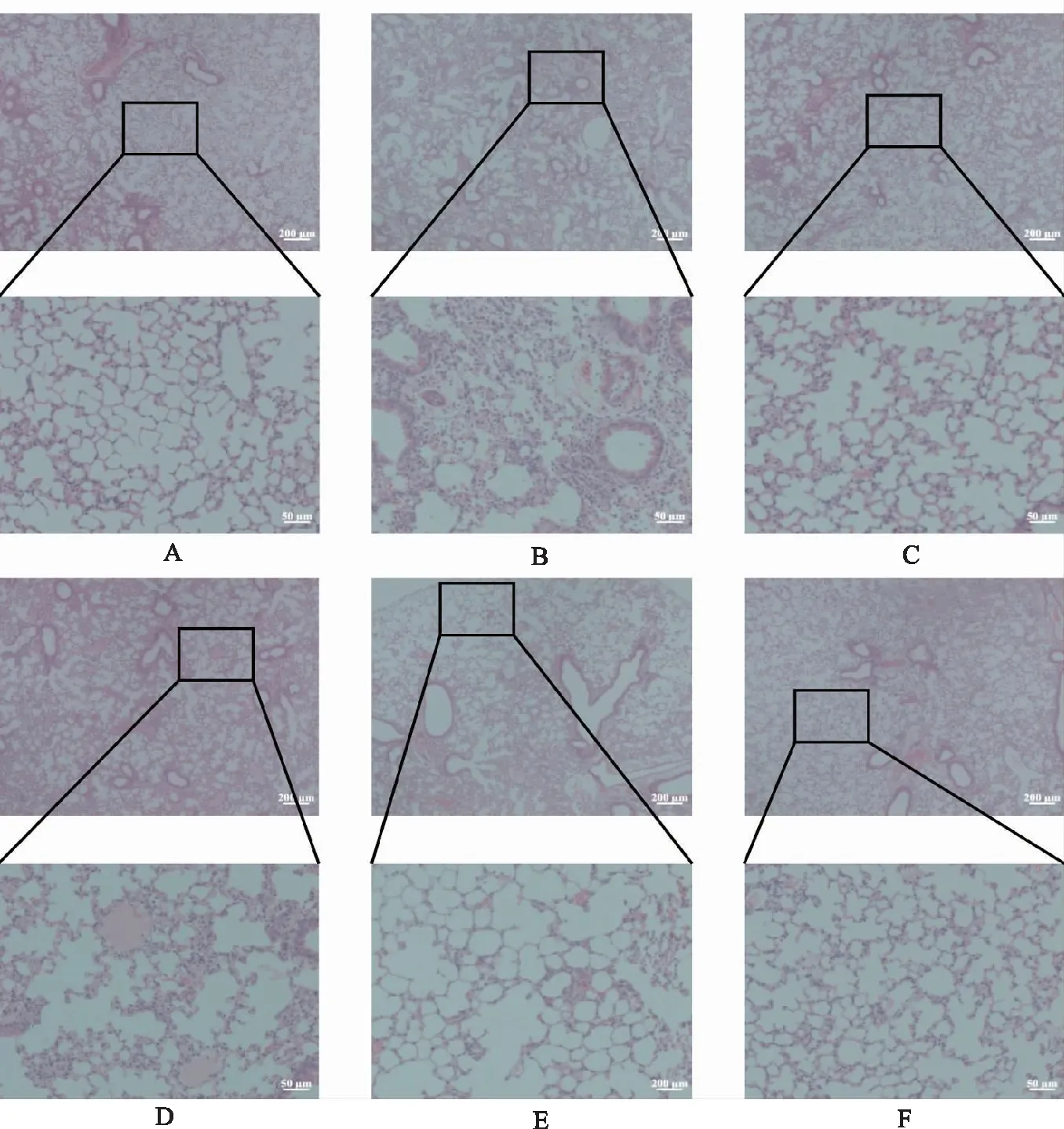
A.正常对照组;B.模型对照组;C.地塞米松组;D.腺花素小剂量组;E.腺花素中剂量组;F.腺花素大剂量组。图2 6组小鼠肺组织HE染色 A.normal control group;B.model control group;C.dexamethasone group;D.adenanthin low dose group;E.adenanthin middle dose group;F.adenanthin high dose group.
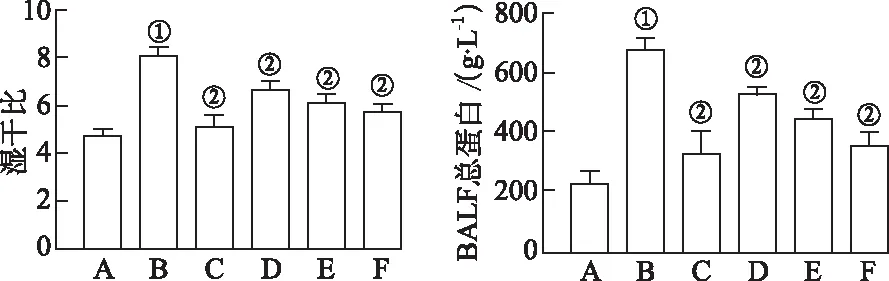
A.正常对照组;B.模型对照组;C.地塞米松组;D.腺花素小剂量组;E.腺花素中剂量组;F.腺花素大剂量组。①与正常对照组比较,t=16.81,18.09,P<0.05;②与模型对照组比较,t=6.56~12.70,P<0.05。图1 6组小鼠肺组织湿干比及BALF中总蛋白A.normal control group;B.model control group;C.dexamethasone group;D.adenanthin low dose group;E.adenanthin middle dose group;F.adenanthin high dose group. ①Compared with normal control group,t=16.81,18.09,P<0.05;②Compared with model control group,t=6.56—12.70,P<0.05.Fig.1 Wet-dry ratio of lung tissue and total protein in BALF in six groups of
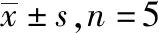
表2 6组小鼠肺组织病理损伤评分比较
2.2腺花素对ALI小鼠炎症反应的影响 与正常对照组比较,模型对照组小鼠肺组织匀浆中TNF-α、IL-1β以及IL-6的含量均显著上升(P<0.05)(图3),巨噬细胞及中性粒细胞比例显著增大(表3);与模型对照组比较,地塞米松和腺花素中、大剂量组TNF-α、IL-1β以及IL-6的含量均显著降低(图3)、中性粒细胞及巨噬细胞比例(表3)明显减小(P<0.05)。
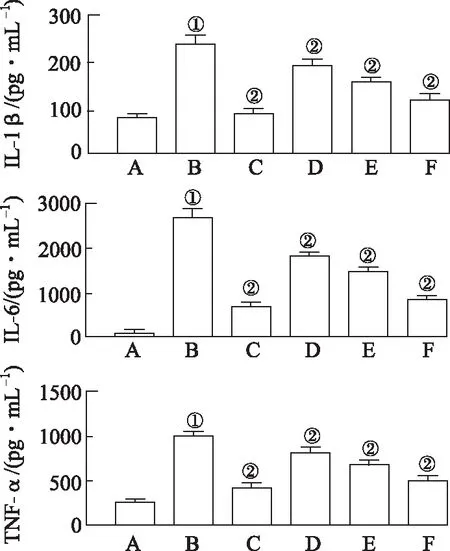
A.正常对照组;B.模型对照组;C.地塞米松组;D.腺花素小剂量组;E.腺花素中剂量组;F.腺花素大剂量组。 ①与正常对照组比较,t=20.22,33.15,28.23,P<0.05;②与模型对照组比较,t=5.24~27.94,P<0.05。图3 6组小鼠肺组织IL-1β、IL-6及TNF-α含量A.normal control group;B.model control group;C.dexamethasone group;D.adenanthin low dose group;E.adenanthin middle dose group;F.adenanthin high dose group. ①Compared with normal control group,t=20.22,33.15,28.23,P<0.05;②Compared with model control group,t=5.24—27.94,P<0.05.Fig.3 Contents of IL-1β,IL-6 and TNF-α in lung tissues of six groups of
表3 6组小鼠BALF中总细胞、巨噬细胞和中性粒细胞数量比较 Tab.3 Comparison of number of total cells,macrophages and neutrophils in BALF among six groups of mice
2.3腺花素对巨噬细胞RAW264.7生长的影响 MTT结果显示,0~12 μmol·L-1浓度范围内腺花素对巨噬细胞RAW264.7生长无明显抑制作用(图4)。
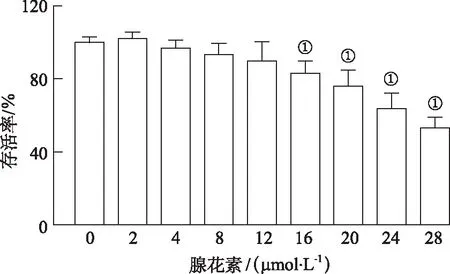
①与0 μmol·L-1比较,t=4.42~14.14,P<0.05。图4 腺花素对RAW264.7细胞存活率的影响 ①Compared with 0 μmol·L-1,t=4.42—14.14,P<0.05.Fig.4 Effect of adenanthin on RAW264.7 cell viability
2.4腺花素对脂多糖诱导的巨噬细胞RAW 264.7凋亡的影响 流式细胞术的结果显示,与正常对照组比较,模型对照组凋亡率显著上升;与模型对照组比较,地塞米松组和腺花素小、中、大剂量组凋亡率显著下降,表明腺花素可抑制脂多糖诱导的巨噬细胞凋亡(P<0.05)(图5)。
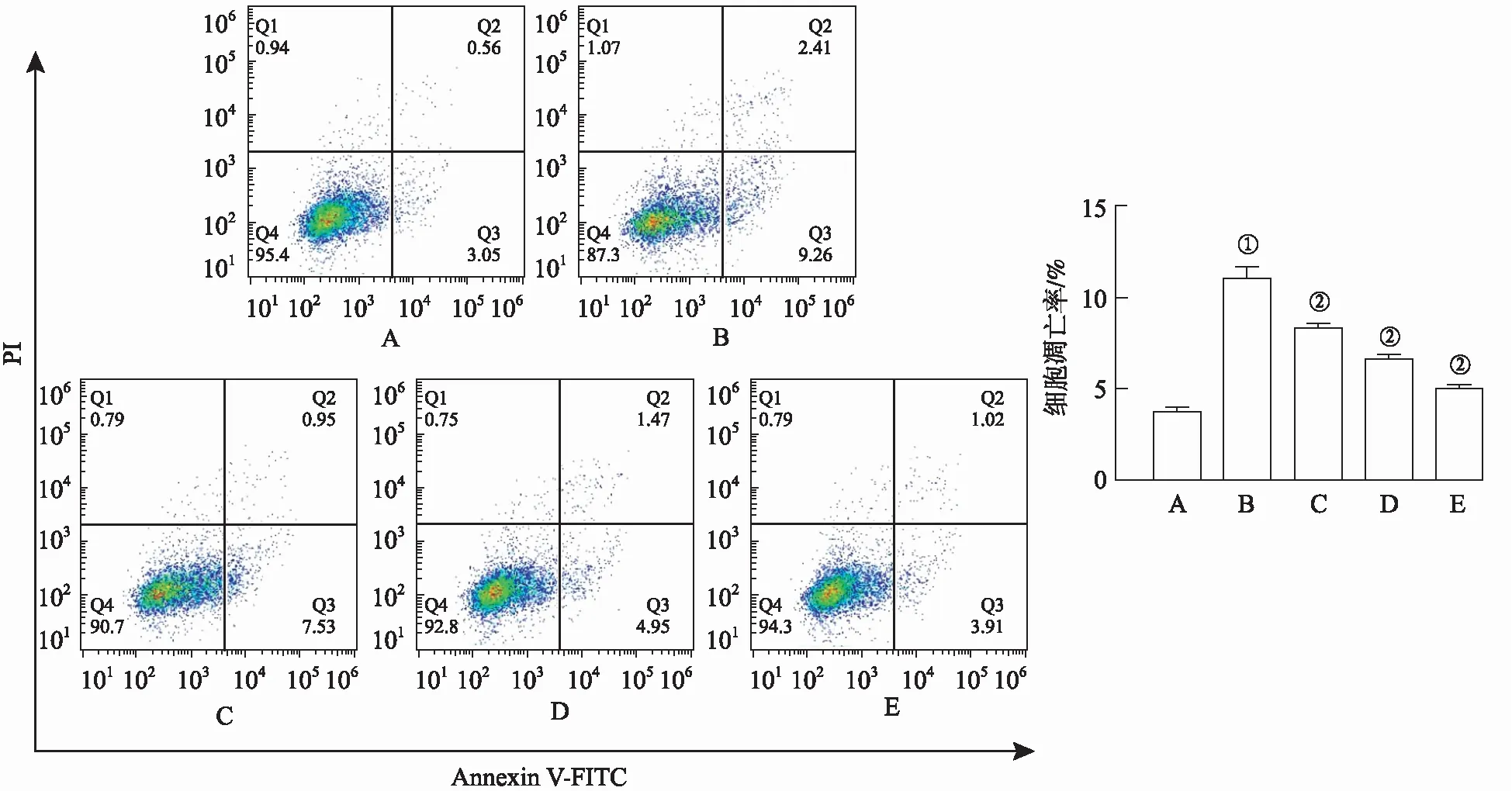
A.正常对照组;B.模型对照组;C.腺花素小剂量组;D.腺花素中剂量组;E.腺花素大剂量组。①与正常对照组比较,t=22.77,P<0.05;②与模型对照组比较,t=8.20,13.49,19.21,P<0.05。图5 5组RAW 264.7细胞凋亡率A.normal control group;B.model control group;C.adenanthin low dose group;D.adenanthin middle dose group;E.adenanthin high dose group.①Compared with normal control group,t=22.77,P<0.05;②Compared with model control group,t=8.20,13.49,19.21,P<0.05.Fig.5 Apoptosis rate of RAW 264.7 cells in five
2.5腺花素对脂多糖诱导的巨噬细胞中TLR4/MyD88/NF-κB信号通路及凋亡相关蛋白的影响 Western blotting结果显示,腺花素能够显著抑制巨噬细胞NF-κB的磷酸化以及TLR4和MyD88蛋白的表达,并伴随促凋亡蛋白Bax显著减少和抗凋亡蛋白Bcl-2表达显著增多(P<0.05)(图6和表4)。上述实验证明,腺花素可抑制TLR4/MyD88/NF-κB信号通路并降低脂多糖诱导的巨噬细胞凋亡率。
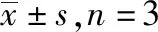
表4 5组RAW 264.7细胞TLR4、 MyD88、p-NF-κB、NF-κB、Bcl-2 和Bax蛋白相对表达量比较 Tab.4 Comparison of relative expression of TLR4,MyD88,p-NF-κB,NF-κB,Bcl-2 and Bax in RAW 264.7 cells among five groups

A.正常对照组;B.模型对照组;C.腺花素小剂量组;D.腺花素中剂量组;E.腺花素大剂量组。图6 5组RAW 264.7细胞TLR4、MyD88、p-NF-κB、NF-κB、Bcl-2 和Bax蛋白的表达(n=3) A.normal control group;B.model control group;C.adenanthin low dose group;D.adenanthin middle dose group;E.adenanthin high dose group.Fig.6 Expression of TLR4, MyD88,p-NF-κB,NF-κB,Bcl-2 and Bax in five groups of RAW 264.7 cells(n=3)
2.6腺花素对脂多糖所致ALI小鼠肺组织TLR4/MyD88/NF-κB信号通路的影响 Western blotting结果显示,腺花素可抑制NF-κB的磷酸化以及TLR4和MyD88蛋白的表达,并伴随促凋亡蛋白Bax显著减少和抗凋亡蛋白Bcl-2表达显著增多(P<0.05)(表5和图7)。上述实验证明,腺花素抑制TLR4/MyD88/NF-κB信号通路并改善ALI。
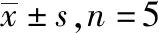
表5 5组小鼠肺组织中TLR4、 MyD88、p-NF-κB、NF-κB、Bcl-2 和Bax蛋白相对表达量比较 Tab.5 Comparison of relative expression of TLR4, MyD88,p-NF-κB,NF-κB,Bcl-2 and Bax in lung tissues among five groups of mice
3 讨论
随着医疗技术的不断发展,治疗ALI的新方法不断涌现,但ALI的病死率30%~50%,依然很高[16]。ALI患者接受类固醇药物治疗后,药物引起的全身不良反应严重影响生活质量[17]。因此亟需研发治疗效果好、不良反应小和价格适宜的有效药物。本研究发现,与脂多糖诱导的ALI小鼠模型对照组比较,腺花素组小鼠的基本状态得到改善,肺组织的湿干比及BALF中总蛋白浓度明显降低。HE染色结果显示,腺花素各组ALI小鼠的肺组织病理损伤均改善,肺泡间隔清晰,肺泡结构完整度较高。腺花素大剂量组的治疗效果与地塞米松组接近。上述结果表明,腺花素能有效改善ALI。
ALI具有炎症细胞浸润及炎症因子爆发等特点,导致弥散性功能受损、肺泡顺应性下降等临床表现[18]。研究报道,腺花素可通过抑制炎症细胞的浸润及降低TNF-α和IL-6等炎症因子分泌,从而预防和治疗自身免疫性脑脊髓炎[9]。本实验结果显示,腺花素能显著减少小鼠肺组织炎症因子TNF-α、IL-1β以及IL-6的分泌及中性粒细胞和巨噬细胞的数量。在脂多糖诱导的ALI体外实验中,在0~12 μmol·L-1浓度范围内腺花素对巨噬细胞RAW264.7生长无明显抑制作用,且能够抑制脂多糖诱导的巨噬细胞的凋亡,表明小剂量腺花素对细胞无毒性作用且能有效抑制脂多糖诱导的肺部组织炎症反应及炎症细胞的凋亡。
研究表明,转录因子NF-κB活化后可进入细胞核与B细胞免疫球蛋白κ链启动子结合,导致炎症的发生[19]。作为NF-κB的上游蛋白,TLR4也有助于先天免疫反应中炎症递质的释放[20],并且可通过激活下游MyD88和NF-κB信号通路调节炎症反应[21]。为了进一步验证腺花素是否通过NF-κB信号通路改善脂多糖诱导的急性肺损伤,本实验分别开展了相应的体内外实验。Western blotting结果显示,腺花素抑制脂多糖诱导的RAW 264.7细胞NF-κB的磷酸化及其NF-κB信号通路上游TLR4和MyD88蛋白的表达,并伴随促凋亡蛋白Bax表达的显著减少和抗凋亡蛋白Bcl-2表达显著增多。进一步的体内实验显示,NF-κB信号通路及凋亡相关蛋白的改变与体外细胞实验结果一致。此外,YIN等[9]也报道腺花素可以通过抑制NF-κB信号通路预防及治疗自身免疫性脑脊髓炎。因此,TLR4/MyD88/NF-κB信号级联可能是腺花素治疗ALI的重要炎症信号通路。既往研究显示,腺花素能靶向抑制硫氧还原蛋白-硫氧还原蛋白还原酶系统[22]。本实验结果提示TLR4/MyD88/NF-κB可能是腺花素另一个重要的靶向信号。然而,腺花素抑制TLR4/MyD88/NF-κB信号通路的机制还有待进一步探究。
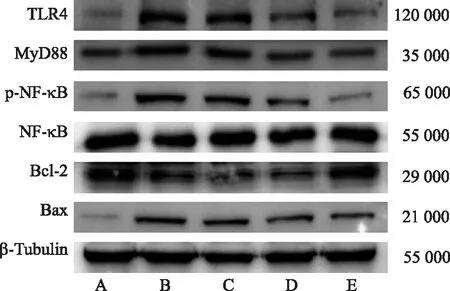
A.正常对照组;B.模型对照组;C.腺花素小剂量组;D.腺花素中剂量组;E.腺花素大剂量组。图7 5组小鼠肺组织中TLR4、MyD88、p-NF-κB、NF-κB、Bcl-2 和Bax蛋白的表达(n=5) A.normal control group;B.model control group;C.adenanthin low dose group;D.adenanthin middle dose group;E.adenanthin high dose group.Fig.7 Expression of TLR4,MyD88,p-NF-κB,NF-κB,Bcl-2,and Bax in lung tissues among five groups of mice(n=5)
