谷氨酸通过调控脊髓背角GABABR2参与慢性胰腺炎痛的机制研究
2022-08-29徐卉红邱海波王莉琴朱成成陆智杰
徐卉红,邱海波,王莉琴,朱成成,陆智杰
(1.海军军医大学第三附属医院麻醉科,上海 200438; 2.中国人民解放军海军第九0五医院麻醉科,上海 200052)
反复发作的腹痛是慢性胰腺炎(chronic pancreatitis,CP)患者主要的临床症状,疼痛管理成为治疗CP的核心[1]。传统理论认为,胰腺自身病变是疼痛的主要来源,但基于这一理论建立的内镜或手术治疗对CP痛的缓解不尽人意[2]。有研究[3-5]认为,CP患者的脑岛、继发性躯体感觉皮层及扣带回皮层发生重构,下行抑制疼痛调节受损。定量感觉测试结果显示约50%的CP痛患者存在中枢敏化[6],手术或去内脏神经治疗对缓解疼痛十分有限[7]。提示中枢敏化可能是难治性CP痛发生的重要机制。
脊髓背角是外周伤害信息向中枢传递的第一站。GABA在脊髓背角中广泛表达,作为GABA发挥作用的受体之一GABABR(GABABreceptor)也在脊髓表达,并且与疼痛的调控密切相关。当脊髓背角GABABR激活后,与外周伤害感受密切相关的Aδ纤维和C纤维的活性降低;神经递质谷氨酸(Glu)、P物质、钙基因相关肽等伤害性物质的释放减少[8-9]。有研究[10]表明,正常大鼠鞘内给予GABABR激动剂后,大鼠伤害阈值增加;而给予GABABR拮抗剂后,大鼠会出现痛觉异常和痛觉过敏。可见,脊髓背角GABABR表达失调导致GABA的抑制效应减弱是疼痛传导的重要机制。
GABABR是由GABABR1和GABABR2两个亚单位组成的异二聚G蛋白偶联受体[11]。链唑霉素诱导的糖尿病神经病理性疼痛模型大鼠脊髓背角处GABABR1表达下调[10],但未研究GABABR1下调的机制。此外,有研究[12]显示,体外培养的海马神经元和大脑皮层神经元细胞膜上GABABR的下调,主要是由Glu介导非其自身配体GABA所致。但是,Glu调控脊髓背角GABABR2参与CP痛并不明确,本研究将着重探讨其机制。
1 材料与方法
1.1 主要试剂
DBTC、1% Triton-X100、DAPI、抗IB4抗体(美国Sigma公司);RIPA细胞裂解液(美国Thermo公司);正常山羊血清封闭液(博士德生物工程有限公司);抗GABABR2抗体、抗MAP2抗体(美国Abcam公司);抗GAPDH抗体(天津三箭公司);胰酶(上海化学试剂公司);荧光二抗、多聚-L-鸟氨酸、0.05%EDTA、Neurobasal培养液、DMEM高糖培养液、神经生长因子B27、L-谷氨酰胺、青链霉素双抗、F12、FBS胎牛血清(美国Invitrogen公司);Sulfo-NHS-LC-Biotin(磺酸基-NHS-生物素)、High Capacity Neutr Agarose Resin(高结合能力中性亲和素琼脂糖树脂)(美国Thermo Scientific Pierce公司)。
1.2 主要仪器
常规手术精细解剖器械一套(美国WPI公司);垂直洁净工作台(上海博讯实业有限公司);体视解剖显微镜、荧光显微镜(德国Leica公司);Von Frey电子测痛仪(美国IITC公司);CO2培养箱(日本三洋公司);JY92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);LHR体外灌流泵(上海医疗器械厂);Western-blot电泳系统、Western Blot转膜系统(美国Bio-Rad公司);热电台式多用冷冻离心机(美国Thermo Scientific公司);Image Quant LAS4000化学发光成像仪(通用电气健康护理生物科学股份公司)。
1.3 实验动物与CP模型的构建
200 g左右的Wistar雄性大鼠共42只,购于上海斯莱克动物实验有限公司。实验动物的使用处理经海军军医大学伦理委员会批准。实验在海军军医大学第三附属医院麻醉科实验室进行。
CP模型的构建参照文献[13]。腹腔注射2%戊巴比妥钠溶液(50 mg·kg-1),大鼠麻醉后经尾静脉注射DBTC溶液(8 mg·kg-1DBTC,溶剂为2:3的甘油和无水酒精)。建模成功的大鼠为CP组(n=30),其中,6只建模后用于行为学检测,并于术后21 d取脊髓用于免疫荧光实验;24只在DBTC注射后3、7、14、21 d用于Western-blot实验,每个时间点6只大鼠。对照组12只仅注射等剂量溶剂,其中6只用于行为学检测,完成行为学实验后取脊髓用于免疫荧光实验;6只用于Western-blot实验取材。
1.4 腹部机械痛的测定
腹部机械痛的测定参考Randall-Sellito法[14]。测试前3 d将大鼠放在有机玻璃箱(22 cm×22 cm×30 cm)中适应30 min·d-1。测试当天大鼠适应同前,用Von Frey电子测痛仪探头逐渐加压大鼠左上腹部。当大鼠抬腹、走开或腹肌收缩时停止加压,记录此时数值。每只大鼠测3次,每次间隔10 min。腹部机械痛阈值为3次平均值。
1.5 免疫荧光组织化学法
脊髓组织切成20 μm厚度,0.01 mol·L-1PBS漂洗15 min×3次后用(1%NGS+1% Triton-X100+0.01 mol·L-1PBS)室温封闭2 h。4 ℃孵育一抗(抗GABABR2抗体,1:1000;抗IB4抗体,1:1000)24 h。0.01 mol·L-1PBS漂洗15 min×3次。室温避光孵育1:2000的二抗(羊抗兔:Alexa Fluor 488,羊抗小鼠:Alexa Fluor 588)2 h。
1.6 脊髓背角神经元原代培养
脊髓背角神经元的培养参照文献[15]。多聚-L-鸟氨酸包被6孔细胞培养板。取胎龄13 d大鼠脊髓背角,并剪成1 mm3大小。用2 mL含0.05%EDTA的胰酶37 ℃消化15 min后用含78%DMEM、10%FBS、10%F12、1%青链霉素双抗、1%L-谷氨酰胺的完全培养液终止消化。重悬后0.07 nm细胞滤膜过滤,1000 次·min-1离心5 min去上清。加入培养液重悬沉淀后种于细胞培养板。接种密度为5×105孔-1,置于37 ℃、5%CO2的培养箱。每 3~4 d半量换细胞培养液。
1.7 细胞膜蛋白的提取
原代培养的脊髓背角神经元分别用20、40 μmol·L-1的Glu孵育30 min后,提取细胞膜蛋白。脊髓背角神经元加入含0.5 mg的Sulfo-NHS-LC-biotin溶液2 mL(pH=8.0),4 ℃30 min。用30 μL 1 mol·L-1glycine(pH=7.4)中止生物素反应。RIPA裂解液裂解45 min,13 000 次·min-14 ℃ 离心15 min,取上清。取一部分用于直接加入SDS上样缓冲液,100 ℃×5 min,用于测定总蛋白浓度;剩余部分用与连接了亲和素的琼脂糖树脂磁珠(Neutr Avidin beads)处理。4 ℃冰箱过夜后10 000 g 离心3 min。将离心沉淀物Neutr Avidin beads用4 ℃ PBS溶液洗涤5次,10 000 g离心 1 min,沉淀物加入SDS上样缓冲液,100 ℃×5 min,即得细胞膜蛋白。
1.8 Western-blot实验
组织蛋白提取按前法所述[16]。蛋白经5%浓缩胶和10%分离胶后,转到PVDF膜上。用5%脱脂牛奶+5%BSA的TBST溶液室温封闭2 h。4 ℃孵育一抗(抗GABABR2抗体1:1000;抗GAPDH抗体1:2000),24 h。室温孵育二抗(羊抗兔,1:5000)2 h。ECL显影。Image J分析定量。
1.9 细胞免疫荧光法
4%PFA固定培养7 d的脊髓背角神经元。0.01 mol·L-1PBS漂洗3次,用10%NGS+1%Triton-X100的0.01 mol·L-1PBS溶液室温封闭2 h。4 ℃孵育一抗GABABR2抗体(1:500)及抗MAP2抗体(1:500),24 h。室温避光孵育二抗1:2000(羊抗兔:Alexa Fluor 488,羊抗鼠:Alexa Fluor 588)2 h。
1.10 统计学方法
采用SPSS17.0统计软件分析,数据以均数±标准差表示。大鼠腹部机械痛阈值采用重复测量方差分析。Western-blot实验结果对照组为数值1,其他组测定数值为与对照组的相对值。多组间的均数分析采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠CP模型及腹部机械痛的测定
CP模型大鼠胰腺HE染色可见散在的胰腺细胞肿胀坏死,广泛的炎症细胞浸润及大量的纤维结缔组织增生(图1)。腹部机械痛测定结果显示:与对照组相比,在DBTC单次尾静脉注射后,大鼠对腹部机械刺激敏感性明显增强(图2),说明CP大鼠痛阈明显降低。
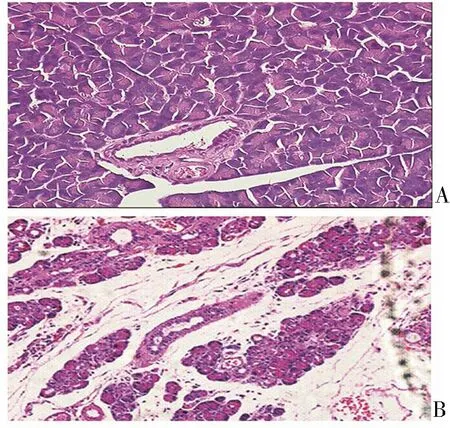
A:对照组;B:DBTC注射21 d。

1—4:依次为DBTC注射3、7、14、21 d。
2.2 大鼠脊髓背角GABABR2的分布和表达
免疫荧光法检测显示GABABR2主要表达在脊髓背角Ⅰ、Ⅱ层。同时,GABABR2与伤害感受神经元标记物IB4共染结果显示,GABABR2在伤害感受神经元中广泛表达(图3)。这提示脊髓背角GABABR2可能参与疼痛的调控。
2.3 CP大鼠脊髓背角GABABR2表达的变化
与对照组比较,CP组大鼠在DBTC注射后3、7、14、21 d时GABABR2的相对表达分别为(105.70±17.78)%(P=1.000)、(53.82±12.40)%(P<0.001)、(53.01±13.01)%(P<0.001)、(48.04±9.31)%(P<0.001),见图4A。结果显示CP大鼠脊髓背角GABABR2的表达明显减少。同时,免疫荧光组织化学法结果也显示DBTC注射21 d大鼠脊髓背角处GABABR2的表达显著下降(图4B)。

1:对照组;2—5:依次为DBTC注射3、7、14、21 d。*P<0.001与对照组比较。
2.4 Glu对脊髓背角神经元GABABR2表达的影响
脊髓背角神经元培养7 d后,进行GABABR2和神经元标记物MAP2的共染。结果显示,GABABR2在体外培养的脊髓背角神经元上表达广泛(图5A)。用20和40 μmol·L-1的Glu刺激体外培养7 d的脊髓背角神经元30 min。Western-blot结果显示,GABABR2的相对表达分别为(55.01±7.51)%(P<0.001)和(46.28±7.70)%(P<0.001),差异具有统计学意义(图5B)。结果提示,Glu可能通过调控GABABR2参与慢性胰腺炎痛。
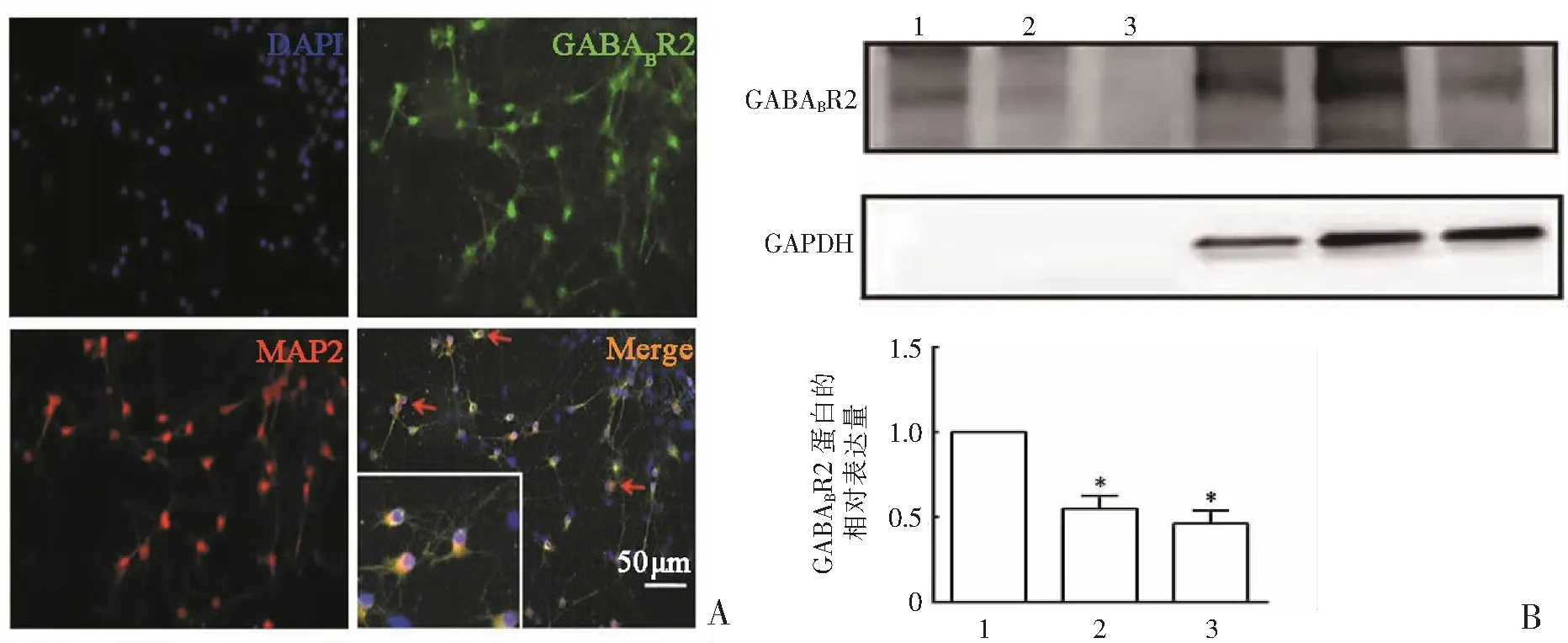
A:蓝色为细胞核标记物DAPI,绿色为GABABR2,红色为神经元标记物MAP2,黄色为共标;B:1为对照组;2为Glu 20 μmol·L-1;3为Glu 40 μmol·L-1。*P<0.001,n=6。
3 讨论
CP痛的发生机制尚不明确。本研究结果表明,CP大鼠腹部机械痛阈值明显下降(P<0.001);DBTC注射7 d后大鼠脊髓背角GABABR2的表达显著下降(P<0.001);Glu刺激脊髓背角神经元后GABABR2的表达下调(P<0.001)。LÜTT等[13,17]的研究表明,单次尾静脉注射DBTC后24 h内诱发急性水肿性胰腺炎和胆胰管扩张。注射DBTC 7 d后胰腺呈现慢性胰腺炎的病理特征(胰腺组织内可见广泛的单核细胞浸润和坏死纤维化形成),并持续2个月。该模型不但操作简单,且能很好地模拟人慢性胰腺炎的发病过程。本实验利用该方法建立CP模型大鼠的胰腺形态学结果与此相似。
本研究显示GABABR2主要表达在与疼痛密切相关的脊髓背角浅层,这一结果与前期的研究[18-19]一致。同时笔者检测到CP模型大鼠脊髓背角中GABABR2的表达显著下降(P<0.001)。本实验未具体研究GABABR2在哪一类神经元上减少,主要是因为GABABR2在脊髓背角处分布广泛,其发挥功能可以通过突触前、突触后和突触外机制。脊髓背角处给予GABABR2激动剂可以产生突触前和突触后抑制,阻断初级感觉神经末梢释放Glu、P物质及钙基因相关肽[9,20]。鞘内给予GABABR2拮抗剂phaclofen诱导触摸痛和温觉痛[21]。脊髓处而非延髓头端腹内侧区给予选择性的GABABR2拮抗剂CGP 35348可以阻断baclofen的镇痛效应[22],这进一步提示脊髓处GABABR2的功能与疼痛的发生密切相关。因此,本研究结果提示脊髓背角处GABABR2下调是导致CP痛的一个重要机制。
调控细胞膜上受体表达的机制包括基转录、翻译和受体磷酸化等修饰、受体的降解、重新分布及与配体的结合能力等。有研究[12,23]显示,中枢神经系统GABABR主要存在于兴奋性神经元上,与谷氨酸能神经元密切相关。海马和大脑皮层神经元GABABR2的表达并不受其自身配体GABA的影响,而是由Glu通过调控GABABR2的内吞,导致细胞膜GABABR的表达减少。本研究结果显示,20和40 μmol·L-1Glu刺激体外培养7 d的脊髓背角神经元30 min后,细胞膜上GABABR2的表达较未处理组显著下降(P<0.001),与以往的研究[12,23]结果一致。本研究未检测CP模型大鼠脊髓背角Glu水平,但已有文献[7,24]证实,Glu通过激活N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptor,NMDA)受体参与CP痛患者中枢敏化过程,CP痛患者给予NMDA受体拮抗剂S-氯胺酮后,疼痛显著缓解。CP痛患者扣带回皮层Glu的水平增加与疼痛密切相关[25]。本研究为Glu在CP痛的发生中提出了另一机制。
总之,Glu通过调控脊髓背角GABABR2的表达参与慢性胰腺炎痛的发生。这一结果为缓解慢性胰腺炎痛提供了新的中枢敏化机制。
