血清CircRNA_100367与鼻咽癌患者放疗敏感性及预后的相关性
2022-08-29皮本元魏媛媛佘文胜
皮本元,魏媛媛,佘文胜
(鄂州市中心医院耳鼻喉科,湖北 鄂州 436000)
鼻咽癌(NPC)是一种起源于鼻咽部黏膜上皮细胞的上皮性恶性肿瘤,主要在我国南方流行[1]。NPC对放射治疗比其他头颈部恶性肿瘤更敏感,故5年总生存率从32%增加到52%[2-3]。然而放疗后局部复发和远处转移仍然是该病治疗失败的主要原因[4]。因此尽早诊断和治疗是改善患者预后的重要措施。目前许多证据[5-8]表明环状RNA(circRNA)在肿瘤形成过程中具有重要作用。同时有研究[8]显示circRNA在NPC中亦发挥重要作用。在NPC细胞中,circRNA的表达与其抗辐射表型有关。SU等[9]从人类食管鳞癌亲本细胞系KYSE-150和自建放射抗拒细胞系KYSE-150R的基因芯片数据中获得了大量的circRNA差异表达谱,发现circRNA_100367表达明显上调;LIU等[10]进一步证实circRNA_100367可通过miR-217/Wnt3通路调节食管癌细胞的放疗敏感性。然而circRNA_100367在调节NPC放疗敏感性方面的作用尚不清楚。因此,在本研究中利用临床样本探讨circRNA_100367在NPC诊断和放疗反应预测中的价值,旨在为NPC的临床治疗提供新的生物标志物。
1 对象与方法
1.1 研究对象
收集2010年9月至2017年10月在鄂州市中心医院头颈外科耳鼻咽喉科接受根治性放射治疗的NPC患者(NPC组)血清样本222例,其中男164例,女58例,年龄18~76岁。同时,收集同期健康人(来源于体检人群)的血清样本200例作为对照组。所有患者在术后放疗前收集血清样本用于实时荧光定量PCR法检测。本研究经本院医学伦理委员会审核通过,所有受试者提供书面知情同意参与本研究。
纳入标准:1)18岁及以上;2)病理活检诊断为无角化和/或未分化鼻咽癌(世界卫生组织Ⅱ/Ⅲ型);3)无抗癌治疗史和癌症病史;4)Kamofsky评分≥80分;5)诊断时无远处转移和伴发恶性肿瘤证据;6)心脏功能(纽约心脏协会心功能分级≤Ⅱ级)、肝脏(总胆红素和丙氨酸含量≤1.5倍参考上限)和肾功能(肌酐含量≤1.5倍参考上限)正常;7)完成处方治疗;8)在获得血清前未接受放疗或化疗。根据美国癌症联合委员会(AJCC)第八版分期系统进行TNM分期。
排除标准:1)对放疗不耐受者;2)血清基线生化数据不完整者;3)未完成规定治疗方案或任何原因退出研究者。
1.2 放射治疗方法
治疗前的评估包括完整的病史、身体检查、血液学和生物化学特征、纤维鼻咽镜、胸部X线片、腹部超声、鼻咽和颈部磁共振成像、全身骨骼扫描或全身FDG PET/CT。根据本院治疗原则,原发肿瘤和颈部恶性淋巴结均采用调强放疗(IMRT)。用Elekta直线加速器(Precise 1120,瑞典Elekta公司)以220 cGy·min-1的剂量率对患者进行6MV X射线治疗。计划剂量为鼻咽部肿瘤体积(GTVnx)计划靶体积(PTV)66~72 Gy(28~33 次分割),恶性淋巴结肿瘤体积(GTVnd)的PTV为64~70 Gy(28~33 次分割)。原则上,Ⅰ期患者单独使用放疗,Ⅱ期患者进行单独化疗或同步放化疗,晚期患者(Ⅲ—Ⅳ期)进行同步放化疗并/或不并诱导/辅助铂类化疗(IC/AC)。经过7~8周的放射治疗后,根据治疗效果分患者为放射敏感组和抵抗组。放射抵抗是指放射治疗结束后3个月以上有持续性病变(原发肿瘤和/或颈部淋巴结不完全消退)或鼻咽和/或颈部淋巴结局部复发的患者。放射敏感指放射治疗后3个月以上无局部残留病变(完全消退),且12个月以上无局部复发。
1.3 实时荧光定量PCR法
在放疗前24~48 h,用外周静脉穿刺法获取血样5 mL,离心取血清样本并保存在-80 ℃备用。利用Trizol试剂盒(美国赛默飞公司)提取血清总RNA。RNase R(美国Epicentre公司)用于降解线性RNA。使用1 μg circRNA,采用PrimeScriptTMRT试剂盒(大连宝生物工程有限公司)合成cDNA。应用SYBR premix Ex Taq试剂盒(大连宝生物工程有限公司)配制10 μL反应体系(2 μL cDNA模板),在Applied BiosystemsABI 7500 Real Time PCR系统上进行实时荧光PCR反应:95 ℃ 2 min,39个扩增周期(95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s)。每个周期后测量荧光曲线。采用2-ΔΔCt法测定circRNA_100367的相对表达量。引物序列:(正向)5′-GGCACTGGAACCAGACTCTC-3′,(反向)5′-GTAGCCAGCCTTTCCTCCTT-3′。
1.4 观察指标
比较2组血清circRNA_100367水平。单因素和多因素Logistic回归分析血清circRNA_100367水平与NPC患者临床病理特征、放疗反应及预后的关系。预后指标:无进展生存期(PFS)、次要终点包括总生存率(OS)、无远处转移生存率(DMF);PFS指从确诊之日到疾病进展之日或最后一次随访之日的时间。
1.5 统计学方法

2 结果
2.1 2组血清circRNA_100367水平比较
对照组、NPC组血清circRNA_100367相对表达量分别为1.00±0.27、2.53±1.82,2组间比较,其差异有统计学意义(t=11.767,P<0.001)。见图1。ROC曲线结果显示,血清circRNA_100367水平用于NPC诊断的ROC曲线下面积为0.857(95%CI:0.821~0.892),对应截断值为1.433,特异度为94.5%,敏感度69.8%。见图2。

图1 2组血清circRNA_100367水平比较

1-特异性
2.2 NPC患者血清circRNA_100367水平与临床病理特征的关系
根据ROC曲线得到的最佳截断值1.433,将NPC患者分为低表达组(<1.433)和高表达组(≥1.433)。经单因素分析,NPC患者血清circRNA_100367表达水平与患者年龄、TNM分期有关(均P<0.05),而与患者性别、病理分型、T分期、N分期、有无化疗、KPS评分、PGTVnx、PGTVnd、血红蛋白水平均无显著相关性(均P>0.05)。见表1。

表1 NPC患者血清circRNA_100367水平与临床病理特征的关系 n(%)
2.3 NPC患者血清circRNA_100367水平与放疗反应性的关系
根据放疗效果分为放射敏感组(n=149)和抵抗组(n=73)。对于进行单纯放疗的患者,放射敏感组血清circRNA_100367水平低于抵抗组[(1.87±1.38 )比(3.77±2.05),t=3.204、P=0.003]。见图3A。对于联合化疗的患者,放射敏感组血清circRNA_100367水平亦显著低于抵抗组[(1.75±1.05)比(4.12±2.01),t=10.519、P<0.001]。见图3B。

A:单纯放疗患者;B:同步放化疗患者。
2.4 单因素和多因素Logistic回归分析NPC患者血清circRNA_100367水平与放疗反应的关系
经单因素和多因素Logistic回归分析,T分期、血清circRNA_100367水平是放疗反应的独立预测因子(P<0.05)。见表2。

表2 血清circRNA_100367水平与放疗反应的关系
2.5 ROC曲线分析血清circRNA_100367对放疗反应的预测价值
血清circRNA_100367预测放疗反应的ROC曲线下面积为0.860(95%CI:0.807~0.913),对应截断值为2.222,特异度为78.1%,敏感度80.5%。见图4。
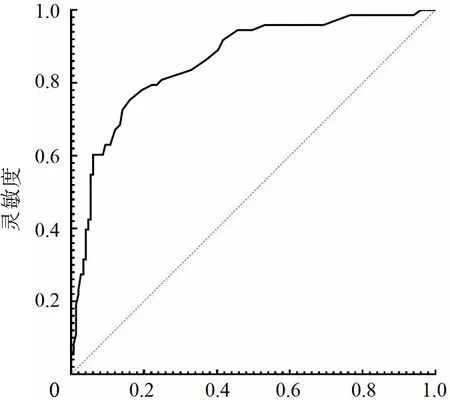
1-特异性
2.6 Kaplan-Meier生存曲线分析
随访期间,NPC患者术后中位生存时间均为29个月,血清circRNA_100367低表达组和高表达组患者无进展生存率分别为77.0%(114/148)、47.3%(35/74),差异有统计学意义(χ2=22.647,P<0.001);总生存率分别为81.8%(121/148)、59.5%(44/74),差异有统计学意义(χ2=11.978,P=0.001);无远处转移生存率分别为90.5%(134/148)、68.9%(51/74),差异有统计学意义(χ2=18.694,P<0.001)。见图5。
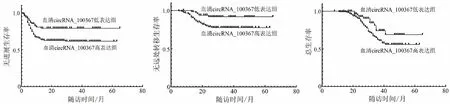
图5 Kaplan-Meier生存曲线
3 讨论
放疗是鼻咽癌患者的首选治疗方法[3]。然而,约30%的NPC因放疗抵抗在放疗后出现局部复发和远处转移,是许多患者治疗成功的主要障碍[11]。因此,确定可靠的预测放疗敏感性的特异生物标志物对NPC的治疗及改善患者预后至关重要。本研究利用实时荧光定量PCR法检测了NPC患者和健康对照血清circRNA_100367表达水平的差异,并评估了其在NPC放疗反应及预后评估中的价值,结果表明,NPC患者血清circRNA_100367水平显著高于对照组。此外,与放射敏感组NPC患者相比,放射抵抗组患者血清circRNA_100367表达显著增加。而且,进一步的分析表明基线血清circRNA_100367水平升高可能是NPC患者放疗抵抗的独立预测因素。
与线性RNA不同,circRNA以闭环结构存在于体内,在多种体液中稳定表达,具有较高的组织特异性[12]。有证据[6]揭示了circRNA在癌症中的功能,它可能作为一个新的生物标志物和癌症治疗的靶标。例如,LIU等[13]的研究表明,高水平的circRPMS1与NPC患者的转移和较差的生存结果相关,这表明circRPMS1可能是爱泼斯坦-巴尔病毒相关NPC的潜在预后标志物和治疗靶点。SHUAI等[14]报道了hsa_circRNA_001387在NPC中高表达,与鼻咽癌的发生发展密切相关,可作为NPC良好的诊断和预后生物标志物。CHEN等[15]发现circ_0000215在NPC中的表达显著上调,可用作NPC的潜在生物标志物和治疗靶点。这些发现表明,circRNA可能成为一种新型的癌症诊断生物标志物和治疗靶点,对早期诊断肿瘤和改善患者生活质量具有重要的潜在临床价值[16]。先前有研究也确定了hsa _ circRNA_100367在其他类型的癌症中的作用,如LIU等[10]证实circRNA_100367在人类抗辐射食管癌细胞系中显著上调。此外,下调circRNA_100367通过下调miR-217靶基因/Wnt3蛋白抑制KYSE-150R细胞的增殖和集落形成[10]。这些研究表明,circRNA_100367的功能具有一定的癌症特异性。本研究结果发现NPC患者血清circRNA_100367的表达明显不同,NPC组患者的血清circRNA_100367的水平显著高于对照组,经ROC曲线结果显示,基线血清circRNA_100367用于诊断NPC的AUC>0.7,说明circRNA_100367有望成为NPC潜在的生物标志物。
放射抵抗是目前癌症复发和治疗失败的重要原因之一[4]。因此,提高对放疗的敏感性是提高鼻咽癌治疗成功率的重点。非编码RNA(ncRNA)已被确定为NPC放疗的促进剂或抑制剂,一般主要通过调节与放疗敏感性密切相关的重要过程的不同基因来调节癌细胞对放疗的反应[17]。首先,ncRNA可通过调控DNA损伤感觉和诱导细胞周期阻滞影响放疗敏感性,例如LncRNA PVT1的敲低显著降低了ATM、p53和Chk2的磷酸化水平,导致NPC细胞在放疗后的DNA修复能力下降并增强其放射敏感性[18]。其次,ncRNA可通过调节DNA损伤修复影响放疗敏感性,例如miR-24可以通过直接调节Jab1/CSN5抑制NPC肿瘤生长并增加NPC放射敏感性。最近,有证据[19]发现一些circRNA可通过调节细胞凋亡来影响癌细胞对放疗的敏感性。先前研究[5]表明,circRNA通过以序列特异性方式隔离靶miRNA发挥作用,从而降低miRNA活性并增加miRNA靶基因的表达。这些circRNA可能作为miRNA海绵发挥作用,转化为蛋白质,或与RNA结合蛋白相互作用,以调节其下游靶点。例如,Hsa_circRNA_006660被进一步证明可通过miR-1276增强放射敏感性[20]。circRNA_000543可以作为NPC中miR-9的海绵,通过靶向miR-9/PDGFRB轴使NPC细胞对放疗敏感[21]。circRNA_100367可通过调控下游靶点miR-217/Wnt3来调节放疗敏感性[10]。这些研究表明,circRNA_100367可能是鼻咽癌细胞增殖、转移和放射敏感性的调节机制。本研究结果显示敏感组患者放疗后血清circRNA_100367水平降低且显著低于放疗抵抗患者,而且进一步的研究证实,circRNA_100367表达水平是放疗抵抗的独立预测因子。提示血清circRNA_100367水平升高可能通过影响肿瘤细胞对放射线的敏感性,进而导致患者放疗失败和预后不良。
综上,circRNA_100367水平在NPC患者血清中显著上调,并且与患者放射抵抗性有关,提示血清中 circRNA_100367可能是预测NPC放疗效果和实时监测耐药性的新生物标志物。但是本研究也存在一定的局限性,例如样本量仍然偏小,circRNA_100367作用机制尚不明确,需要更深入的体内外研究来进一步证实其在NPC中的临床应用价值。
