炮制和煎煮方式对化痰祛湿活血方成分的影响Δ
2022-08-26刘鸣昊黄亚森张振凌张丽慧刘素彤赵文霞河南中医药大学第一附属医院脾胃肝胆病科郑州450006河南中医药大学药学院郑州450046
刘鸣昊,黄亚森,张振凌,张丽慧,刘素彤,赵文霞#(.河南中医药大学第一附属医院脾胃肝胆病科,郑州 450006;.河南中医药大学药学院,郑州 450046)
化痰祛湿活血方(Huatan qushi huoxue decoction,HQHD)是由全国第五批名老中医赵文霞教授根据非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)病机“痰湿内停、淤血阻滞、肝失条达”而定的经验方,由泽泻(30 g)、丹参(15 g)、郁金(15 g)、海藻(15 g)、决明子(10 g)、山楂(15 g)、水飞蓟(15 g)、柴胡(6 g)共8味中药组成。方中泽泻利水渗湿、行气消瘀,为君药;丹参活血化瘀、凉血安神,郁金活血止痛、行气解郁,海藻化痰利湿、软坚消痰,共为臣药;决明子清肝明目,山楂消积散瘀,水飞蓟清热解毒,共为佐药;柴胡疏肝理气,为使药;全方共奏化痰祛湿活血之功。目前,该方已被开发为院内制剂消脂护肝胶囊(豫药制字Z20130331[郑]),用于临床治疗NASH,效果良好[1]。
本课题组通过查阅文献发现,决明子长于清肝热,炮制前后均可减轻肝损伤,降低丙氨酸转氨酶、天冬氨酸转氨酶水平,且生品活性强于炮制品[2];山楂生品和炮制品的降脂效果存在差异,以净山楂最优[3];泽泻经麸炒后寒性稍微,长于渗湿和脾、降浊以升清,利尿作用较生品显著增强,主要活性成分23-乙酰泽泻醇B的含量较生品有所升高[4];丹参经酒炙后,寒凉之性缓和,活血祛瘀、调经止痛之功增强[5];郁金能够引药入血,且醋郁金在止痛方面的作用最强[6];醋柴胡可引药入肝,疏肝解瘀止痛效果强于生品[7]。另外,有研究分析了传统汤剂单煎与混煎的化学成分和药效学指标的异同,发现复方混煎和药味单煎混合汤剂在化学成分、药效和临床应用上均各有不同[8-10]。可见,炮制方法和煎煮方式均会影响单味药材及全方的功效。HQHD原方中,各味药材均采用生品,而未选用活性更优的泽泻、丹参、郁金、柴胡炮制品,目前也尚无研究探讨HQHD单煎与混煎对药材有效成分溶出的影响。
中药成分复杂,检测任一种或多种活性成分均不能表征其整体质量,故质量一致性成为中药质量控制的难点。目前,中药指纹图结合高效液相色谱(HPLC)法已成为中药质量控制的主要手段[11-12]。本课题组前期采用正交实验优化了HQHD标准汤剂的煎煮工艺,得其最优煎煮工艺为12倍量水、浸润60 min、煎煮30 min×3次。在此基础上,本研究拟建立以生品或炮制品及不同煎煮方式所得HQHD样品的指纹图谱,并进行相似度评价;同时,拟结合主成分分析(principal component analysis,PCA)和偏最小二乘法-判别分析(partial least squaresdiscriminant analysis,PLS-DA)等化学模式识别方法,分析各批次样品的成分差异,以期为完善HQHD质量标准、实现后续相关制剂的质量控制提供依据,也为HQHD中各药味的炮制及煎煮方式的进一步优化提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260型HPLC仪(美国Agilent公司)、BSA224S-CWⅠ级电子天平[赛多利斯科学仪器(北京)有限公司]、YP10002Ⅲ级电子天平(上海衡际科学仪器有限公司)等。
1.2 主要药品与试剂
芦丁、橙皮苷、丹酚酸B、槲皮素、水飞蓟宾、木犀草素、橙黄决明素、23-乙酰泽泻醇C、柴胡皂苷b2对照品均购自成都普思生物科技股份有限公司,批号分别为153-18-4、520-26-3、121521-90-2、522-12-3、802918-57-6、327-97-9、67979-25-3、26575-93-9、58316-41-9,纯度均不低于98.0%。
泽泻饮片(批号分别为200403641、200202011、200500691)、丹参饮片(批号分别为 201200631、201100181)、柴胡饮片(批号分别为 200403321、200900911)、山楂饮片(批号分别为 210102511、191203831、190804891)、决明子饮片(批号分别为191000099、190200099)、郁金饮 片(批号分别为201201391、191001211)、海藻饮片(批号190601871)均购自康美药业股份有限公司;郁金饮片(批号200502)购自普宁市泽群中药饮片有限公司;海藻饮片(批号200801)购自广东天诚中药饮片有限公司;水飞蓟饮片(批号190501CP0122)购自安国市光明饮片加工厂。上述饮片由河南中医药大学药学院张振凌教授鉴定均为真品,且符合2020年版《中国药典》(一部)规定。
黄酒(批号20160909,酒精度≥10.0%)购自湖州老恒和酿造有限公司;米醋(批号20201022)购自山西紫林醋业股份有限公司;麦麸购自南阳市新田园农产品有限公司;甲醇、磷酸均为色谱纯,其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 饮片炮制
2.1.1 麸炒泽泻 大火预热待烟起时,将麦麸快速均匀撒入热锅中,改中火加热,快速投入提前净制且大小分档的泽泻片快速翻炒,炒至泽泻表面呈黄色、麦麸呈焦黄色时出锅,筛去麦麸,晾凉。每100 kg泽泻用麦麸10 kg。
2.1.2 酒丹参 取丹参片,照2020年版《中国药典》(四部)“0213炮制通则”项下酒炙法炒干[13]。每100 kg丹参用黄酒20 kg。
2.1.3 醋郁金 取郁金片净制,大小分档,加入规定剂量的米醋搅拌均匀,闷润,待醋被吸尽后,置铁锅内,用文火加热并快速翻炒,控制温度在200℃左右,炒干,取出晾凉,筛去碎屑。每100 kg郁金用米醋10 kg。
2.1.4 醋柴胡 取柴胡片,照2020年版《中国药典》(四部)“0213炮制通则”项下醋炙法炒干[13]。每100 kg柴胡用米醋20 kg。
2.2 色谱条件
以Eclipse XDS-C18(250 mm×4.6 mm,5 μm)为色谱柱,以甲醇(A)-1%磷酸溶液为流动相进行梯度洗脱(0~5 min,5.0%A→8.0%A;5~7 min,8.0%A;7~25 min,8.0%A→39.0%A;25~32 min,39.0%A→41.5%A;32~36 min,41.5%A;36~55 min,41.5%A→48.0%A;55~65 min,48.0%A→67.4%A;65~75 min,67.4%A→95.0%A;75~77 min,95.0%A→5.0%A;77~80 min,5.0%A);柱温为35℃;流速为0.9 mL/min;检测波长为265 nm;进样量为10 μL。
2.3 溶液的制备
2.3.1 对照品溶液 分别精密称取芦丁、橙皮苷、丹酚酸B、槲皮素、水飞蓟宾、木犀草素、橙黄决明素、23-乙酰泽泻醇C、柴胡皂苷b2对照品各适量,置于5 mL量瓶中,加甲醇定容,摇匀,得上述成分质量浓度分别为0.322、0.145、0.243、0.128、0.998、0.516、0.165、0.161、0.112 mg/mL的单一对照品储备液。分别吸取上述对照品储备液100、200、100、200、20、50、200、200、200 μL 置于同一5 mL量瓶中,加甲醇定容,摇匀,即得混合对照品溶液。
2.3.2 HQHD供试品溶液 将不同批号的8味饮片随机组合成10个不同批次的HQHD样品(编号S1~S10),其中各批次原方混煎(编号YH-1~YH-10)、原方单煎(编号YD-1~YD-10)、炮制混煎(编号PH-1~PH-10)、炮制单煎(编号PD-1~PD-10)样品的饮片组成及来源同相应批次的HQHD样品,具体批号见表1。

表1 10批HQHD样品中各饮片的批号信息
按处方量精密称定各饮片,混合,放入锅中,按本课题组前期所得最优工艺煎煮,水煎液于50℃下浓缩至400 mL,取10 mL于25 mL量瓶中,用75%甲醇定容,摇匀,滤过,续滤液经0.45 μm微孔滤膜滤过,即得原方混煎供试品溶液。按处方量分别精密称定与上述样品等量的饮片,分置于烧杯中,按上述最优工艺煎煮,混合各水煎液,于50℃下浓缩至400 mL,取10 mL于25 mL量瓶中,用75%甲醇定容,摇匀,滤过,续滤液经0.45 μm微孔滤膜滤过,即得原方单煎供试品溶液。取泽泻、丹参、郁金、柴胡炮制品,其余药材取生品,按上述原方混煎供试品方法制备炮制混煎供试品溶液,按上述原方单煎供试品方法制备炮制单煎供试品溶液。
2.3.3 HQHD单味饮片供试品溶液及阴性溶液 按处方量精密称取泽泻、丹参、郁金、柴胡、山楂、海藻、决明子、水飞蓟饮片,按“2.3.2”项下方法制得HQHD各单味饮片供试品溶液和分别缺泽泻、郁金、水飞蓟、山楂、决明子、海藻、丹参、柴胡的阴性溶液。
2.4 指纹图谱的建立
2.4.1 精密度试验 取同一HQHD供试品溶液(YH-1),按“2.2”项下色谱条件连续进样6次,记录HPLC图。以丹酚酸B峰(保留时间适中,峰面积较大且分离度良好)为参照峰,计算得到各共有峰相对保留时间的RSD为0.01%~0.04%(n=6),相对峰面积的RSD为1.04%~2.69%(n=6),表明方法精密度良好。
2.4.2 稳定性试验 取同一HQHD供试品溶液(YH-1),置于HPLC仪进样盘中,分别在放置0、2、4、8、12、24 h时按“2.2”项下色谱条件进样测定,记录HPLC图。以丹酚酸B峰为参照峰,计算得到各共有峰相对保留时间的RSD为0.01%~0.04%(n=6),相对峰面积的RSD为0.52%~1.83%(n=6),表明供试品溶液在该条件下放置24 h内稳定。
2.4.3 重复性试验 按“2.3.2”项下方法制备HQHD供试品溶液(YH-1),共6份,按“2.2”项下色谱条件进样测定,记录HPLC图。以丹酚酸B峰为参照峰,计算得到各共有峰相对保留时间的RSD为0.01%~0.09%(n=6),相对峰面积的RSD为1.12%~3.29%(n=6),表明方法重复性良好。
2.4.4 HPLC指纹图谱的建立 取“2.3.2”项下HQHD原方混煎、原方单煎、炮制混煎、炮制单煎各10个批次的供试品溶液,按“2.2”项下色谱条件进样测定,记录HPLC图。将所得图谱信息导入《中药色谱指纹图谱相似度评价系统(2012版)》,以各类样品的首批图谱(色谱峰分离度好且出峰稳定)为参照图谱,设置时间窗宽度为0.1 min,采用中位数生成法进行多点校正和全谱峰匹配,生成HQHD原方混煎、原方单煎、炮制混煎、炮制单煎的叠加指纹图谱及相应的对照指纹图谱(R),见图1。由图1可知,HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品的叠加指纹图谱均各有37个共有峰。通过匹配分离度较好的共有峰获得共有峰模式(图2A),通过比对混合对照品溶液的HPLC图(图2B),共指认出9个共有峰:12号峰为芦丁、13号峰为橙皮苷、16号峰为丹酚酸B、20号峰为槲皮素、22号峰为水飞蓟宾、23号峰为木犀草素、29号峰为橙黄决明素、34号峰为23-乙酰泽泻醇C、35号峰为柴胡皂苷b2。

图1 10批HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品的叠加指纹图谱和对照指纹图谱

图2 共有峰模式和混合对照品溶液的HPLC图
2.4.5 共有峰归属 取HQHD原方混煎样品(YH-1)和泽泻、丹参、郁金、柴胡、山楂、海藻、决明子、水飞蓟单味饮片,分别按“2.3.2”“2.3.3”项下方法制备供试品溶液和各阴性溶液,再按“2.2”项下色谱条件进样测定,记录HPLC图。通过与色谱峰的保留时间和紫外吸收图进行对比分析,初步对37个共有峰进行了归属,见图3。由图3可知,8味组方饮片对HQHD指纹图谱均有贡献,其中1号峰来自海藻、水飞蓟、泽泻、丹参,2号峰来自山楂、泽泻、水飞蓟、丹参,3、8号峰来自山楂,4号峰来自山楂、丹参、水飞蓟,5号峰来自山楂、水飞蓟,6号峰来自海藻、山楂、郁金,7号峰来自柴胡、丹参、水飞蓟,9号峰来自泽泻、水飞蓟、山楂,10、11、12、18、36号峰来自决明子、丹参,13号峰来自柴胡、丹参、山楂,14号峰来自水飞蓟、丹参,15号峰来自水飞蓟、决明子、丹参,16、19号峰来自丹参,17、20、21、24~29、32号峰来自决明子,22号峰来自水飞蓟,23号峰来自决明子、水飞蓟,30号峰来自水飞蓟、郁金,31、34号峰来自泽泻,33号峰来自决明子、泽泻,35号峰来自柴胡,37号峰来自丹参、决明子。
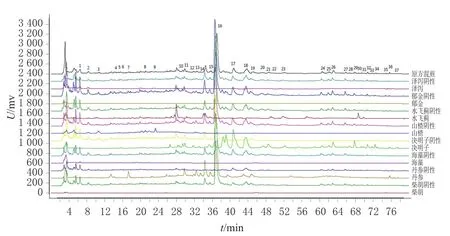
图3 HQHD共有峰归属
2.4.6 相似度分析 将HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品的图谱依次导入《中药色谱指纹图谱相似度评价系统(2012版)》,采用多点校正和Mark峰匹配计算相似度。结果,与对照指纹图谱比对,10批原方混煎样品的相似度为0.962~0.999,10批原方单煎样品的相似度为0.975~0.998,10批炮制混煎样品的相似度为0.943~0.998,10批炮制单煎样品的相似度为0.953~0.995,均在0.950以上,表明样品相似度良好,所建HQHD指纹图谱稳定、可靠,可以反映样品的特征。
2.5 化学模式识别分析
2.5.1 PCA 以10批HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品指纹图谱37个共有峰的峰面积为变量,用SIMCA-P 14.1(Demo)软件的“Pareto”功能进行预处理,经系统自动拟合后选取前2个主成分进行分析,其中第1个主成分的贡献率为44.9%,第2主成分的贡献率为19.1%;模型检验参数R2Xcum(模型对X矩阵的解释率)为0.639,模型预测参数Q2cum(原始模型预测能力)为0.514,表明该模型稳定性及预测信度良好[14]。据PCA得分图(图4)可知,原方混煎、原方单煎、炮制混煎、炮制单煎样品各自聚为一类。

图4 PCA得分图
2.5.2 炮制前后、不同煎煮方式的HQHP镜像对比 随机选取4批炮制前后、不同煎煮方式的HQHP样品的HPLC图进行镜像比较,未发现新成分(图略)。
2.5.3 PLS-DA 在PCA的基础上,以10批HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品指纹图谱37个共有峰的峰面积为变量,用SIMCA-P 14.1(Demo)软件进行有监督模式的PLS-DA,得模型检验参数R2Xcum为0.639、R2Ycum(模型对Y矩阵的解释率)为0.626,模型预测参数Q2cum为0.601,说明样品分离良好[14]。据PLS-DA得分图(图5)可知,原方混煎、原方单煎、炮制混煎、炮制单煎样品各自聚为一类,与PCA分析结果一致。
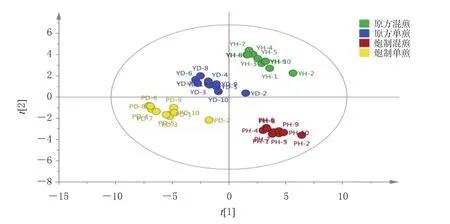
图5 PLS-DA得分图
2.5.4 差异标志物分析 为分析引起样品差异的原因和差异标志物,本研究将不同批次HQHD原方混煎、原方单煎、炮制混煎、炮制单煎样品指纹图谱37个共有峰的峰面积输入SIMCA-P 14.1(Demo)软件,建立有监督模式的PLS-DA模型。为验证所建PLS-DA模型是否存在过度拟合现象,设置分类矩阵变量随机排列200次以进行置换检验,结果R2拟合线和Q2拟合线与Y坐标轴的截距均分别小于0.3和0.05,说明所建模型可靠,不存在过度拟合现象,可用以判别分析组间差异[15]。
为确定影响样品质量的差异标志物,本研究采用变量重要性投影(variable importance in the projection,VIP)对数据矩阵进行分析,VIP图见图6。当VIP>1时,代表对应成分对样品质量具有显著影响,是潜在的差异标志物[14]。由图6A可知,1、15、17、18、36号峰对应成分和丹酚酸B(16号峰)、木犀草素(23号峰)可能是影响原方混煎与炮制混煎样品质量的差异标志物;由图6B可知,1、7、17~19号峰对应成分和丹酚酸B(16号峰)、橙皮苷(13号峰)可能是影响原方单煎与炮制单煎样品质量的差异标志物;由图6C可知,1、17~19、36号峰对应成分和丹酚酸B(16号峰)、木犀草素(23号峰)可能是影响原方单煎与原方混煎样品质量的差异标志物;由图6D可知,7、17~19、21号峰对应成分和橙皮苷(13号峰)、丹酚酸B(16号峰)、芦丁(12号峰)、木犀草素(23号峰)、橙黄决明素(29号峰)可能是影响炮制混煎与炮制单煎样品质量的差异标志物。

图6 共有峰的VIP图
3 讨论
本研究建立了不同批次HQHD样品的指纹图谱,通过相似度评价发现,各类样品与对照指纹图谱的相似度均大于或接近于0.950,表明各批次样品的整体质量稳定可靠。本研究共标记了37个共有峰;通过与混合对照品比对,共指认了9个共有峰;进一步通过色谱峰的镜像分析可知,炮制前后、不同煎煮方式的HQHD均未发现新成分,但峰面积有所变化,提示炮制和煎煮方式可能对化学成分的含量有所影响。
PCA结果发现,原方混煎、原方单煎、炮制混煎、炮制单煎样品各自聚为一类,说明各类样品间存在差异,炮制和煎煮方式的影响较大。进一步对两组组成相同、煎煮方式不同的原方单煎和原方混煎、炮制单煎和炮制混煎样品进行PLS-DA发现,1、17~19、36号峰对应成分和丹酚酸B、木犀草素可能是原方混煎和原方单煎样品的差异标志物(图6C),7、17~19、21号峰对应成分和橙皮苷、丹酚酸B、芦丁、木犀草素、橙黄决明素可能为炮制混煎与炮制单煎样品的差异标志物(图6D),提示1、7、21、36号峰对应成分和橙皮苷、芦丁、橙黄决明素7个成分可能是HQHD样品质量的差异性成分。结合指纹图谱结果可知,炮制后上述成分的峰面积均显著增加,且单煎大于混煎,可能与炮制过程中的成分转化、分解、物理结构改变及辅料作用等有关。
进一步对两组煎煮方式相同、组成不同的原方混煎和炮制混煎、原方单煎和炮制单煎样品进行PLS-DA发现,1、15、17、18、36号峰对应成分和丹酚酸B、木犀草素可能为原方混煎与炮制混煎样品的差异标志物(图6A),1、7、17~19号峰对应成分和丹酚酸B、橙皮苷可能为原方单煎与炮制单煎样品的差异标志物(图6B),提示7、15、19、36号峰对应成分和木犀草素、橙皮苷6个成分可能是影响HQGD样品质量的差异性成分。结合指纹图谱结果可知,炮制后单煎样品中上述成分的峰面积均显著增加,可能与不同的煎煮方式会通过改变溶剂的pH、黏度和溶质的旋光度、渗透压、荷电情况等属性来影响成分的溶解度,或与其他溶质发生相互作用而导致成分水溶性递减等因素有关。但1、7、15、19、21、36号峰对应成分还需借助高分辨质谱、核磁共振等技术进行鉴定。
在NASH发病过程中,首先是各种原因造成的肝脏内脂肪酸增多,多余的游离脂肪酸与甘油发生酯化反应生成三酰甘油,导致肝脏脂肪堆积;随后在脂肪的浸润下,肝细胞更易受到脂肪因子和氧化应激等因素的打击,从而发生损伤,最终发展为NASH[16]。此外,肝脏脂肪堆积也与总胆固醇水平密切相关:总胆固醇与低密度脂蛋白结合后可被肝细胞排出;当该过程发生障碍时,大量的总胆固醇在肝脏中堆积,从而引起肝脏脂肪变性[17]。有研究指出,芦丁能够激活脂肪变性人肝细胞HepG2中过氧化物酶体增殖物激活受体α的转录和翻译,进而促进其靶因子肉毒碱棕榈酰转移酶的转录,加速脂肪酸的降解代谢,抑制三酰甘油的合成,提示该成分对非酒精性脂肪性肝病具有一定的治疗作用[18];橙皮苷可通过抗脂质过氧化对肝纤维化大鼠发挥保护作用[19];橙黄决明素可通过调节脂肪酸的代谢来发挥较强的调脂作用,从而降低大鼠总胆固醇、三酰甘油和低密度脂蛋白水平,提高高密度脂蛋白水平[20]。基于上述文献,笔者推测上述成分在炮制、煎煮过程中的变化可能会导致HQHD药效的改变,但仍需后续研究予以验证。
综上所述,本文所建HQHD指纹图谱方法稳定、可靠;木犀草素、橙皮苷等是不同煎煮方式样品的质量差异成分,芦丁、橙皮苷、橙黄决明素等是炮制与否样品的质量差异成分。本实验结果能较为全面地探讨炮制和煎煮方式对HQHD的影响,但中药复方化学成分复杂,本研究仅对共有峰进行了初步分析,后期可加强对其他未知差异性成分的识别,并跟踪其体内代谢过程,通过比较入血成分含量、组织分布、代谢等情况探讨炮制和煎煮方式对中药复方体内行为的影响,以期为中药炮制理论、临床药效提供更多依据。
