加味塔布森-2提取工艺优化及其对破骨细胞分化的抑制作用Δ
2022-08-26郭姝宋清翔董睿封千喜薛培凤董馨内蒙古医科大学药学院呼和浩特010110
郭姝,宋清翔,董睿,封千喜,薛培凤,董馨(内蒙古医科大学药学院,呼和浩特 010110)
蒙药加味塔布森-2(modified Tabusen-2,MT-2)是我国蒙古族治疗骨科疾病的传统验方,由蓝刺头、杜仲、红花、三七、珍珠5味药材构成,用于治疗骨质疏松、软组织挫伤等,具有良好的临床疗效[1-2]。MT-2原剂型是以药材打粉混合而成的散剂,患者用药依从性差,加之方中各味药材未经提取,不利于有效成分的吸收。复方制剂所含成分复杂,且具有多成分、多靶点协同起效的特点[3-4]。既往关于复方提取工艺优化的研究大多未能将有效成分含量与药效关联起来,对提取工艺优劣的评价过于片面,造成成分与疗效脱节[5]。因此,开展MT-2成分、疗效、提取工艺的关联研究,对阐明MT-2的治疗作用至关重要。为此,本研究拟借助网络药理学方法,挖掘MT-2方中的有效成分,并以此作为MT-2提取工艺优劣的评价指标,采用Box-Behnken设计-响应面法考察各因素对提取工艺的影响;同时,拟通过破骨细胞模型来验证最优工艺所得提取物对破骨细胞分化的抑制活性,以期克服既往研究成分与疗效脱节的不足,为建立MT-2规范化生产工艺提供可靠的实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括LC-2030C 3D型高效液相色谱仪(日本Shimadzu公司)、Heraeus HERAcell 150i型细胞培养箱(美国Thermo Fisher Scientific公司)、Spectra Max i3x型酶标仪[美谷分子仪器(上海)有限公司]、DMi8型倒置荧光显微镜(德国Leica公司)等。
1.2 主要药品与试剂
蒙药蓝刺头药材于2020年8月采自内蒙古呼和浩特市武川县,经内蒙古医科大学药学院薛培凤教授鉴定为菊科植物驴欺口Echinops latifolius Tausch.的干燥花序。杜仲、红花药材和三七粉均购自亳州抱朴药业有限责任公司,珍珠购自北京同仁堂股份有限公司,经内蒙古医科大学药学院薛培凤教授鉴定均为真品。
绿原酸对照品(批号SH18071907,纯度≥98.0%)、松脂醇二葡萄糖苷对照品(批号SH19102403,纯度≥98.0%)、异绿原酸A对照品(批号SH20092505,纯度≥98.0%)、1,5-二咖啡酰奎宁酸对照品(批号SH20200429,纯度≥98.0%)、羟基红花黄色素A对照品(批号SH19082807,纯度≥98.0%)、人参皂苷Rg1对照品(批号SH19040208,纯度≥98.0%)、人参皂苷Rb1对照品(批号SH19012107,纯度≥98.0%)均购自北京赛百草科技有限公司。
核因子κB受体激活蛋白配体(receptor activator of nuclear factor-κB ligand,RANKL)购自美国R&D System公司;TRAP染色试剂盒购自美国Sigma-Aldrich公司;DMEM培养基和胎牛血清均购自美国Gibco公司;CCK-8试剂盒购自日本DOJINDO公司。其余试剂包括甲醇(色谱纯)、无水乙醇(分析纯)、甲酸(分析纯)等,水为纯净水。
1.3 细胞
小鼠单核巨噬细胞RAW264.7购自中国科学院细胞库。
2 方法与结果
2.1 指标性成分的确定
2.1.1 网络药理学筛选 以TCMSP数据库(http://tcmspw.com/tcmsp.php)、SymMap数据库(https://www.symmap.org)和 ETCM 数 据 库(http://www.nrc.ac.cn:9090/ETCM)为依据,检索MT-2各药材所含化合物,经活性靶点筛选、去重后,共得到方中活性化合物257个、对应靶点931个。借助DisGeNET数据库(https://www.disgenet.org)筛选骨质疏松相关基因,共获得该疾病相关基因3 704个。采用Venny 2.1.0在线工具(https://bioinfogp.cnb.csic.es/tools/venny)绘制成分靶点与疾病靶点交集的韦恩图,共获得交集靶点470个。采用CytoScape软件绘制方中活性化合物与470个交集靶点的网络图,计算各成分与交集靶点的关联度(即度值)。使用Cyto-Scape软件的“Network Analyzer”功能对网络图进行分析,明确与交集靶点有相互作用的活性成分。结果显示,人参皂苷Rg1、人参皂苷Rb1、1,5-二咖啡酰奎宁酸、异绿原酸A、绿原酸、松脂醇二葡萄糖苷、羟基红花黄色素A均能与20个以上的交集靶点相互作用,其度值分别为73、58、64、63、55、55、50。因此,初步确定以上成分为MT-2提取工艺评价的候选指标性成分。
2.1.2 实验验证 本课题组在预实验中采用反相高效液相色谱法对各单味药材中的成分进行了测定,发现上述方法无法对珍珠的有效成分(氨基酸类成分)进行有效定量,若采用柱前衍生化的方法,则会影响其余药材中有效成分的准确测定。结合“2.1.1”项下结果,氨基酸类成分对骨质疏松的干预并不明显,故本研究最终确定将绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1和人参皂苷Rb1作为MT-2提取工艺优化的指标性成分。
2.2 7种指标性成分含量测定方法的建立
2.2.1 色谱条件 以Thermo Hypersil GOLD C18(4.6 mm×250 mm,5 μm)为色谱柱,以甲醇(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~5 min,2%A→5%A;5~10 min,5%A→10%A;10~15 min,10%A→18%A;15~25 min,18%A→23%A;25~35 min,23%A→28%A;35~65 min,28%A→33%A;65~70 min,33%A→39%A;70~75 min,39%A→100%A);柱温为30 ℃;流速为0.6 mL/min;检测波长为203 nm(人参皂苷Rb1、人参皂苷Rg1)、277 nm(绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸)、403 nm(羟基红花黄色素A);进样量为10µL。
2.2.2 混合对照品溶液的制备 精密称取绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rb1对照品各10.00、10.54、10.90、10.31、10.20、10.20、10.10 mg,分别置于10 mL量瓶中,用甲醇溶解并定容,摇匀,即得各单一对照品溶液。分别吸取上述7种单一对照品溶液830、370、640、540、1 375、135、1 110 μL,置于同一10 mL量瓶中,加入甲醇定容,摇匀,配制成上述成分质量浓度分别为0.083、0.039、0.070、0.056、0.140、0.014、0.112 mg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备 取杜仲、蓝刺头和红花药材,于50℃下干燥2 h,粉碎,过40目筛,得实验用药材粉末。取杜仲粉末、蓝刺头粉末、红花粉末、三七粉、珍珠粉各1.6、1.2、0.8、0.4、0.1 g,精密称定,置250 mL圆底烧瓶中,按不同料液比加入不同体积分数的乙醇进行不同次数、不同时间的回流提取,滤过(由于三七、珍珠为极细粉,为避免其在提取中的损失,2味药均在末次回流时加入),合并滤液并摇匀,经0.45 μm微孔滤膜滤过,即得。
2.2.4 阴性对照溶液和空白溶液的制备 按“2.2.3”项下方法依次制得缺杜仲、缺蓝刺头、缺红花、缺三七的阴性供试品溶液。另取甲醇,作为空白溶液。
2.2.5 专属性试验 取“2.2.2”项下混合对照品溶液、“2.2.3”项下供试品溶液[乙醇体积分数60%、料液比1∶14(g/mL,下同)、提取时间90 min、提取次数2次]、“2.2.4”项下阴性对照溶液和空白溶液各适量,分别按“2.2.1”项下色谱条件进样测定,记录色谱图(图1,空白溶液色谱图略)。结果显示,阴性对照溶液和空白溶液对测定均无干扰,7个待测成分的色谱峰均能达到基线分离,说明方法专属性较好。

图1 MT-2中7种成分含量测定的高效液相色谱图
2.2.6 线性关系考察 精密吸取“2.2.2”项下的混合对照品溶液1、2、5、10、15、20、25 µL,按“2.1.1”项下色谱条件进样测定,记录峰面积。以待测成分的质量为横坐标(X)、峰面积为纵坐标(Y)进行线性回归,得7种成分的线性方程,具体结果见表1。
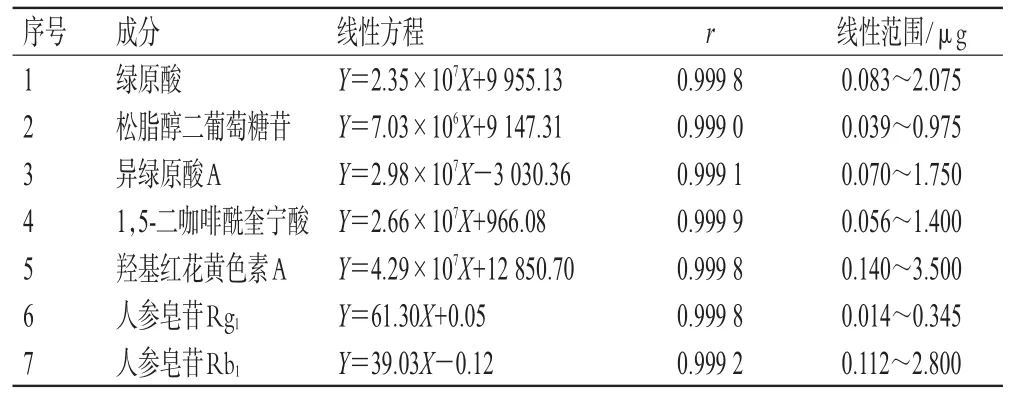
表1 7种成分的线性关系考察结果
2.2.7 精密度考察 按“2.2.5”项下条件制备供试品溶液,再按“2.2.1”项下色谱条件连续进样测定6次,计算得绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rb1峰面积的RSD分别为0.49%、1.53%、1.46%、1.23%、0.90%、0.97%、2.57%(n=6),表明方法精密度良好。
2.2.8 重复性考察 按“2.2.5”项下条件平行制备供试品溶液6份,按“2.2.1”项下色谱条件依次进样,记录峰面积,采用标准曲线法计算绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rb1的含量,得各成分含量的RSD分别为2.65%、1.47%、2.90%、1.18%、2.13%、2.79%、1.75%(n=6),表明方法重复性良好。
2.2.9 稳定性考察 按“2.2.5”项下条件制备供试品溶液,分别在(25±2)℃下放置0、2、4、6、8、10、12、24 h时按“2.2.1”项下色谱条件进样测定,计算得绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rb1峰面积的RSD分别为0.60%、0.50%、0.38%、1.14%、0.16%、1.50%、2.89%(n=8),表明供试品溶液在上述条件下放置24 h内稳定。
2.2.10 加样回收率考察 精密称定MT-2样品6份,精密加入等同于样品含有量的各对照品溶液,按“2.2.5”项下条件制成供试品溶液,再按“2.2.1”项下色谱条件进样分析,计算得绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rb1的平均加样回收率分别为98.10%、97.70%、100.96%、101.09%、97.42%、100.88%、100.68%,RSD分别为2.67%、2.74%、3.29%、1.92%、1.90%、2.07%、3.58%(n=6)。
2.3 权重系数的确定及综合评分的计算
本研究权重系数的确定参考网络药理学分析所得各成分的度值,即权重系数为各成分度值与7种成分度值之和的比值。结果显示,绿原酸、松脂醇二葡萄糖苷、异绿原酸A、1,5-二咖啡酰奎宁酸、羟基红花黄色素A、人参皂苷Rg1、人参皂苷Rg1的权重系数(记为W1~W7)分别为0.131 6、0.131 6、0.150 7、0.153 1、0.119 6、0.174 6、0.138 8;随后,按如下公式计算综合评分:综合评分=(W1×a/amax+W2×b/bmax+W3×c/cmax+……+W7×g/gmax)×100。式中,a、b、c、d、e、f、g分别为当前提取工艺下上述成分的含量;amax、bmax、cmax、dmax、emax、fmax、gmax分别为所有提取条件下上述成分的含量最大值。
2.4 单因素实验
按照“2.2.3”项下提取方法进行单因素实验。在固定其余因素的条件下,分别考察乙醇不同体积分数(20%、40%、60%、80%、100%)、料液比(1∶8、1∶10、1∶12、1∶14、1∶16)、提取时间(30、45、60、90、120 min)和提取次数(1、2、3次)4个因素对MT-2中7种成分总含量的影响,结果见图2。由图2可知,7种成分总含量分别在乙醇体积分数60%、料液比1∶14、提取时间90 min、提取次数2次的条件下达到峰值。

图2 MT-2提取工艺优化的单因素实验结果
2.5 Box-Behnken设计-响应面实验
2.5.1 工艺优选 结合单因素实验和前期预实验结果发现,当提取次数超过2次时,各成分总含量略有下降,此时再增加提取次数对各成分总含量的影响有限;同时,综合考虑提取成本等实际生产问题,在工艺优选时将提取次数固定为2次。选取乙醇体积分数(A)、料液比(B)和提取时间(C)为考察因素,以7种成分含量的综合评分为评价指标,应用Design Expert 8.0.6软件进行设计,具体因素与水平见表2,实验设计及结果见表3。

表2 MT-2提取工艺优化的因素与水平
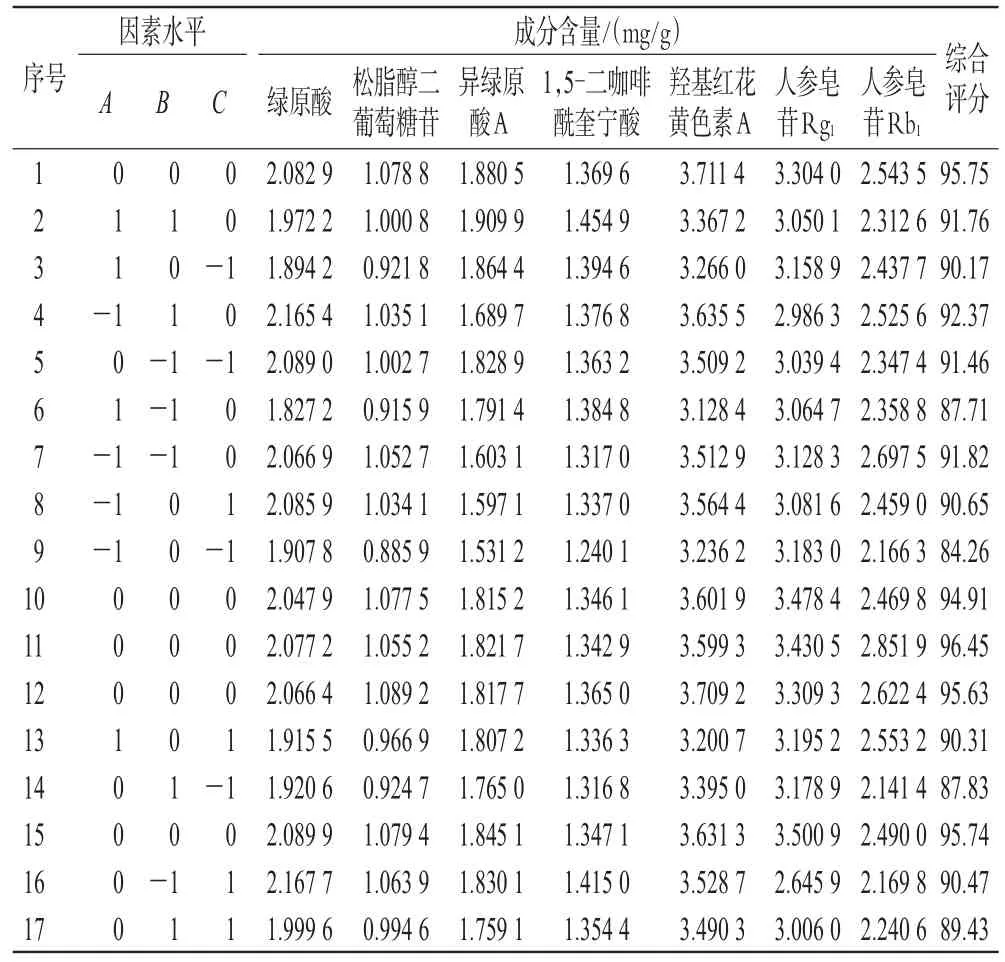
表3 MT-2提取工艺优化的实验设计及结果
2.5.2 因素交互作用分析 通过Design Expert 8.0.6软件对数据进行拟合,得多元二次方程如下:综合评分=95.70+0.11A-0.01B+0.89C+0.87AB-1.56AC+0.65BC-2.87A2-1.92B2-3.98C2,方差分析结果见表4。由表4可知,回归模型F值为3.948(P<0.05),表明模型具有显著性,可用于响应值的预测;各因素对综合评分的影响程度依次为C(提取时间)>A(乙醇体积分数)>B(料液比),其中A2、C2的影响具有显著性(P<0.05)。

表4 方差分析结果
为进一步分析各因素交互作用对综合评分的影响,本研究采用Design Expert 8.0.6软件绘制了3D响应面图和等高线图,结果见图3。研究指出,等高线的形状可反映交互作用的强弱,越趋向椭圆形表示各因素的交互作用越强,越趋向圆形则交互作用越弱[6]。由图3可知,因素A与B、A与C、B与C的交互作用均较为明显。对比A与B的交互作用发现,等高线沿A轴变化相对密集,明显密于B轴方向,表明乙醇体积分数对综合评分的影响比液料比大;同理可得,提取时间对综合评分的影响比液料比大,也比乙醇体积分数大。

图3 因素A、B、C对综合评分影响的3D响应面图与等高线图
2.5.3 最优工艺及验证 采用Design Expert 8.0.6软件求解上述多元二次方程,得MT-2最优提取工艺为乙醇体积分数59.78%,料液比1∶14.03,提取时间93.48 min。考虑到实际的可操作性,最终将工艺参数调整为乙醇体积分数60%,料液比1∶14,提取时间94 min,提取2次。根据上述最优条件,进行3次验证实验,结果见表5。由表5可知,3次验证实验的平均综合评分为95.50,与预测值(95.75)的相对误差为-0.26%,表明该方法重现性好,工艺稳定。

表5 验证实验结果
2.6 MT-2提取物对破骨细胞分化影响的考察
2.6.1 细胞培养 将RAW264.7细胞接种于含有1%青霉素-链霉素双抗和10%胎牛血清的DMEM培养基中,于37℃、5%CO2培养箱中培养(培养条件下同)。
2.6.2 MT-2提取物药液的制备 按“2.5.3”项下最优工艺提取MT-2,合并2次滤液,旋转蒸发挥去乙醇后,冷冻干燥,即得MT-2提取物冻干粉(提取率为27.0%)。取冻干粉适量,用DMEM培养基溶解,经0.45 μm滤膜滤过,取续滤液,即得。
2.6.3 MT-2提取物对细胞增殖活性的影响 采用CCK-8法进行考察。取对数生长期的RAW264.7细胞,经消化后制成单细胞悬液,以5×103个/孔接种至96孔板中,待细胞完全贴壁后,将其分为实验组和对照组,每组设置6个复孔。实验组细胞加入含不同质量浓度MT-2提取物(18.6、37.2、74.4、111.6、148.8、186.0 ng/mL,按MT-2冻干粉质量计,按“2.6.2”项下方法处理;剂量设置参考前期预实验结果)的DMEM培养基,对照组细胞加入等体积的DMEM培养基,培养48 h。弃去培养基,每孔加入CCK-8试剂适量,使用酶标仪于450 nm波长下检测各孔的光密度值。采用SPSS 22.0软件对数据进行统计分析;数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;检验水准α=0.05。结果显示,当MT-2提取物的质量浓度低于186.0 ng/mL时,其对细胞活性无明显影响(P>0.05),故在后续实验中,MT-2提取物的质量浓度不宜高于148.8 ng/mL。2.6.4 MT-2提取物对破骨细胞分化的影响 取处于对数生长期的RAW264.7细胞,经消化后制成单细胞悬液,以5×103个/孔接种至96孔板中,待细胞完全贴壁后,将其分为对照组、模型组和MT-2低、中、高质量浓度组,每组设置6个复孔。除对照组外,其余各组均加入100 ng/mL RANKL诱导以制备破骨细胞分化模型,同时各药物组加入含不同质量浓度MT-2提取物(18.6、37.2、74.4 ng/mL,按MT-2冻干粉质量计;剂量设置参考前期预实验和“2.6.3”项下结果)的DMEM培养基,对照组和模型组细胞加入等体积的DMEM培养基。培养5 d后,每孔用磷酸盐缓冲液冲洗3次,用多聚甲醛固定30 min后,再用磷酸盐缓冲液冲洗3次。参照TRAP染色试剂盒说明书配制染液并染色,于荧光显微镜下观察。以TRAP染色阳性的多核细胞(细胞核≥3)为破骨细胞,观察各组破骨细胞的分化情况。结果(图4A~图4E)显示,对照组未见明显染色区域,细胞数量少;模型组出现散在的大型细胞,且TRAP染色呈阳性,可见多核细胞,即存在明显的破骨细胞分化现象;而各药物组多为体积较小的单核圆形细胞,且TRAP染色不明显,说明MT-2提取物具有抑制破骨细胞分化的作用。

图4 MT-2提取物对破骨细胞分化和数量的影响
对破骨细胞进行计数,考察不同组别破骨细胞的增殖情况;同时,采用SPSS 19.0软件对各组破骨细胞数量进行单因素方差分析和Bonferroni检验,检验水准α=0.05。结果(图4F)显示,与对照组比较,模型组破骨细胞数量显著增多(P<0.05);与模型组比较,各药物组破骨细胞数量均显著减少(P<0.05),且这种抑制作用有随药物质量浓度增加而增强的趋势。
3 讨论
以往对于蒙药提取工艺的优化多以单因素和正交实验设计为主,对工艺优劣评价也多以单一成分或少数成分的含量为指标,未能有效关联成分含量与药物疗效[5,7-8],无法全面体现蒙药复方“多成分、多靶点整合起效”的作用特点。网络药理学是在多向药理学和系统生物学快速进步的基础上发展而来的一门从网络层面观察药物对疾病影响的新学科[9],将其用于预测蒙药复方的有效成分既能解决成分-疗效脱节难题,也能节省各单一成分药效评价的实验成本。故本研究采用网络药理学方法预测MT-2的有效成分,并以各成分的度值来赋予指标权重,不仅可综合考察MT-2成分与疾病靶点的相关性,而且可均衡评估各信息的实际重要程度,确保综合评价结果的合理性、科学性[10]。随后,本研究通过药效学实验验证了最优工艺所得MT-2提取物的有效性,初步构建了“成分-工艺-药效”的关联网络。
经查阅文献发现,本研究经网络药理学筛选所得7种有效成分中的5种在骨质疏松治疗领域具有一定活性:绿原酸可通过激活核因子E2相关因子2/血红素加氧酶1通路来抵抗地塞米松诱导的成骨细胞凋亡[11];松脂醇二葡萄糖苷可促进骨细胞的增殖[12];皂苷类成分可通过促进血管新生来发挥抗骨质疏松作用[13];羟基红花黄色素A可增强成骨细胞活性,并可促进骨矿化的发生[14]。结合网络药理学结果可认为,本研究以绿原酸等7种成分作为提取工艺评价指标,既可体现成分-药效的相关性,又有助于全面地评价提取工艺优劣。
此外,本研究采用的Box-Behnken设计-响应面法不局限于“点对点”优化,可直观阐释多种因素的交互作用[15-16]。结果显示,各因素对综合评分的影响依次为C(提取时间)>A(乙醇体积分数)>B(料液比)。究其原因,笔者认为可能与药材中有效成分的溶出度、溶胀度、溶解性有关;同时,由于有效成分的溶出度随时间延长而变化明显,因此提取时间对提取的影响更为显著;而溶胀度随水醇比例变化的速率高于溶解度随料液比变化的速率,因此乙醇体积分数对提取效果的影响大于料液比。
破骨细胞介导的骨吸收与成骨细胞介导的骨形成失衡是骨质疏松的主要发病原因[17-18]。其中,RANKL介导的破骨细胞功能失调在绝经后骨质疏松中的关键作用已被证实[19-20]。因此,抑制过度激活的破骨细胞分化是抗骨质疏松的重要途径,也是相关药物治疗效果体外评价的重要指标。本研究结果显示,RAW264.7细胞经RANKL诱导后,出现了大量的TRAP染色阳性多核细胞,即破骨细胞;而给予按最优工艺制备的MT-2提取物后,破骨细胞数量明显减少,提示该提取物可抑制RANKL诱导的破骨细胞分化,且随着给药剂量的增加,破骨细胞数量随之减少,有一定的剂量依赖趋势。
综上所述,本研究基于网络药理学方法和7种指标成分的含量对MT-2的提取进行了工艺优化,并通过破骨细胞分化实验初步验证了按最优工艺所得MT-2提取物的有效性,为解决传统工艺成分与疗效脱节难题、克服单因素实验带来的实验误差提供了参考,为MT-2新剂型的研发提供了科学依据。
