模型反应中不同酚酸物质抑制PhIP形成效果分析
2022-08-24于迪龙娟张丽雯黄嘉佳黄媛赵立春孔繁磊
于迪,龙娟,张丽雯,黄嘉佳,黄媛,赵立春,孔繁磊
(广西中医药大学药学院,广西 南宁 530200)
杂环胺(heterocyclic amines,HAs)是食品热加工过程中产生的具有致突变性和致癌性的一类化合物[1]。目前,已经鉴定出超过25种HAs化合物,分为两类:一类为氨基咔啉杂环胺(amino-carbolines);另一类为氨基咪唑氮杂芳烃(aminoimidazole-azaarenes,AIAs),AIAs类杂环胺又可分为喹啉型、喹喔啉型和吡啶型。2-氨基-1-甲基-6-苯基-咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenyl-imidazole[4,5-b]pyridine,PhIP)属于AIAs类杂环胺[2-3]。研究表明,HAs的摄入会增大患癌风险,其中来源于 PhIP 的约占一半[4-5]。Jägerstad 等[6]认为HAs化合物合成的前体物质为葡萄糖、氨基酸和肌酸,并提出了喹啉类杂环胺形成的机理。前期研究普遍认为氨基酸、肌酸和葡萄糖是PhIP的前体物质。Shioya 等[7]、Puangsombat等[8]将试验对象简化,利用氨基酸、肌酸和葡萄糖3种PhIP的前体物质建立模型反应,研究PhIP的形成机制。Manabe等[9]的研究则确认了杂环胺PhIP模型反应中的前体物质是苯丙氨酸和肌酐,而起关键作用的物质是反应过程中形成的中间体——苯乙醛。于迪[10]以苯丙氨酸和肌酐作为杂环胺PhIP模型反应中的前体物质,确定了两者最佳摩尔比,使得到的模型反应体系中PhIP生成量最高。在化学模型体系中,可以排除大量干扰因素,这有利于反应机理层面的研究,因此许多学者利用化学模型体系进行PhIP的形成机理研究[11-15]。
抑制PhIP的形成有很多途径,例如通过食品加工处理控制[16-19]、通过添加抗氧化剂控制[20-23]等。模型反应中加入酚酸类物质属于添加抗氧化剂控制途径,香辛料因富含酚酸类成分有较强的抗氧化活性,可抑制杂环胺的形成[24]。研究表明,花椒叶提取物对牛肉饼中杂环胺的生成有抑制作用,因其富含多酚类物质,具有良好的抗氧化活性[25]。鄢嫣等[26]研究发现黑胡椒乙醇提取物可以抑制PhIP的形成。包香香[27]研究发现阿魏酸、对香豆酸对罗非鱼饼中杂环胺的形成有一定的抑制作用。陈怡[28]对苦苣菜提取物进行了测定,发现提取物的主要成分为咖啡酸、绿原酸,将苦苣菜提取物添加至猪肉糜中以不同条件烘烤后,检测到的杂环胺总量有所降低。
本研究将阿魏酸、咖啡酸、对香豆酸3种单体酚酸以及混合酚酸分别添加到模型体系中,对比分析酚酸类物质抑制PhIP形成的效果,探讨酚酸类物质在模型体系中是否存在相互协同抑制作用,监控反应物和生成物的变化,推测抑制PhIP形成的反应机理,为酚酸类物质在抑制食品加工中杂环胺的形成方面的应用提供依据。
1 材料与方法
1.1 材料与试剂
PhIP标准品(色谱纯,98% ):加拿大多伦多研究化学公司;肌酐、L-苯丙氨酸(分析纯):上海麦克林生化科技有限公司;阿魏酸标准品、咖啡酸标准品、对香豆酸标准品(分析纯,≥98% ):北京索莱宝科技有限公司;甲醇(质谱纯):赛默飞世尔科技有限公司;甲酸(色谱纯):上海吉至生化科技有限公司;试验用水为去离子水。
1.2 仪器与设备
分析天平(FA1204):赛多利斯科学仪器北京有限公司;电热恒温鼓风干燥箱(DHG-9140A):上海煜南仪器有限公司;超高效液相色谱-三重四极杆串联质谱联用仪(Xevo TQ-XS):美国Waters公司;聚四氟乙烯反应管、不锈钢反应釜:广西中医药大学食品质量与安全实验室自制。
1.3 模型体系的制备
模型体系参考于迪[10]的试验方法稍作修改。
PhIP模型体系(空白组)的制备:取苯丙氨酸(0.6 mmol)-肌酐(0.6 mmol),加入 10 mL 去离子水,置于聚四氟乙烯反应管(25 mL)中,再将反应管装入不锈钢反应釜中,充分密封,在200℃下反应3.5 h。取出水浴降温后用0.22 μm微孔滤膜过滤,将所得溶液置于4℃冰箱保存。
酚酸-PhIP对照模型体系的制备:分别在单体酚酸以及不同配比的混合酚酸溶液(均为10 mL)中加入苯丙氨酸(0.6 mmol)-肌酐(0.6 mmol),建立 13种不同浓度和不同混合形式的酚酸模型体系,其中9种单体酚酸模型体系,分别为10 mL的10-8、10-9、10-10mg/mL的阿魏酸(A)、咖啡酸(B)、对香豆酸(C)。 4种混合酚酸模型体系见表1。

表1 混合酚酸模型体系Table 1 Model systems of mixed phenolic acids
1.4 检测方法
采用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)法,对模型体系中的酚酸、苯丙氨酸、肌酐以及PhIP进行定性和定量分析。参考文献[10]的方法条件并作如下调整。
液相色谱条件:检测器Waters QDa、Waters 2998 PDA检测器;色谱柱Waters CORTECSC18+(2.7 μm,2.1 mm×100 mm);进样量 5.0 μL;流速 0.2 mL/min;流动相A为甲醇,流动相B为0.1% 甲酸-水;梯度洗脱条件为0~1min5% A,1min~10min90% A,10min~14min 5% A。
质谱条件:电喷雾离子源(electron spray ionization,ESI),多反应监测模式;正、负离子扫描模式;样品温度(10.0±5.0)℃,柱温(30±5.0)℃;质量扫描范围50 amu~500 amu;离子源温度150℃;喷雾电压3 000 V;毛细管温度300℃;毛细管电压3.0 kV;脱溶剂温度550℃。
2 结果与分析
2.1 模型体系中PhIP的检测结果
PhIP的母离子与子离子的碎片质谱图见图1。
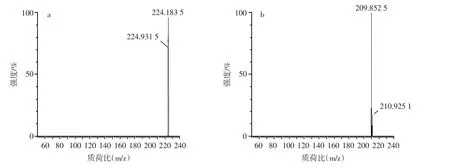
图1 PhIP的母离子与子离子碎片质谱图Fig.1 Mass spectra of parent ion and daughter ion fragments of PhIP
从图1可以看出,模型体系中PhIP在质谱检测中存在着正离子m/z=224的母离子峰,击碎此峰得到的二级碎片子离子峰m/z=210,可定性该峰的代表物质为PhIP,与文献[20]的检测结果一致。
2.2 模型体系中前体物质及酚酸物质的测定
苯丙氨酸和肌酐的出峰时间和子离子碎片质谱图见图2。阿魏酸、咖啡酸和对香豆酸的母离子碎片和子离子碎片质谱图见图3~图5。

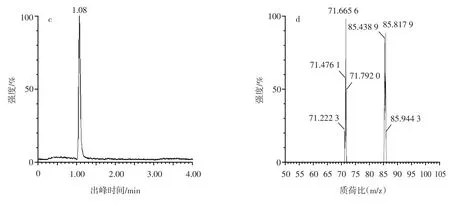
图2 苯丙氨酸和肌酐的出峰时间和子离子碎片质谱图Fig.2 Peak time and mass spectra of daughter ion fragments of phenylalanine and creatinine
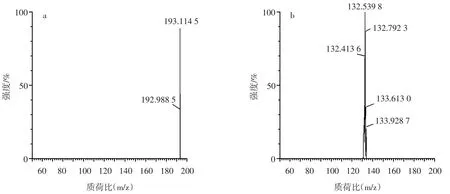
图3 阿魏酸的母离子碎片和子离子碎片质谱图Fig.3 Mass spectra of parent ion and daughter ion fragments of ferulic acid
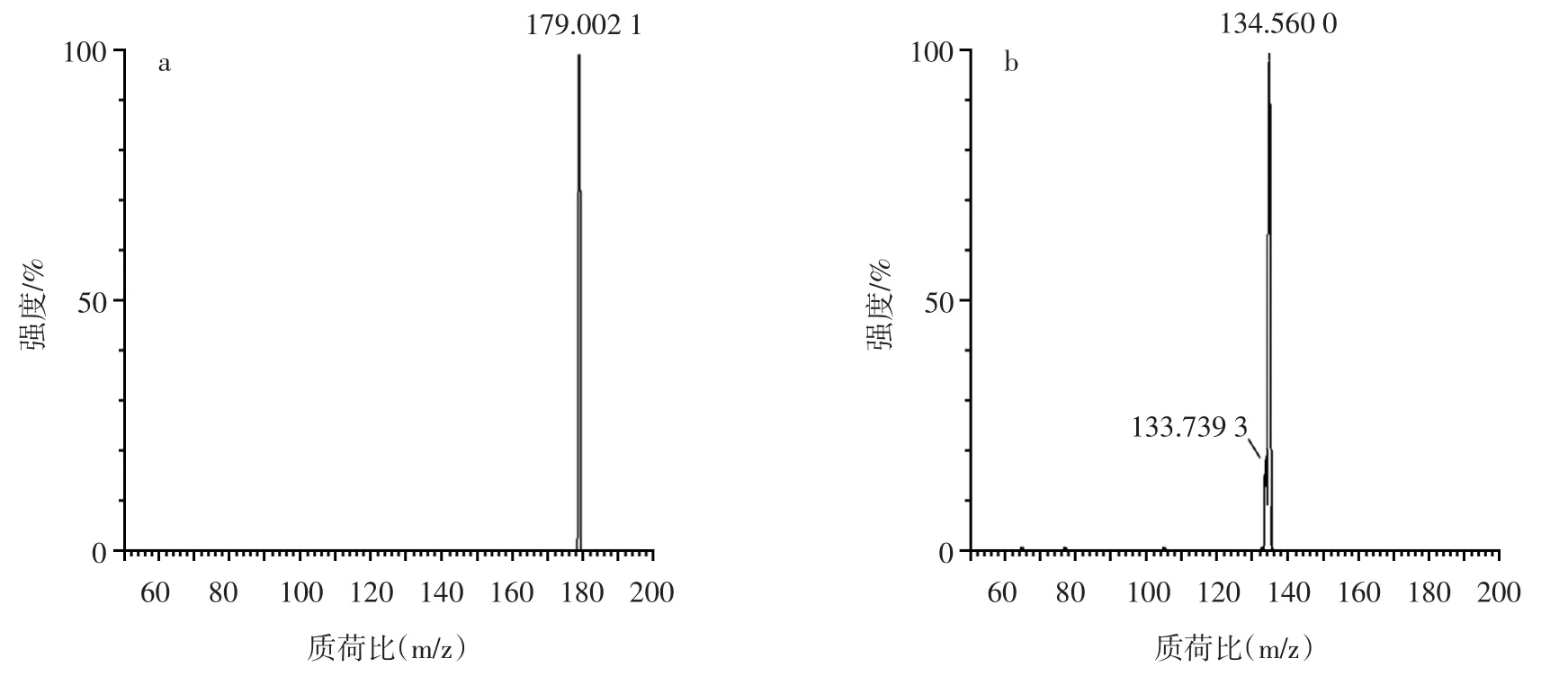
图4 咖啡酸的母离子碎片和子离子碎片质谱图Fig.4 Mass spectra of parent ion and daughter ion fragments of caffeic acid

图5 对香豆酸的母离子碎片和子离子碎片质谱图Fig.5 Mass spectra of parent ion and daughter ion fragments of p-coumaric acid
从图2可以看出,正离子扫描模式下,在UPLCMS/MS检测中于3.18 min出现m/z=166的峰,二级碎片子离子峰m/z=120,经二级质谱鉴定,可定性该峰为苯丙氨酸;在UPLC-MS/MS检测中于1.08 min出现m/z=114的峰,二级碎片子离子峰m/z=72、m/z=86,经二级质谱鉴定,可定性该峰为肌酐。从图3可以看出,负离子扫描模式下,在UPLC-MS/MS检测中,存在m/z=193的母离子峰,二级碎片子离子峰m/z=133,经二级质谱鉴定,可定性该峰为阿魏酸。从图4可以看出,负离子扫描模式下,在UPLC-MS/MS检测中,存在m/z=179的母离子峰,二级碎片子离子峰m/z=135,经二级质谱鉴定,由此可定性该峰为咖啡酸。从图5可以看出,负离子扫描模式下,在UPLC-MS/MS检测中,存在m/z=163的母离子峰,二级碎片子离子峰m/z=84,经二级质谱鉴定,可定性该峰为对香豆酸。
2.3 单体酚酸模型体系中前体物质及PhIP含量变化分析
单体酚酸模型体系中肌酐、苯丙氨酸、酚酸以及PhIP含量变化趋势见图6~图9。
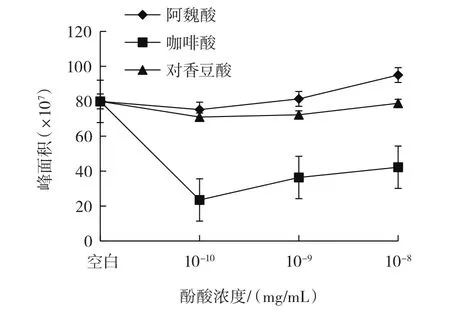
图6 单体酚酸模型体系中肌酐含量变化趋势Fig.6 Trends of creatinine content in single phenolic acids model systems
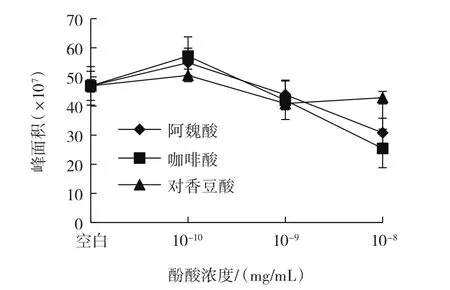
图7 单体酚酸模型体系中苯丙氨酸含量变化趋势Fig.7 Trends of phenylalanine content in single phenolic acids model systems
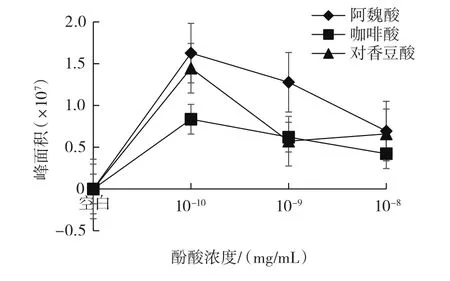
图8 单体酚酸模型体系中酚酸含量变化趋势Fig.8 Trends of phenolic acid content in single phenolic acids model systems
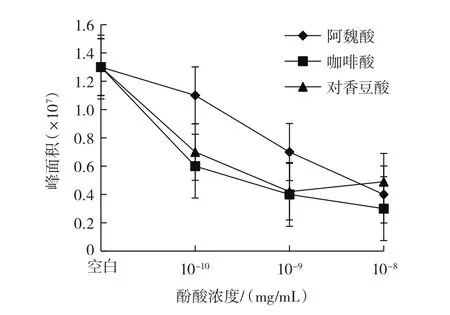
图9 单体酚酸模型体系中PhIP含量变化趋势Fig.9 Trends of PhIP content in single phenolic acids model systems
已有研究表明,模型体系中前体物质——苯丙氨酸会热降解生成苯乙醛,苯乙醛与另一前体物质——肌酐反应生成PhIP[7]。从图6可以看出,咖啡酸、阿魏酸和对香豆酸的单体模型体系中,随着酚酸的浓度增加,肌酐含量逐渐增大。从图7和图8可以看出,酚酸浓度为10-10mg/mL时,3个单体酚酸模型体系中苯丙氨酸含量均高于空白模型;咖啡酸、阿魏酸的单体模型体系中随酚酸浓度增大,苯丙氨酸含量和经过模型体系反应后的酚酸含量均降低,而对香豆酸单体模型体系中随酚酸浓度增大,苯丙氨酸含量和经过模型体系反应后的酚酸含量均呈现先下降再缓慢上升的趋势。原因可能是随着酚酸浓度的增加,酚酸与苯丙氨酸发生加合反应,生成新的化合物,阻碍了肌酐与苯丙氨酸反应生成PhIP,进而肌酐的含量会有所增加,苯丙氨酸含量整体呈降低趋势,并且使得苯丙氨酸和经过模型体系反应后的酚酸含量呈现相似的趋势。从图9可以看出,单体酚酸模型体系中PhIP的含量均比空白模型中PhIP的含量低,同时咖啡酸、阿魏酸的单体模型体系中PhIP含量随着酚酸浓度增大而逐渐降低,对香豆酸的单体模型体系中PhIP含量随着酚酸浓度增大呈现出先下降再缓慢上升的趋势。在单体酚酸模型体系的10-10mg/mL和10-9mg/mL两种酚酸浓度中,从整体效果比较,3种酚酸对PhIP形成的抑制效果由强到弱的顺序为咖啡酸、对香豆酸、阿魏酸。分析三者的化学结构可以发现,咖啡酸在苯环上有两个邻位羟基,而对香豆酸和阿魏酸均只有一个羟基,结合Salazar等[29]的研究结果:芳香环上有两个邻位羟基的酚酸对PhIP形成的抑制效果最强,而当芳香环中有烷基或羧基作为取代基时会略微降低对PhIP形成的抑制效果。所以从理论上分析咖啡酸的抑制效果最强,与本试验结果相符;当酚酸浓度增加为10-8mg/mL时,阿魏酸对PhIP形成的抑制效果强于对香豆酸,与文献[29]的研究结果相符,且当对香豆酸浓度增加到10-8mg/mL时,其对PhIP形成的抑制效果却没有随之增强,可能是对香豆酸在模型体系中生成的新化合物既对PhIP形成有抑制作用,又能减少对香豆酸的消耗。
2.4 混合酚酸模型体系的前体物质及PhIP含量变化分析
混合酚酸模型体系中肌酐、苯丙氨酸、酚酸以及PhIP含量变化见图10~图12。
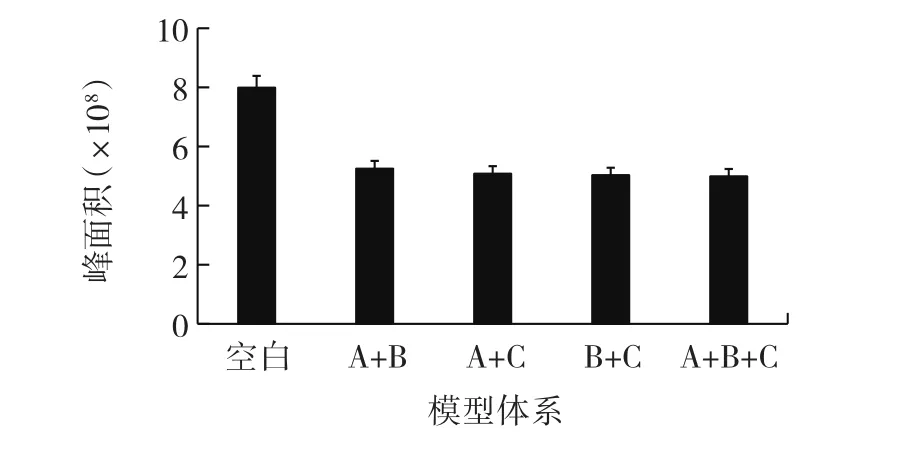
图10 混合酚酸模型体系中肌酐含量变化Fig.10 Changes in creatinine content in the model systems of mixed phenolic acids
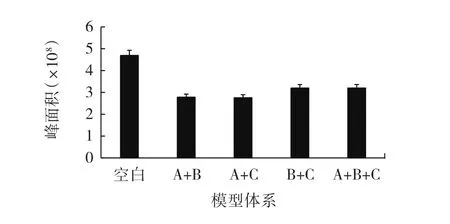
图11 混合酚酸模型体系中苯丙氨酸含量变化Fig.11 Changes in phenylalanine content in the model systems of mixed phenolic acids
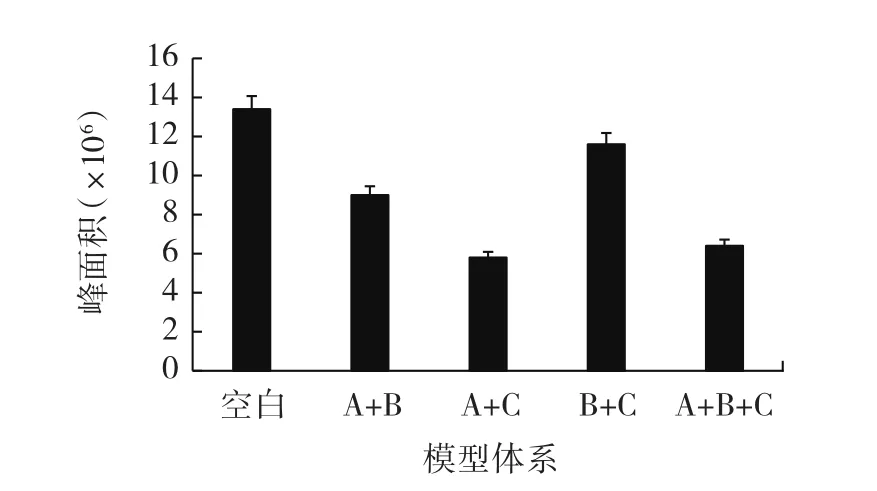
图12 混合酚酸模型体系中PhIP含量变化Fig.12 Changes in PhIP content in the model systems of mixed phenolic acids
结合单体酚酸模型体系对PhIP形成的抑制效果,阿魏酸和咖啡酸浓度均在10-8mg/mL时,对PhIP形成抑制效果最强;对香豆酸浓度在10-9mg/mL时抑制效果最强,当浓度达到10-8mg/mL时抑制效果虽有所减弱,但变化不大,为了统一混合酚酸模型体系中酚酸单体的浓度,各个酚酸单体浓度选取为10-8mg/mL。
从图10~图12可以看出,4种混合酚酸模型体系的肌酐的含量相近,说明酚酸抑制PhIP形成的化学机理与肌酐的关系不大;但对于苯丙氨酸含量而言,阿魏酸+对香豆酸(A+C)模型体系中含量最少,咖啡酸+对香豆酸(B+C)模型体系中含量最多。相较仅有一个酚羟基的阿魏酸,咖啡酸苯环上的两个羟基活性更强,而在咖啡酸+对香豆酸(B+C)的模型体系中,咖啡酸可能与对香豆酸脱羧合成新物质,消耗了酚酸,酚酸之间的协同抑制相互作用导致体系对PhIP形成的抑制效果降低;而阿魏酸+对香豆酸(A+C)体系中,阿魏酸的化学性质比咖啡酸稳定,体系中阿魏酸和对香豆酸大部分直接与苯丙氨酸或者苯乙醛反应,使得体系对PhIP形成的抑制效果明显。因此阿魏酸+对香豆酸(A+C)模型体系对PhIP抑制效果最强,PhIP生成量最低,抑制效果最弱的是咖啡酸+对香豆酸(B+C)模型体系,PhIP生成量最高。原因可能是酚酸与苯丙氨酸或者苯乙醛反应生成了新的化合物,抑制了PhIP的生成;并推测是各类酚酸之间协同作用产生的中间产物与前体物质发生反应,对PhIP形成的抑制效果产生差异,具体抑制路径需进一步分析。
2.5 单体酚酸与混合酚酸模型体系中对PhIP形成的抑制效果对比分析
单体酚酸与混合酚酸模型体系中PhIP形成的抑制率见图13。
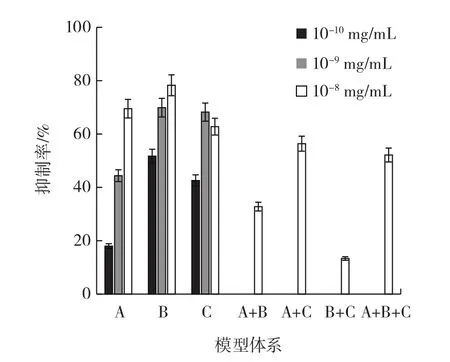
图13 模型体系对PhIP形成的抑制率对比Fig.13 Inhibition rates of phenolic acids on PhIP formation in model systems
从图13可以看出,在单体酚酸模型体系中,除对香豆酸模型体系是随着酚酸浓度增加,其抑制率先上升后下降外,其余单体酚酸模型体系的抑制率随酚酸浓度的增加均呈上升趋势;混合酚酸模型体系中抑制率最高的为阿魏酸+对香豆酸(A+C)模型体系,其抑制率为56.37% ;抑制率最低的是咖啡酸+对香豆酸(B+C)模型体系,其抑制率为13.33% 。通过分析发现,混合酚酸模型对PhIP形成的抑制率均小于单体酚酸模型体系中酚酸浓度为10-8mg/mL时的抑制率,可能是由于在混合酚酸模型体系中酚酸单体争抢PhIP前体物质——苯丙氨酸,导致混合酚酸模型体系中出现酚酸与酚酸之间相互抑制的作用,导致了混合酚酸模型体系的抑制率普遍降低的现象。
酚酸抑制PhIP形成的可能抑制机理路径见图14。
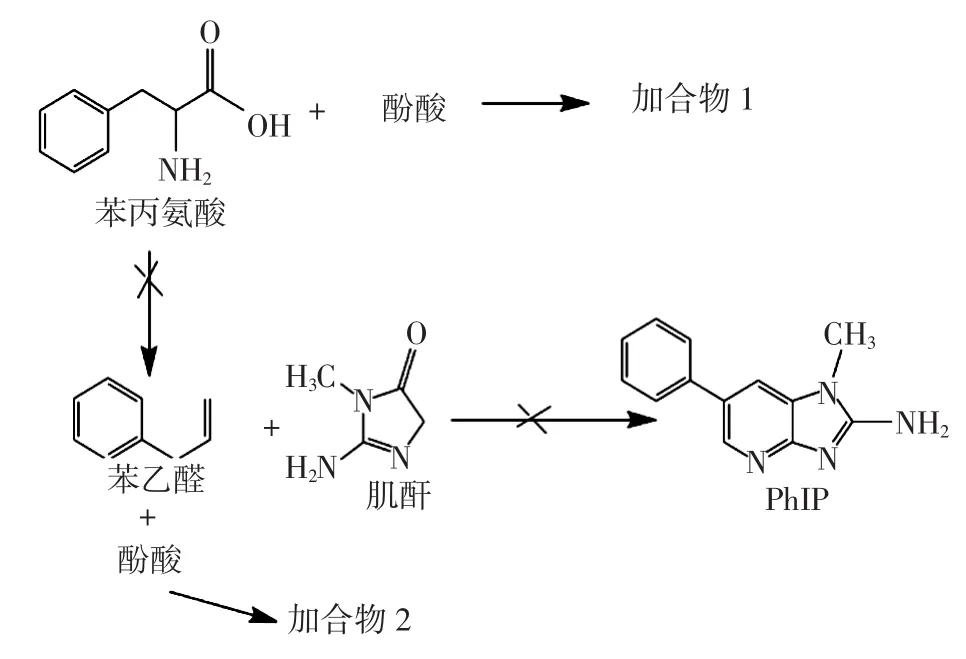
图14 酚酸抑制PhIP形成的可能抑制机理路径Fig.14 Possible pathways of phenolic acid inhibiting PhIP formation
综合所有研究数据发现酚酸物质加入模型体系后,单体酚酸模型体系随酚酸浓度增大,肌酐的含量增多,而苯丙氨酸含量整体减少;在混合酚酸模型体系中肌酐的含量相近,而苯丙氨酸含量却有较大差异。推测可能是因为加入的酚酸抑制了苯丙氨酸生成苯乙醛,或者苯丙氨酸在热降解后可能与酚酸反应生成新的化合物,致使大部分苯丙氨酸不能与肌酐反应,使得肌酐含量增多,反应通过消耗掉前体物质含量,致使PhIP生成量减少,对PhIP的抑制效果增大。相关研究[29]表明,邻、间和对二羟基苯可以抑制苯丙氨酸的降解,由此推测酚酸抑制PhIP形成的反应机理。从图14可以看出,酚酸可能在高温热反应中与PhIP的前体物质——苯丙氨酸反应形成加合物1;酚酸在高温体系中与苯丙氨酸热降解产物苯乙醛反应生成加合物2;两条路径反应消耗掉PhIP的前体物质,从而抑制PhIP的形成。
3 结论
本试验选取的阿魏酸、咖啡酸、对香豆酸在模型体系中均对PhIP的形成有抑制作用,不同的单体酚酸与混合酚酸对PhIP抑制率不同。在单体酚酸模型体系中,咖啡酸和阿魏酸模型体系的抑制率随酚酸浓度的增加均呈上升趋势;混合酚酸模型体系中阿魏酸+对香豆酸模型体系抑制率最高,阿魏酸+咖啡酸模型体系抑制率次之,咖啡酸+对香豆酸模型体系抑制率最低;综合试验数据分析,不论是酚酸单体模型体系还是混合酚酸模型体系,其抑制PhIP形成的机理与苯丙氨酸含量的变化密切相关,可能是加入的酚酸抑制了苯丙氨酸生成苯乙醛,或者与苯丙氨酸反应生成新的化合物;在混合酚酸模型体系里,推测是各类酚酸物质之间存在相互协同抑制作用导致对PhIP形成的抑制效果不同。本试验验证了酚酸类物质对PhIP形成有抑制作用,对比分析单体酚酸和混合酚酸的模型体系对PhIP形成的影响,监控整个反应过程中前体物质和生成物质的变化关系,推测出酚酸模型体系对PhIP形成的抑制路径,为酚酸类物质在抑制食品加工中杂环胺的形成应用方面提供依据。
