链格孢菌侵染采后伽师瓜抗病关键酶活性变化规律
2022-08-24曾禹睿慷白羽嘉王乾乾迪娜拉海拉提蒋莉莹刘阳冯作山
曾禹睿慷,白羽嘉*,王乾乾,迪娜拉·海拉提,蒋莉莹,刘阳,冯作山*
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052)
伽师瓜是新疆特有的一种成熟期较晚的厚皮甜瓜品种,是西北地区经济效益较好的一种农作物[1]。伽师瓜果皮呈现深绿色并覆盖有大网纹及小网纹,部分无网纹,果肉呈现橘红色且肉质松脆,口味清甜。伽师瓜的主要病害是由链格孢菌侵染采后伽师瓜所引起的黑斑病[2-3]。链格孢菌侵染伽师瓜果实后,侵染初期果实呈现水渍状湿腐,伽师瓜表面果皮变软并开始腐烂,后因链格孢菌开始产生分生孢子梗以及大量孢子,故而果实表面会形成黑色霉斑[4-7]。在病原菌开始侵染果实时,植物细胞会刺激产生几丁质酶(chitinase,CHT)及 β-1,3 葡聚糖酶(β-1,3-glucanase,GLU)以降解构成真菌细胞壁骨架的几丁质与纤维素,从而影响真菌微生物的形态形成、生理活性和生长发育等,达到抵抗病原微生物入侵的目的[8-11]。病原微生物侵染同样会激活植物体内的苯丙烷代谢过程,苯丙烷代谢是植物抵抗病原菌侵染的另一途径,通过此途径可产生一类抗病原物的化合物即类黄酮植保素及酚类物质,后者进一步氧化生成对病原菌有毒害作用的醌类物质,从而达到抗病作用[12-13]。
目前,关于链格孢菌侵染采后甜瓜的研究,多采用损伤接种的方法,此方法使得病原菌更容易侵染到果实内部,损伤接种的方法不但破坏了甜瓜果实的完整性,同时也破坏了果实抗病的第一道防线——外果皮,外果皮是果实重要的物理抗病性结构[14]。本试验采用无损接菌的方法,模拟自然环境下甜瓜果实被侵染的情况,将链格孢菌孢子悬浮液吸附在伽师瓜外果皮自然产生的大、小、无网纹处,计算病害发生率,分析苯丙烷代谢相关酶活性的变化规律以及β-1,3葡聚糖酶、几丁质酶活性的变化规律,研究不同网纹组织、不同果实组织抗病能力的差异。
1 材料与方法
1.1 试验材料
伽师瓜:采摘于新疆喀什地区伽师县,果实质量(4.0±0.5)kg、可溶性固形物含量(12.5±0.5)°Brix。
链格孢菌(Alternaria alternata):对已自然发病的伽师瓜果实进行链格孢菌的分离纯化并使用马铃薯葡萄糖琼脂培养基保存。
1.2 试剂
30% H2O2、3,5-二硝基水杨酸、丙酮、冰乙酸、结晶酚、酒石酸钾钠、L-抗坏血酸、浓盐酸、氢氧化钠、无水乙醇、无水乙酸钠、五水合四硼酸钾、亚硫酸钠(均为分析纯):天津市致远化学试剂有限公司;二甲苯、中性树胶(均为分析纯):国药集团化学试剂有限公司;几丁质、昆布多糖(均为分析纯):美国西格玛奥德里奇公司;焦碳酸二乙酯(diethypyrocarbonate,DEPC)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、脱盐蜗牛酶、β-巯基乙醇、琼脂糖:生工生物工程(上海)股份有限公司;马铃薯葡萄糖琼脂培养基:北京奥博星生物技术有限责任公司。
1.3 仪器与设备
NBCJ-B型无菌操作台、MHP-250型恒温霉菌培养箱:上海鸿都电子科技有限公司;XHF-DY型高速分散器:宁波新芝生物科技股份有限公司;TGL-16G型高速冷冻离心机:上海安亭科学仪器厂;TU-1810PC型紫外-可见分光光度计:北京普析通用公司;DZKWS-4型电热恒温水浴锅:北京市永光明医疗仪器厂。
1.4 方法
1.4.1 样品制备
1.4.1.1 伽师瓜预处理
配备2% 双氧水溶液用于伽师瓜果实表面的杀菌与清洗,重复操作3次后置于阴凉且通风处晾干备用。
1.4.1.2 网纹分级
大、小、无网纹的分级规则:伽师瓜外果皮网纹处网纹纵横比(mm)>20∶3 为大网纹组;10∶1≤伽师瓜外果皮网纹处网纹纵横比(mm)≤20∶3为小网纹组;伽师瓜外果皮以接种点为中心,半径20 mm内无网纹为无网纹组。
1.4.1.3 病原菌侵染
制备浓度为1.0×106spores/mL[8](含0.01% 吐温20)链格孢菌孢子悬浮液。
1.4.1.4 伽师瓜无损接种
接种组:取20 μL链格孢菌孢子悬浮液接种于无菌海绵布上并粘贴在伽师瓜外果皮处的大网纹、小网纹及无网纹处,各伽师瓜果实大网纹、小网纹、无网纹组均接种10个点后置于室温贮藏。
对照组:取20 μL无菌水接种于无菌海绵布上并粘贴在伽师瓜外果皮处的大网纹、小网纹及无网纹处,各伽师瓜果实大网纹、小网纹、无网纹组均接种10个点后置于室温贮藏。
1.4.1.5 取样
1.4.2 指标测定
1.4.2.1 病害发生率
对照组因接种无菌水、贮藏期间无病害,故不统计对照组病害发生率,接种组各网纹组接种点出现直径≥4.0 mm的黑色病斑即病害发生,分别统计大网纹组、小网纹组和无网纹组的病害发生率。
1.4.2.2 失重率
接种组与对照组只区分是否接种病原菌并不区分网纹,测量时均测量完整果实,利用电子秤分别称量贮藏前与贮藏后伽师瓜的质量,计算失重率。
1.4.2.3 可溶性固形物含量
接种组与对照组只区分是否接种病原菌并不区分网纹,测量时均测量完整果实,随机选择6个伽师瓜取果肉榨汁,使用折光仪测量可溶性固形物含量。
1.4.2.4 硬度
给予综合对症治疗:予阿托伐他汀钙片20 mg,1次/d口服,以降血脂;予口服降糖药或胰岛素已控制血糖;根据具体病情,给予降血压、改善脑部血液循环等治疗;再予阿司匹林肠溶片100 mg,1次/d口服。治疗3个月为1个疗程,共1个疗程。
接种组与对照组只区分是否接种病原菌并不区分网纹,测量时均测量完整果实,随机选择6个果实,使用硬度计测定硬度。
1.4.2.5 苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活性的测定
PAL活性的测定方法参照文献[15]。称取0.3g外果皮、内果皮1.5g、果肉2g,分别加入浓度为100 mmol/L、pH8.8的硼酸缓冲溶液5、5、4 mL。冰浴研磨后于4℃、12 000 r/min条件下离心30 min,上清液即粗酶液,低温保存备用。取一支试管加入3 mL浓度为50 mmol/L、pH8.8的硼酸缓冲溶液,0.5 mL浓度为20 mmol/L的L-苯丙氨酸,30℃保温10 min后加入0.5 mL酶提取液混匀,迅速测定290 nm波长下的吸光度记为OD0,将剩余混合液置于30℃下保温60 min后再次测定290 nm波长下的吸光度值记为OD1,根据吸光度的变化量计算PAL活性。
1.4.2.6 4-香豆酰辅酶A连接酶(4-coumaroyl-Coa ligase,4CL)活性的测定
4CL活性的测定参照张培岭等[12]的方法。称取外果皮0.1 g、内果皮0.5 g、果肉1 g,分别加入pH8.0的Tris-HCl缓冲溶液5.9、5.5、5.0 mL。在冰浴研磨后,于4℃、12 000 r/min条件下离心20 min,上清液即粗酶提取液。取一支试管加入1 mL酶提取液、0.45 mL浓度为5 μmol/L 的 p-香豆酸、0.45 mL 浓度为 50 μmol/L 的腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、0.45 mL浓度为1μmol/L的辅酶A、1.35mL浓度为15μmol/L的MgSO4。空白对照为不加p-香豆酸,40℃下保温10 min后立即在波长333 nm下测定吸光度。空白对照组记为OD0,试验组记为OD1,以吸光度变化量计算4CL活性。
1.4.2.7 几丁质酶(CHT)和β-1,3葡聚糖酶(GLU)活性的测定
CHT和GLU活性的测定方法参照文献[15]。
CHT活性:称取外果皮0.5g、内果皮0.5g、果肉1g,分别加入乙酸-乙酸钠缓冲溶液(含EDTA、β-巯基乙醇)5.5、5.5、5.0 mL。在冰浴研磨后,于4℃、12 000 r/min条件下离心30 min,上清液即粗酶提取液。取一支试管加入1 mL酶提取液;0.5 mL浓度为50 mmol/L、pH5.2的乙酸-乙酸钠缓冲溶液;0.5 mL浓度为10 g/L胶状几丁质悬浮液。空白组只加入1.5 mL的蒸馏水,对照组加入的酶液为沸水浴灭活5 min后的酶液。37℃保温1 h后,空白组、对照组、试验组均加入0.2 mL浓度为0.6 mol/L的四硼酸钾。再经沸水浴5 min后立即在波长585 nm下测定吸光度。对照组记为OD0,试验组记为OD1,通过吸光度差量查出标准曲线上相应的N-乙酰葡萄糖胺微摩尔数,以每秒钟每克样品中酶解胶状几丁质产生1×10-9mol N-乙酰葡萄糖胺一个CHT活性单位(U)。
GLU活性:称取外果皮0.1 g、内果皮1 g、果肉2 g,分别加入乙酸-乙酸钠缓冲溶液(含EDTA、L-抗坏血酸、β-巯基乙醇)4.9、5.0、4.0mL。在冰浴研磨后,于4℃、12 000 r/min条件下离心30 min,上清液即粗酶提取液。取一支试管加入100 μL酶提取液、100 μL浓度为4 g/L的昆布多糖、1.8 mL的蒸馏水、1.5 mL的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂;空白组不加昆布多糖以及酶液,蒸馏水为2 mL;对照组加入的酶液为沸水浴灭活5 min后的酶液。再经沸水浴3 min后冷却,加入蒸馏水定容至25 mL,混匀,立即在波长540 nm下测定吸光度。对照组记为OD0,试验组记为OD1,以吸光度变化量查出标准曲线上葡萄糖的毫克数,以每秒钟每克样品中酶解昆布多糖产生1×10-9mol葡萄糖为一个GLU活性单位(U)。
1.5 数据处理
采用IBM SPSS Statistics 26.0进行数据分析,采用Duncan法进行差异显著性分析(p<0.05,差异显著),采用Origin 2018软件进行绘图。
2 结果与分析
2.1 病害发生率
采后伽师瓜经链格孢菌无损接菌侵染后病害发生率见图1。

图1 病害发生率Fig.1 Disease incidence
如图1所示,大网纹、小网纹以及无网纹处均有黑斑病的发生,且黑斑病发生率随着贮藏时间的延长而增加,病害发生率总体呈现上升的趋势。3种网纹均在3 d时开始出现病斑,且在接种18 d时达到最大,此时大网纹组病害发生率为89.00% ,小网纹病害发生率为83.33% ,无网纹病害发生率为78.00% ,差异显著(p<0.05)。推测是由于在伽师瓜生长过程中表皮会产生一种角质膜,而这种角质膜有一定的疏水性,对链格孢菌的孢子悬浮液起到了抵抗作用[16-17]。而大网纹以及小网纹在伽师瓜的生长过程中外表皮开裂后会形成木栓,导致疏水性较差且表皮网纹下陷,易被链格孢菌附着,病害发生率随之升高[8],与本研究结果相似。
2.2 链格孢菌侵染对伽师瓜果实失重率、硬度、可溶性固形物含量的影响
2.2.1 链格孢菌侵染对伽师瓜失重率的影响
链格孢菌侵染对伽师瓜失重率的影响见图2。
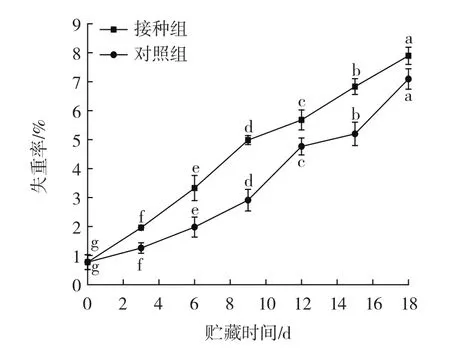
图2 链格孢菌侵染对伽师瓜失重率的影响Fig.2 Effect of Alternaria alternata infection on weight loss rate of Jiashi melon
如图2所示,采后伽师瓜经链格孢菌无损接菌侵染后,接种组与对照组伽师瓜果实失重率随着贮藏时间的延长而增加,差异显著(p<0.05)。在贮藏期达到18 d时接种组与对照组失重率最大,此时接种组失重率为7.89% ,对照组失重率为7.09% 。推测接种组失重率高于对照组的原因是伽师瓜果实的细胞壁被链格孢菌分泌的细胞壁降解酶降解,细胞内物质大量渗出,链格孢菌利用这些营养物质大量繁殖导致伽师瓜腐烂,失重率上升[18]。受粉红单端孢侵染的伽师瓜失重率呈现下降的趋势[18],与本试验研究结果相似。
2.2.2 链格孢菌侵染对伽师瓜硬度的影响
链格孢菌侵染对伽师瓜硬度的影响见图3。
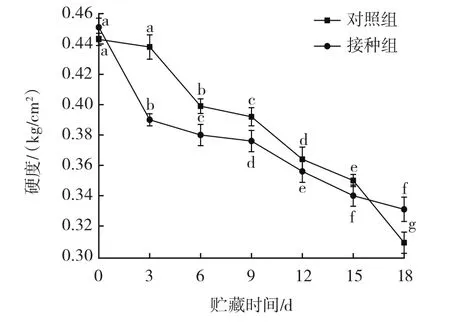
图3 链格孢菌侵染对伽师瓜硬度的影响Fig.3 Effect of Alternaria alternata infection on hardness of Jiashi melon
如图3所示,采后伽师瓜经链格孢菌无损接菌侵染后,接种组与对照组伽师瓜果实硬度随着贮藏时间的延长而降低,接种组与对照组果实硬度总体呈现下降的趋势。在贮藏期达到18 d时接种组与对照组果实硬度最小,此时接种组果实硬度为0.33 kg/cm2,对照组为0.31 kg/cm2。贮藏期间接种组硬度低于对照组的原因是,病原菌的侵染导致了伽师瓜细胞壁的降解,近而导致果实硬度降低。受粉红单端孢侵染的伽师瓜硬度呈现下降的趋势[18],与本试验研究结果相似。
2.2.3 链格孢菌侵染对伽师瓜可溶性固形物含量的影响
链格孢菌侵染对伽师瓜可溶性固形物含量的影响见图4。
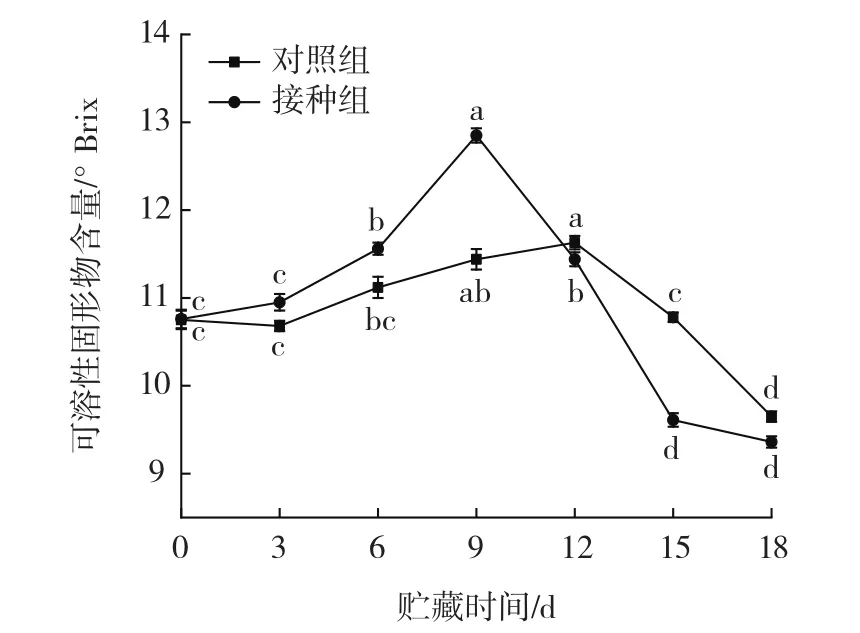
图4 链格孢菌侵染对伽师瓜可溶性固形物含量的影响Fig.4 Effect of Alternaria alternata infection on soluble solid content of Jiashi melon
如图4所示,采后伽师瓜经链格孢菌无损接菌侵染后,接种组与对照组伽师瓜果实可溶性固形物含量随着贮藏时间的延长先上升后下降。在贮藏期达到9 d时接种组可溶性固形物含量达到峰值,为12.85°Brix;对照组在12 d时达到峰值,为11.63°Brix,在18 d时接种组与对照组都达到最小值,分别为9.36、9.65°Brix。推测采后伽师瓜在贮藏期间可溶性固形物含量先升高再降低的原因,在贮藏前期属于伽师瓜的后熟阶段,此时无论是接种组还是对照组可溶性固形物含量都是呈上升的趋势,当链格孢菌开始侵染时,伽师瓜为了抵抗病原菌的侵染开始消耗果实中的可溶性固形物故而接种组的可溶性固形物含量迅速下降。受粉红单端孢侵染的伽师瓜可溶性固形物含量呈现先上升后下降的趋势[18],与本试验研究结果相似。
探究伽师瓜果实不同网纹以及不同组织部位在对病原微生物侵染的抵抗能力上的差异,可以进一步对植物抗病机制进行研究。以上试验结果表明在伽师瓜采后的病原微生物侵染阶段大网纹病害发生率最高,小网纹次之,无网纹最低,且失重率会随着贮藏时间的延长而上升,果实硬度随之下降,可溶性固形物含量因果实的后熟作用呈现先上升后下降的趋势。伽师瓜采摘后,呼吸作用成为其果实新陈代谢的主导过程[19]。呼吸作用协同伽师瓜自身酶进行生理活动,此过程会消耗伽师瓜果实中的脂肪酸以及多糖等,导致果实失去水分,硬度下降[20]。
2.3 链格孢菌侵染对伽师瓜果实苯丙烷代谢相关酶活性的影响
2.3.1 链格孢菌侵染对伽师瓜不同组织PAL活性的影响
链格孢菌侵染对伽师瓜不同组织PAL活性的影响见图5。
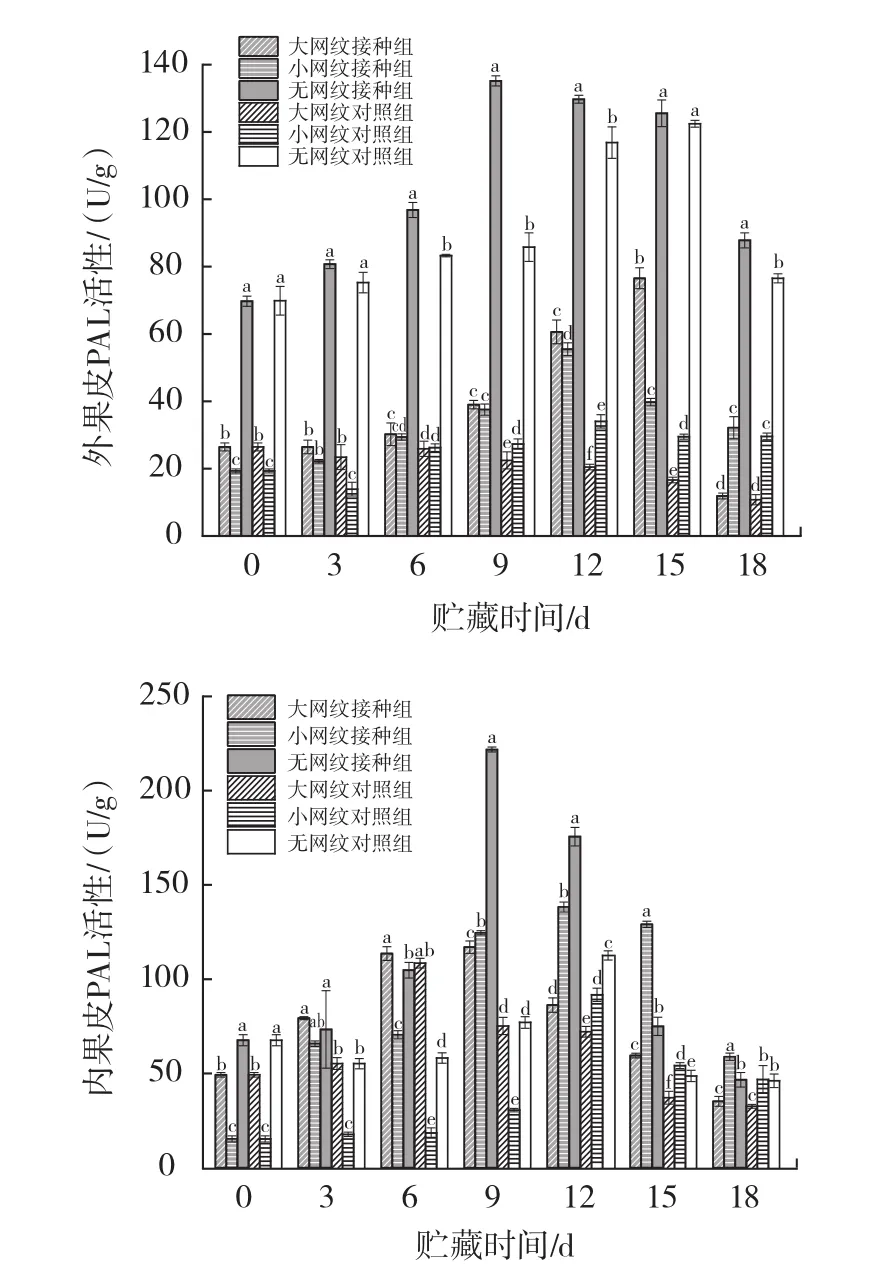
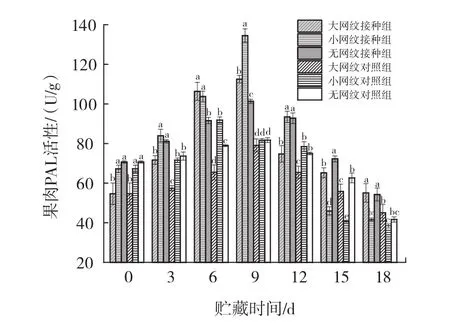
图5 链格孢菌侵染对伽师瓜外果皮、内果皮、果肉PAL活性的影响Fig.5 Effect of Alternaria alternata infection on PAL activity of exocarp,endocarp and pulp of Jiashi melon
由图5可知,链格孢菌无损侵染伽师瓜大网纹、小网纹以及无网纹的外果皮、内果皮、果肉组织,PAL活性随贮藏时间的延长呈现先上升后下降的趋势且均高于对照组。外果皮组织无网纹组酶活性最先达到峰值,其次是小网纹组、大网纹组,分别为侵染9、12、15 d,无网纹组、小网纹组、大网纹组酶活性分别为0 d时的1.93、2.86、2.89倍。内果皮组织无网纹组及大网纹组在9 d达到峰值,小网纹在侵染12 d达到峰值,此时各网纹组分别为0 d时的3.28、2.37、9.05倍。果肉组织大网纹组、小网纹组、无网纹组均在侵染9 d达到峰值,此时大网纹组、小网纹组、无网纹组酶活性分别为0 d时的2.05、2.00、1.43倍。在18 d的侵染过程中,外果皮组织无网纹组的PAL活性显著高于小网纹组和无网纹组(p<0.05);接种组内果皮组织在 3 d~6 d时大网纹PAL活性高于小网纹组、无网纹组,无显著差异(p>0.05),9 d~12 d时无网纹组 PAL 活性高于小网纹组、大网纹组,差异显著(p<0.05);接种组果肉组织9 d时小网纹组PAL酶活性最高,大网纹组次之,无网纹最小,差异显著(p<0.05)。文献[12]研究表明链格孢菌侵染会增强采后甜瓜果实PAL活性且侵染期间呈现先上升后下降趋势,与本试验研究结果相似。结合各网纹接种组病害发生率得出,无网纹接种组在受到病原菌侵染时会更快地启动苯丙烷代谢途径,增强自身的抗病性。
2.3.2 链格孢菌侵染对伽师瓜不同组织4CL活性的影响
链格孢菌侵染对伽师瓜不同组织4CL活性的影响见图6。
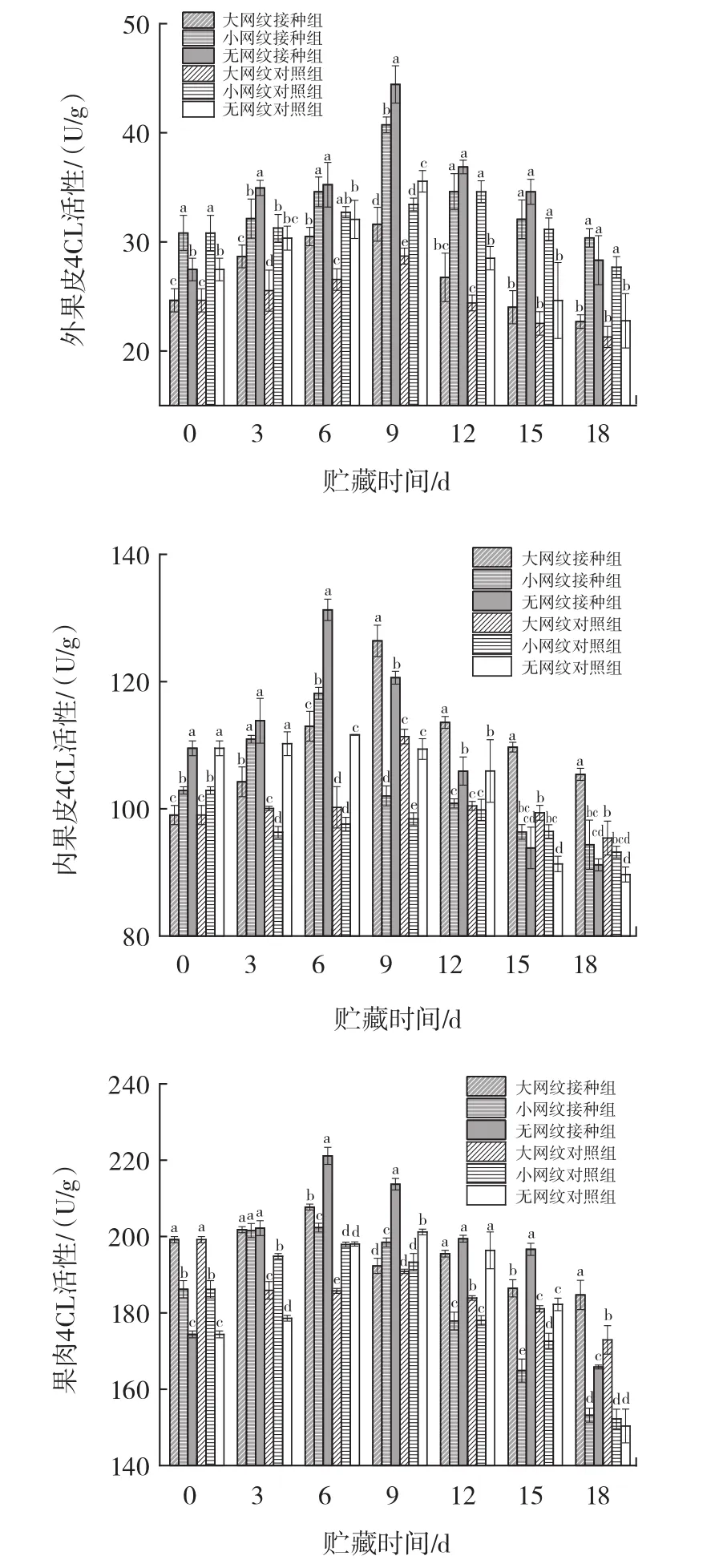
图6 链格孢菌侵染对伽师瓜外果皮、内果皮、果肉4CL活性的影响Fig.6 Effect of Alternaria alternata infection on 4CL activity of exocarp,endocarp and pulp of Jiashi melon
由图6所示,链格孢菌无损侵染伽师瓜大网纹、小网纹以及无网纹的外果皮、内果皮、果肉组织,4CL活性都随贮藏时间的延长呈现先上升后下降的趋势,且高于对照组。外果皮组织大网纹组、小网纹组、无网纹组均在侵染9 d达到峰值。无网纹组、小网纹组、大网纹组酶活性分别为0 d时的1.48、1.02、1.80倍。内果皮组织无网纹组、小网纹组4CL活性在侵染6 d达到峰值,大网纹组在9 d达到峰值,此时大网纹组、小网纹组、无网纹组分别为0 d时的1.28、1.14、1.20倍。果肉组织大网纹组、小网纹组、无网纹组4CL活性均在侵染的6 d达到峰值,此时大、小、无网纹酶活性分别为0 d时的 1.04、1.09、1.27倍。
在18 d的侵染过程中,接种组外果皮组织大网纹组4CL活性在9 d时显著高于大网纹组和小网纹组(p<0.05);接种组内果皮组织无网纹组、小网纹组4CL活性最先达到峰值,显著高于大网纹组(p<0.05);接种组果肉组织无网纹组4CL活性在6 d时显著高于大网纹组、小网纹组(p<0.05)。文献[12]研究表明,链格孢菌侵染会引起采后甜瓜果实的苯丙烷代谢通过合成类黄酮等物质增强自身的抗病性,4CL作为苯丙烷代谢过程中的最后一个酶,在侵染期间呈现先上升后下降趋势,与本试验研究结果相似。
PAL、4CL是苯丙烷代谢的关键酶,PAL作为起始酶同时也是限速酶,而4CL则是此反应的最后一个酶,苯丙烷代谢在植物抗病过程中起到了至关重要的作用,它们为类黄酮、木质素等下游产物的合成提供原料[21]。经大量试验验证植物在受到病原菌的侵染时,PAL活性有明显提高,抗病组织高于感病组织[21],因此PAL、4CL与果实的抗病性呈正相关[22-25]。
2.4 链格孢菌侵染对伽师瓜果实CHT和GLU活性的影响
2.4.1 链格孢菌侵染对伽师瓜不同组织CHT活性的影响
链格孢菌侵染对伽师瓜不同组织CHT活性的影响见图7。
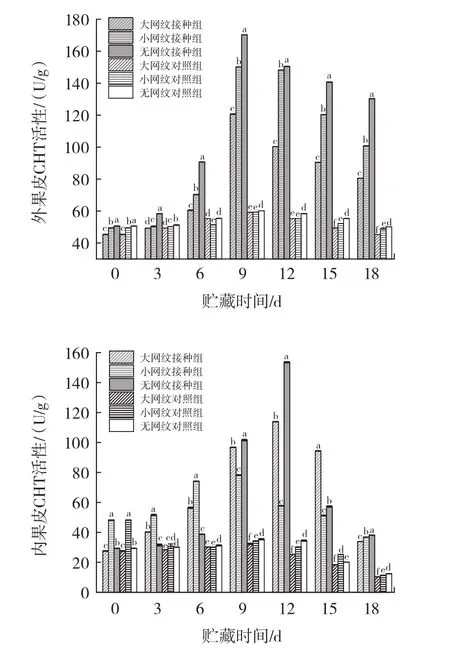
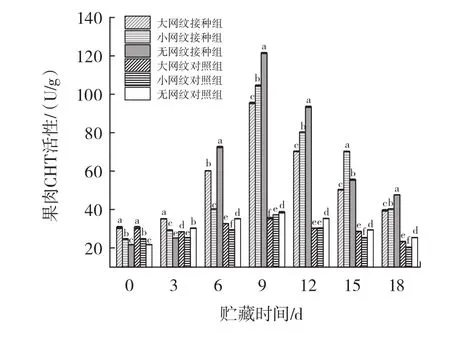
图7 链格孢菌侵染对伽师瓜外果皮、内果皮、果肉CHT活性的影响Fig.7 Effect of Alternaria alternata infection on CHT activity of exocarp,endocarp and pulp of Jiashi melon
由图7可知,链格孢菌无损侵染伽师瓜大网纹、小网纹以及无网纹的外果皮、内果皮、果肉组织,CHT活性都随贮藏时间的延长呈现先上升后下降的趋势,且均高于对照组。外果皮组织大网纹组、小网纹组、无网纹组酶活性均在侵染9 d时达到峰值,大网纹组、小网纹组、无网纹组酶活性分别为0 d时的3.37、3.04、2.66倍。内果皮组织小网纹组酶活性最先达到峰值为侵染9 d,大网纹组以及无网纹组酶活性均在12 d达到峰值,此时小网纹组、大网纹组、无网纹组别为0 d时的5.23、1.63、4.13倍。果肉组织大网纹组、小网纹组、无网纹组均在侵染9 d达到峰值,此时大网纹组、小网纹组、无网纹组酶活性分别为0 d时的5.60、4.24、3.12倍。在18 d的侵染过程中,外果皮组织无网纹组CHT活性均高于大网纹组、小网纹组;接种组内果皮组织在0~6 d时小网纹CHT活性高于大网纹组、无网纹组,显著差异(p<0.05),9 d~12 d时无网纹组 CHT 活性高于小网纹组、大网纹组,差异显著(p<0.05);接种组果肉组织在0~3 d时无网纹组CHT活性低于小网纹组、大网纹组,显著差异(p<0.05),6 d~12 d 时无网纹组CHT活性高于小网纹组、大网纹组,差异显著(p<0.05)。文献[6]研究结果表明,链格孢菌在侵染甜瓜果实后会刺激CHT的产生,并且提高自身活力,降解病原菌的细胞壁,提高自身抗病性,与本试验研究结果相似。
2.4.2 链格孢菌侵染对伽师瓜不同组织GLU活性的影响
链格孢菌侵染对伽师瓜不同组织GLU活性的影响见图8。
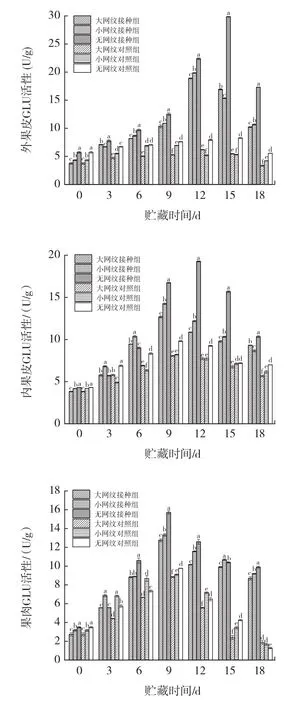
图8 链格孢菌侵染对伽师瓜外果皮、内果皮、果肉GLU活性的影响Fig.8 Effect of Alternaria alternata infection on GLU activity of exocarp,endocarp and pulp of Jiashi melon
由图8可知,链格孢菌无损侵染伽师瓜大网纹、小网纹以及无网纹的外果皮、内果皮、果肉组织,GLU活性都随贮藏时间的延长呈现先上升后下降的趋势,且均高于对照组。外果皮组织大网纹组、小网纹组在侵染12 d达到峰值,无网纹组在15 d达到峰值,大网纹组、小网纹组、无网纹组酶活性分别为0 d时的5.23、4.59、5.04倍。内果皮组织大网纹组、小网纹组在侵染9 d达到峰值,无网纹组在12 d达到峰值,此时各网纹组分别为0 d时的4.47、3.40、3.31倍;果肉组织大网纹(p<0.05)。文献[6]研究结果表明,GLU水解真菌的细胞壁,在链格孢菌侵染甜瓜果实时,甜瓜自身的GLU被刺激,产生大量代谢产物水解真菌细胞壁使其失活,提高自身抗病性,与本试验研究结果相似。
CHT与GLU是植物在抗病过程中起到反击作用的关键酶,其原理是水解构成真菌细胞壁的几丁质与葡聚糖,通过降解真菌细胞壁从而使病原菌失去致病能力,提高果实的抗病能力[26-27],果实中CHT与GLU的活性与抗病性呈正相关[28-31]。
3 结论
采后伽师瓜在贮藏期间,其自身酶进行生理活动并协同呼吸作用,消耗伽师瓜果实中的脂肪酸以及多糖等,导致果实失去水分,硬度下降,从而影响伽师瓜各项指标,接种组与对照组失重率在贮藏期间均呈现上升趋势,且接种组失重率显著高于对照组,可溶性固形物含量呈现先上升后下降的趋势,接种组变化趋势显著大于对照组,硬度在贮藏期间呈下降趋势,接种组硬度显著小于对照组。接种病原菌的3种网纹发病率,大网纹病害发生率最高,小网纹次之,无网纹最低。
苯丙烷代谢以及CHT与GLU在植物抗病过程中都起到了关键性作用,它们为类黄酮、木质素等下游产物的合成提供原料。CHT与GLU通过水解构成真菌细胞壁的几丁质与葡聚糖,通过降解真菌细胞壁从而使病原菌失去致病能力,提高果实的抗病能力。本试验通过测定采后伽师瓜不同网纹及不同组织受病原菌侵染后苯丙烷代谢相关酶以及CHT与GLU的活性,对其抗病性进行比较,得出结论:伽师瓜外果皮、内果皮、果肉均为无网纹组>小网纹组>大网纹组,且外果皮>内果皮>果肉。组、小网纹组、无网纹组均在侵染的9 d达到峰值,此时大网纹组、小网纹组、无网纹组酶活性分别为0 d时的4.50、4.20、4.66倍。在18 d的侵染过程中,接种组外果皮组织无网纹组GLU活性均高于大网纹组、小网纹组,差异显著(p<0.05);接种组内果皮组织在 3 d~6 d时无网纹组GLU活性低于小网纹组、大网纹组,9 d~15 d时无网纹组GLU活性高于小网纹组、大网纹组,差异显著(p<0.05);接种组果肉组织在 6 d~12 d时无网纹组GLU活性高于小网纹组、大网纹组,差异显著
